2. 澳门科技大学中医药学院, 中国澳门 999078;
3. 上海市新药设计重点实验室, 华东理工大学药学院, 上海 200237
2. School of Chinese Medicine, Macau University of Science and Technology, Macao 999078, China;
3. Shanghai Key Laboratory of New Drug Design, School of Pharmacy, East China University of Science and Technology, Shanghai 200237, China
近年来,随着名贵药材冬虫夏草资源的日益枯竭,通过液体发酵技术大规模生产的虫草菌丝已成为野生冬虫夏草的重要替代品[1]。至今,国家批准了5种发酵虫草制剂用于临床,分别是金水宝胶囊(国药准字Z10890003)、百令胶囊(国药准字Z10910036)、宁心宝胶囊(国药准字Z33020008)、至灵胶囊(国药准字Z33020246)和心肝宝胶囊(国药准字Z13020082)。其中,金水宝菌丝为蝙蝠蛾拟青霉菌Cs-4(Paecilomyces hepiali Chen)的发酵物,具有补益肺肾、秘精益气的功效;百令菌丝为中国被毛孢菌Cs-C-Q80(Hirsutella sinensis Liu,Guo,Yu-et Zeng)的发酵物,可补肺肾、益精气;宁心宝菌丝为虫草头孢菌(Cephalosporium sinensis Chen. sp. nov)的发酵物,主要用于治疗心律失常;至灵菌丝为孢霉属真菌(Mortierella sp.)的发酵物,具有补肺益肾的作用;心肝宝菌丝为粉红胶霉(Gliocladium roseum(Link)Thom.)的发酵物,功效为补虚损、益精气、保肺益肾、扶正固本[2]。研究表明,该类制剂源于野生冬虫夏草的菌种,因此含有与野生虫草类似的化学成分类型,如核苷类、多糖类、氨基酸类和脂肪酸类等[3]。但又由于菌株品种和培养条件不同,不同厂家生产的发酵虫草产品的化学成分种类和相对含量存在较大差异[4],因此,其药理活性也不尽相同。
随着发酵虫草制剂产值的不断提升,市场上出现了大量发酵虫草制剂的伪冒产品。在多个网购平台上,均可购买到5种国药准字制剂的替代菌丝粉。由于这些伪冒产品的菌种、生产工艺等均未得到相关部门的认可,其化学成分和药理活性与相应的药品存在较大差异,将给消费者的健康带来潜在的风险,为此,发酵虫草产品的真伪鉴别和质量评价对市场监管显得尤为重要。
中药由于其挥发性物质的差异,能呈现出不同的气味。野生冬虫夏草具有腥香气味,发酵虫草菌丝也都具有浓郁的气味,因此可以通过挥发性成分的分析,达到质量评价和真伪鉴别的目的。中药中挥发性成分的分析一般采用GC法或GC-MS法,样品的前处理是分析过程的关键步骤。常用的挥发性成分预处理方法有同时蒸馏萃取法、水蒸气蒸馏法、溶剂萃取法、超临界流体萃取法等[5-6],这些方法普遍存在样品和溶剂用量大,操作烦琐,提取溶液的再浓缩步骤易损失低沸点成分等缺点。固相微萃取技术(SPME)是1990年由Pawliszyn科研小组发明的一种样品前处理与富集萃取技术[7-8],该技术属于非溶剂型选择性萃取方法[9],它集采样、萃取、浓缩、进样等步骤于一身,具有灵敏度高,操作简便快速,成本低,环境友好等特点[10]。
SPME包括直接固相微萃取(direct-solidphase micro-extraction,DI-SPME)和顶空固相微萃取(head space-solidphase micro-extraction,HS-SPME)[11],其中HS-SPME适合分析易挥发性和半挥发性物质,它能全面快速地获得样品中挥发性物质的组成信息,广泛应用于挥发性成分的检测[12-13]。本文建立了发酵虫草菌丝粉的HS-SPME/GC-MS分析方法,对发酵虫草制剂金水宝胶囊、百令胶囊、宁心宝胶囊、至灵胶囊和心肝宝胶囊中的挥发性成分进行分析,并结合主成分分析(principal component analysis,PCA)和偏最小二乘判别分析(partial least squares-discriminant analysis,PLS-DA)这2种化学计量学方法,对不同发酵虫草产品及其真伪进行鉴别,在此基础上,进一步寻找不同发酵虫草产品中特征的差异性挥发成分,为发酵虫草制剂的质量评价提供依据。
1 仪器与材料GC-MS-QP2010plus仪(Shimadzu公司);DB-5 MS毛细管柱(30 m×0.25 μm×0.25 mm;固定相:(5%-苯基)-甲基聚硅氧烷,非极性;安捷伦公司);1 cm的PA、CAR/PDMS、PDMS/DVB、DVB/CAR-PDMS萃取头和手动SPME进样器(Supelco公司);CPA225D型分析天平[赛多利斯科学仪器(北京)有限公司];DF-101S集热式恒温加热磁力搅拌器(上海英予仪器有限公司)。
金水宝胶囊(批号131004、130913、140208,江西济民可信药业有限公司),百令胶囊(批号121243、130749、131128,杭州中美华东制药有限公司),宁心宝胶囊(批号1306002、1401001、1401003,正大青春宝药业有限公司),至灵胶囊(批号130406、130703、130902,杭州天缘药业有限公司),心肝宝胶囊(批号130407、18130101、18140104,河北长天药业有限公司);网购伪品A(蝙蝠蛾被孢霉菌粉),网购伪品B(中国被毛孢菌粉),网购伪品C(虫草头孢菌粉)。
2 HS-SPME方法精密称取胶囊内容物或粉末样品30 mg,置于8 mL低流失样品瓶内,90 ℃恒温水浴中预平衡40 min。取预先在GC进样口270 ℃老化30 min的固相萃取头,通过聚四氟乙烯隔垫插入样品瓶顶空部分,在90 ℃恒温下萃取吸附80 min后,抽出萃取头,迅速插入在预运行状态下的GC-MS进样口,于250 ℃状态下解吸2 min后,进行气质联用分析。
3 GC-MS分析条件采用DB-5 MS毛细管柱(30 m×0.25 μm×0.25 mm),氦气作载气,程序升温(初始温度40 ℃,停留5 min,以2 ℃·min-1的速度升至200 ℃,停留10 min),不分流进样,载气流速1 mL·min-1,进样口温度250 ℃,离子源温度230 ℃,接口温度250 ℃,四极杆温度150 ℃,离子源电压70 eV,质谱扫描范围m/z 30~500。
4 数据分析实验得到的GC-MS总离子流图数据通过NIST 11谱库检索定性,用峰面积归一化法计算各成分的相对含量,采用SIMCA 13.0软件进行多元化统计处理和分析。
5 结果与讨论 5.1 萃取条件的优化首先通过实验对SPME萃取头的类型(长度为1 cm的PA、CAR/PDMS、PDMS/DVB和DVB/CAR-PDMS)进行选择;结果发现,DVB/CAR-PDMS萃取头得到的HS-SPME/GC-MS的总离子流图中,挥发性成分种类最多,总峰面积最大,说明该萃取头对发酵虫草菌丝粉中的挥发性成分有较好的吸附和保留性,因此选择DVB/CAR-PDMS纤维萃取头进行后续的SPME分析。还考察了样品用量对分析结果的影响;结果表明,样品用量为10、30、50、70 mg时,挥发性物质的总峰面积基本一致,考虑到样品称量误差的控制,最终选择30 mg作为实验样品用量。
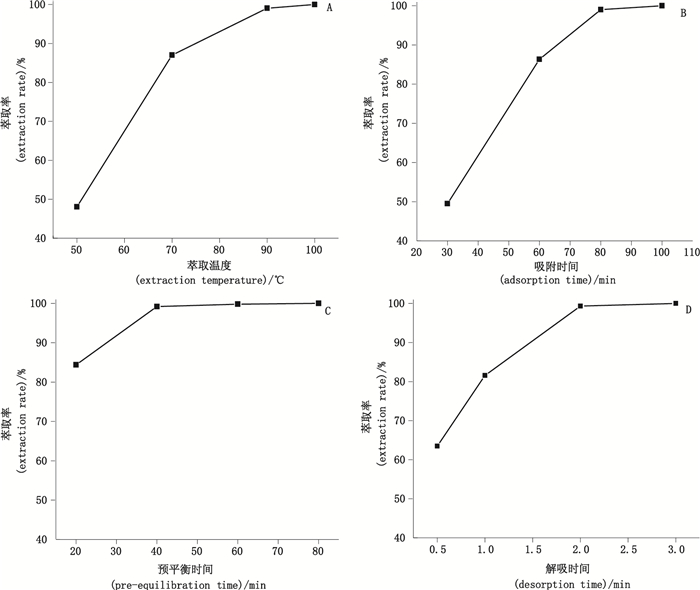
优化了萃取温度、吸附时间、预平衡时间、解吸时间等萃取条件。为消除样品不均匀性的影响,分别以各优化项目下所检出的挥发性物质的最大总峰面积作为基准计算萃取率,以萃取率为评价指标,所得结果见图 1。
|
A.萃取温度的影响:吸附时间60 min,预平衡时间60 min,解吸时间2 min(effects of extraction temperature:adsorption time 60 min,pre-equilibration time 60 min,desorption time 2 min)B.吸附时间的影响:萃取温度90 ℃,预平衡时间60 min,解吸时间2 min(effects of adsorption time:extraction temperature 90 ℃,pre-equilibration time 60 min,desorption time 2 min)C.预平衡时间的影响:萃取温度90 ℃,吸附时间80 min,解吸时间2 min(effects of pre-equilibration time:extraction temperature 90 ℃,adsorption time 80 min,desorption time 2 min)D.解吸时间的影响:萃取温度90 ℃,吸附时间80 min,预平衡时间40 min(effects of desorption time:extraction temperature 90 ℃,adsorption time 80 min,pre-equilibration time 60 min) 图 1 不同萃取条件对挥发性物质萃取率的影响 Figure 1 Effects of different extraction conditions on the extraction rate of volatile compounds |
由图 1-A可以看出,随着萃取温度的升高,发酵虫草菌粉挥发性物质的萃取率呈现上升趋势。由于温度过高可能会导致易挥发的物质在萃取头上提前解吸,或者使热稳定性低的化合物分解,所以最终选择90 ℃作为最佳萃取温度;由图 1-B可知,随着吸附时间的延长,挥发性物质的萃取率显著增大,当达到80 min后,总峰面积变化不大,表明挥发性物质吸附和解吸过程已经达到了动态平衡,因此选择80 min作为最佳吸附时间;由图 1-C可以看出,预平衡时间的变化对挥发性物质萃取率的影响不大,预平衡40 min后,挥发性物质的萃取率趋于稳定,说明菌粉中的挥发性物质达到了挥发平衡,最终选择40 min作为最佳预平衡时间;由图 1-D可知,随着解吸时间的延长,发酵虫草菌粉挥发性物质的萃取率显著增大,在2 min以后,萃取率的变化趋于平缓。考虑到样品挥发性物质的解吸是在高温下进行的,而高温可能导致挥发性物质的分解,因此在能满足挥发性物质完全解吸的条件下,解吸时间越短,对样品挥发性物质的不利影响越小,因此最终选择2 min作为最佳解吸时间。
通过对上述萃取条件的优化,最终确立的HS-SPME条件见“3”项下。
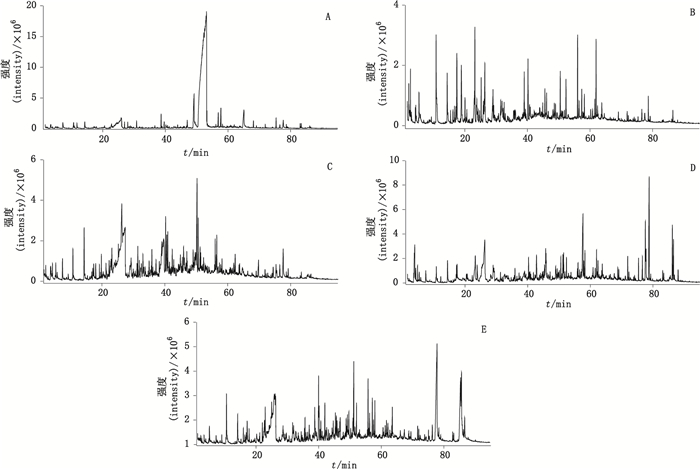
5.2 5种发酵虫草制剂的HS-SPME/GC-MS分析结果利用建立的HS-SPME/GC-MS方法,分别对金水宝胶囊、百令胶囊、宁心宝胶囊、至灵胶囊和心肝宝胶囊5种发酵虫草制剂的挥发性成分进行分析,得到的总离子流色谱图见图 2。
|
图 2 金水宝胶囊(A)、百令胶囊(B)、宁心宝胶囊(C)、至灵胶囊(D)和心肝宝胶囊(E)的挥发性物质总离子流图 Figure 2 The total ion chromatograms of volatile compounds extracted from Jinshuibao capsules(A), Bailing capsules(B), Ningxinbao capsules(C), Zhiling capsules(D) and Xinganbao capsules(E) |
通过NIST11谱库检索,鉴定了各产品中主要的挥发性成分,同时采用峰面积归一化法计算各组分的相对百分含量,鉴定结果及峰面积百分比见表 1。
|
|
表 1 固相微萃取/气-质联用分析不同菌株挥发性成分结果 Table 1 Analysis of HS-SPME/GC/MS for five fermented Cordyceps preparations |
由表 1可以看出,在金水宝胶囊、百令胶囊、宁心宝胶囊、至灵胶囊和心肝宝胶囊5种发酵虫草制剂中分别鉴定出56、71、72、81、75个化合物,分别占挥发性成分的93.6%、82.78%、84.94%、91.24%、83.9%,大体可以归为醇类、羧酸类、醛类、酚类、烃类、硫醚类、含氮杂环、吡嗪类、酮类、含氧杂环、酯类共11类化合物,且成分种类和相对含量有较大差异。金水宝胶囊的内酯类含量最高,其中的马索亚内酯占总挥发性成分的76.41%,远高于其他发酵虫草产品;百令胶囊的挥发性成分中,吡嗪类杂环化合物含量较高;宁心宝胶囊的挥发性成分中,除吡嗪类化合物以外的含氮杂环类所占比例较高;至灵胶囊的挥发性成分中,脂肪酸酯类所占比例较高;心肝宝胶囊的挥发性成分中,脂肪酸类化合物含量较高。
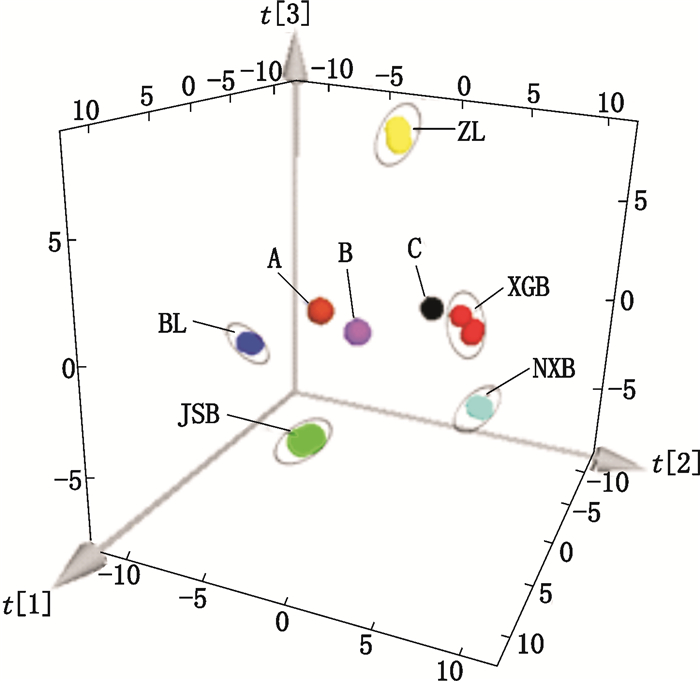
5.3 发酵虫草产品的鉴别本文通过PCA对不同发酵虫草样品的HS-SPME/GC-MS数据进行分析,以实现不同发酵虫草产品的真伪鉴别。以5种发酵虫草菌产品(各3个批次)和3种网购产品的HS-SPME/GC-MS总离子流图中各挥发性成分的峰面积百分比为特征值,利用SIMCA 13.0软件进行PCA,得到的三维图见图 3。由图 3可以看出,5种发酵虫草制剂产品金水宝胶囊、百令胶囊、宁心宝胶囊、心肝宝胶囊和至灵胶囊的3个不同批次的数据均紧簇在一起,即不同批次的产品中挥发性成分的种类和含量基本一致,表明这些发酵虫草制剂不论是在菌种特性和发酵工艺方面,均能实现稳定可控,产品的质量可靠。
|
图 3 金水宝胶囊(JSB,n=3)、百令胶囊(BL,n=3)、宁心宝胶囊(NXB,n=3)、至灵胶囊(ZL,n=3)、心肝宝胶囊(XGB,n=3)和网购产品(A、B、C)的PCA三维得分图 Figure 3 PCA score scatter 3D plot of Jinshuibao capsules(JSB, n=3), Bailing capsules(BL, n=3), Ningxinbao capsules(NXB, n=3), Zhiling capsules(ZL, n=3), Xinganbao capsules(XGB, n=3)and online shopping products (A, B and C) |
由图 3还可以看出,5种发酵虫草制剂分布在PCA三维空间的5个相对独立的区域,可得到很好的区分,表明这5种发酵制剂的挥发性物质在成分和含量上存在差异,提示挥发性成分可能是不同发酵虫草产品具有不同药理活性的物质基础之一。同时也表明,利用HS-SPME/GC-MS结合PCA方法,还可以方便地直观区分5种发酵虫草制剂产品。
对比图 3中5种发酵产品和网购产品A、B、C的相对位置发现,3种网购产品与其发酵菌株相应的制剂相距较远,表明网购产品可能并非其标示菌种发酵制得,或由于发酵工艺的不同导致挥发性化学成分的差异。由此可见,利用HS-SPME/GC-MS结合PCA方法还可以快速、方便、直观地鉴别发酵虫草产
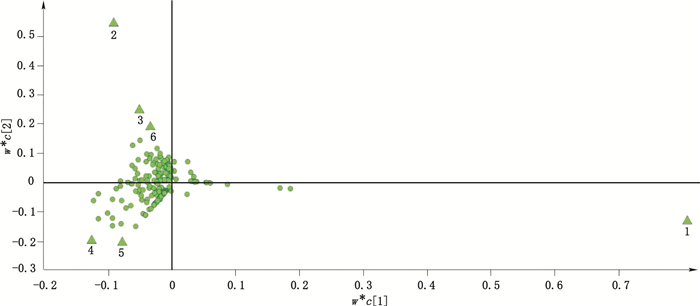
5.4 发酵虫草产品的特征性挥发成分的寻找借鉴代谢组学的研究思路,利用有监督模式的聚类分析方法PLS-DA,对5种发酵虫草制剂的HS-SPME/GC-MS数据进行分析,以寻找不同发酵虫草产品的特征性指标成分或药效成分。由PLS-DA得到载荷图如图 4所示。
|
图 4 5种发酵虫草制剂产品的载荷图 Figure 4 Loading scatter plot of five fermentation products of C. sinensis |
以PLS-DA分析得到的VIP值(变量重要性投影值)大于1.7作为显著性差异标准,并对载荷图进行筛选分析发现,有6个挥发性成分偏离了原点和主要化合物团,是对5种发酵虫草产品分离贡献较大的化合物,可作为区分不同发酵虫草制剂的标志性物质。6个差异性成分及其在发酵虫草产品中的峰面积百分比见表 2。
|
|
表 2 发酵虫草产品中的差异性成分及其在发酵虫草产品中的峰面积百分比 Table 2 Differential compounds and their peak area percentage in fermentation products of C. sinensis |
由表 2看出,经PLS-DA得到的载荷图寻找到的6个差异性成分分别为马索亚内酯、2-吡咯烷酮、棕榈酸、2,5-二甲基吡嗪、吡嗪酰胺和棕榈酸乙酯。其中马索亚内酯在金水宝胶囊挥发性成分中占极高比例,据报道,马索亚内酯具有潜在的抗真菌、抗病毒以及抗肿瘤活性[14-15],金水宝胶囊独特而广泛的药理活性可能与其有关,所以马索亚内酯可考虑作为金水宝胶囊的特征性指标成分。百令胶囊的挥发性成分中含有较高的2,5-二甲基吡嗪,但2,5-二甲基吡嗪在其他虫草产品中的相对含量也较高,因此特征性不强。与2,5-二甲基吡嗪相比,百令胶囊挥发性成分中的吡嗪酰胺更加具有特征性,并且吡嗪酰胺是一种重要的一线抗结核药物[16],因此可以考虑将吡嗪酰胺作为百令胶囊的特征性指标成分。宁心宝胶囊的挥发性成分中含有较高的2-吡咯烷酮,具有较强的特征性。2-吡咯烷酮常以药物中间体的形式进行功能化修饰,在医药行业应用广泛。至灵胶囊的棕榈酸乙酯可作为其特征的差异性指标成分;结合表 1也可以发现,至灵胶囊中脂肪酸酯类化合物所占比例较高,达27.1%。脂质是有机体的基本成分,能有效地增强细胞功能,提高细胞的代谢能力,供给人体所需的能量。心肝宝胶囊的挥发性成分中,除2-吡咯烷酮占较高比例以外,脂肪酸类化合物含量也较高。脂肪酸是重要的生物活性成分,在抗氧化、抗血酯及心肌保护等功能上具有广泛的药理作用[17],相比于其他发酵虫草制剂,心肝宝胶囊中棕榈酸的相对含量较高,棕榈酸能够降低血清中的胆固醇含量[17],可能是心肝宝胶囊中的特征性药效成分之一。
| [1] |
邹秦文, 肖新月, 林瑞超. 冬虫夏草液体深层发酵菌丝体相关制剂的研究现状[J]. 药物分析杂志, 2009, 29(4): 680. ZOU QW, XIAO XY, LIN RC. The research situation of related preparation of submerged fermentation of Cordyceps sinensis[J]. Chin J Pharm Anal, 2009, 29(4): 680. |
| [2] |
姚书文, 李钰, 陈丽华, 等. 冬虫夏草及各种发酵虫草菌粉产品药效学差异的文献研究[J]. 中国药房, 2015, 26(3): 294. YAO SW, LI Y, CHEN LH, et al. Pharmacodynamic differences in the literature research of Cordyceps sinensis and its fermented mycelium[J]. China Pharm, 2015, 26(3): 294. DOI:10.6039/j.issn.1001-0408.2015.03.02 |
| [3] |
黄慧莲, 杨敏娟, 管咏梅, 等. 近5年发酵虫草菌粉的化学成分和临床应用研究进展[J]. 世界科学技术-中医药现代化, 2014, 16(10): 2242. HUANG HL, YANG MJ, GUAN YM, et al. Review on chemical compositions and clinical application of cultured Cordyceps militaris in recent five years[J]. World Sci Technol-Mod Tradit Chin Med Mater Med, 2014, 16(10): 2242. DOI:10.11842/wst.2014.10.033 |
| [4] |
张萍, 郑天骄, 张文娟, 等. 5种发酵虫草菌丝类制剂的特征图谱及其模式识别研究[J]. 中国药学杂志, 2015, 50(4): 293. ZHANG P, ZHENG TJ, ZHANG WJ, et al. HPLC characteristic fingerprint and chemical pattern recognition of fermentation mycelium preparations[J]. Chin Pharm J, 2015, 50(4): 293. |
| [5] |
PENG F, SHENG L, LIU B, et al. Comparison of different extraction methods:steam distillation, simultaneous distillation and extraction and headspace co-distillation, used for the analysis of the volatile components in aged flue-cured tobacco leaves[J]. J Chromatogr A, 2004, 1040(1): 1. DOI:10.1016/j.chroma.2004.03.057 |
| [6] |
何颖. 中药挥发油提取方法分析[J]. 天津药学, 2015, 27(1): 47. HE Y. The analysis of methods for extracting essential oils[J]. Tianjin Pharm, 2015, 27(1): 47. |
| [7] |
ARTHUR CL, PAWLISZYN J. Solid phase microextraction with thermal desorption using fused silica optical fibers[J]. Anal Chem, 1990, 62(19): 2145. DOI:10.1021/ac00218a019 |
| [8] |
ZHANG ZY, YANG MJ, PAWLISZYN J. J.Solid-phase microextraction.A solvent-free alternative for sample preparation[J]. Anal Chem, 1994, 66(17): 844A. |
| [9] |
马继平, 王涵文, 关亚风. 固相微萃取新技术[J]. 色谱, 2002, 20(1): 16. MA JP, WANG HW, GUAN YF. New technologies of solid-phase microextraction[J]. Chin J Chromatogr, 2002, 20(1): 16. |
| [10] |
ARTHUR CL, POTTER DW, BUCHHOLZ KD, et al. Solid-phase microextraction for the direct analysis of water:theory and practice[J]. LC GC, 1992, 10(9): 656. |
| [11] |
余泽红, 贺小贤, 丁勇, 等. 固相微萃取在食品挥发性组分测定方面研究进展[J]. 粮食与油脂, 2010(7): 44. YU ZH, HE XX, DING Y, et al. Research progress on solid phase micro-extraction determination of volatile components in foods[J]. Cereals Oils, 2010(7): 44. |
| [12] |
乐之歆, 庄伟强, 黄健, 等. 固相微萃取/气-质联用分析猴头菇挥发性风味成分[J]. 食品工业, 2015, 36(9): 278. LE ZX, ZHUANG WQ, HUANG J, et al. Analysis of volatile flavors in hericium erinaceus by using solid phase microextraction combined with GC-MS[J]. Food Ind, 2015, 36(9): 278. |
| [13] |
RIU-AUMATELL M, MIRO P, SERRA-CAYUELA A, et al. Assessment of the aroma profiles of low-alcohol beers using HS-SPME-GC-MS[J]. Food Res Int, 2014, 57: 196. DOI:10.1016/j.foodres.2014.01.016 |
| [14] |
KISHIMOTO N, SUGIHARA S, MOCHIDA KYO, et al. In vitro antifungal and antiviral activities of γ-and δ-lactone analogs utilized as food flavoring[J]. Biocontrol Sci, 2005, 10(1/2): 31. DOI:10.4265/bio.10.31 |
| [15] |
BARROS ME, FREITAS JC, OLIVEIRA JM, et al. Synthesis and evaluation of (-)-massoialactone and analogues as potential anticancer and anti-inflammatory agents[J]. Eur J Med Chem, 2014, 76: 291. DOI:10.1016/j.ejmech.2014.02.013 |
| [16] |
ZHANG Y, MITCHISON D. The curious characteristics of pyrazinamide:a review[J]. Int J Tuberc Lung Dis, 2003, 7(1): 6. |
| [17] |
陈银基, 鞠兴荣, 周光宏. 饱和脂肪酸分类与生理功能[J]. 中国油脂, 2008, 33(3): 35. CHEN YJ, JU XR, ZHOU GH. Classification and physiological function of saturated fatty acids[J]. China Oil Fats, 2008, 33(3): 35. |
 2018, Vol. 38
2018, Vol. 38 
