2. 广西农业科学院水稻研究所/广西水稻遗传育种重点实验室, 南宁 530007;
3. 广西中医药大学药学院, 南宁 530001;
4. 广西大学, 南宁 530004
2. Rice Research Institute/Guangxi Key Laboratory of Rice Genetics and Breeding Guangxi Academy of Agricultural Sciences, Nanning 530007, China;
3. Guangxi University of Chinese Medicine, Nanning 530001, China;
4. Guangxi University, Nanning 530004, China
简单重复序列(simple sequence repeats,SSRs)是一种特异引物标记技术,该技术是根据微卫星序列两端的互补序列设计引物,通过反应扩增微卫星片段,用聚丙烯酞胺电泳检测扩增产物,分析不同基因型的个体在每个位点上的多态性[1]。该标记具有共显性遗传,多态性好,用量少,操作简便,重复性好,可靠性高等优点[2],已发展成为一种技术成熟、操作标准化的分子标记体系,近年来,引物标记技术已经广泛地应用于品种分类与鉴定,种质资源遗传多样性及亲缘关系分析,遗传连锁图谱构建及杂种后代检测等多个领域[3-5]。然而,广西莪术作为广西道地药材,长期以来广西莪术良种选育研究常采用常规技术[6],未见分子标志技术应用于广西莪术良种选育及遗传多样性研究。有报道显示用随机扩增多态性DNA(RAPD)、简单序列重复区间(ISSR)和序列相关扩增多态性(SRAP)标记技术等技术研究姜黄属植物种间乃至近缘属间亲缘关系,但技术的重现性较差,有较大的局限性[7-10]。本研究首次应用SSR技术对广西莪术药材进行了分析研究,分析姜黄表达序列标签(expressed sequence tag,EST)中SSR位点的分布特点,发掘SSR位点并探明其规律,开发近缘种广西莪术EST-SSR标记,探讨EST-SSR用于进行广西莪术分子育种及遗传多样性分析的可行性,拟为广西莪术种质资源和遗传多样性以及GAP研究提供一定的科学依据。
1 仪器与试药BioSpec-nano岛津生命科学紫外可见分光光度计(广州科能仪器设备有限公司);三恒电泳仪(北京六一仪器厂);GeneAmpR PCR System 9700型PCR仪(北京利超兴业科技有限公司);FA1004型电子天平(上海精科天平仪器厂),MM400冷冻混合型研磨仪(德莱驰(上海)贸易有限公司);Eppendorf M ini Spin德国艾本德高速离心机(上海创萌生物科技有限公司);HZS-H超级恒温水浴振荡器(哈尔滨市东联电子技术开发有限公司)。
供试广西莪术药材共50份(详见表 1),前期采自广西玉林、钦州、贵港、灵山、邕宁、平南等地,按编号统一种植于广西南宁仙葫区种植基地,经广西中医药大学药用植物教研室王建教授鉴定为姜科植物广西莪术(Curcuma kwangsiensis S.G.Lee C.F.Liang),从广西莪术仙湖种植基地中采集无病虫害、健壮的嫩叶,液氮冷冻后保存于-80 ℃冰箱中备用。
|
|
表 1 供试50份广西莪术种质资源基本情况 Table 1 The basic information of fifty germplasm resources of Curcuma kwangsiensis |
EST序列来源:姜黄属EST序列共计12 678条(截止2014年12月),来自于NCBI公共数据库(http://www.ncbi.nlm.nih.gov/),按关键词Curcuma longa L.进行检索并下载得到。提取缓冲液(称取2%十六烷基三甲基溴化铵(hexadecyltrimethylammonium,CTAB)2 g,20 mmol乙二胺四乙酸(ethylene diamine tetraacetie acid,EDTA 0.745 g,100 mmol·L-1三(羟甲基)氨基甲烷(Tris·HCl)1.21 g,1.4 mol氯化钠8.18 g,置于100 mL量瓶中,加蒸馏水溶解稀释至刻度,高压灭菌备用。);其他试剂:聚乙烯吡咯烷酮(PVP,德国BASF公司);核糖核酸酶A(RNase A,美国Sigma);氯仿-异戊醇(24: 1);平衡酚-氯仿(1: 1);异丙醇;TE Buffer;无水乙醇;75%冰醋酸;水为双蒸水(ddH2O);本实验所用试剂均为分析纯(上海试一化学试剂有限公司)。
2 方法 2.1 DNA提取采用改良的十六烷基三甲基溴化铵法(CTAB法)[11]提取基因组DNA。用紫外分光光度计检测DNA的质量及浓度。
2.2 EST的前处理及SSR位点筛选采用EST-trimmer软件去除载体序列及3端的Po1y A结构,使用RepeatMasker软件剔除小于100 bp的低质量序列,截短处理大于700 bp序列的3端。运用在线SSRfinder对拼接后的无冗余序列进行位点搜索,搜索标准为单核苷酸重复大于10次,二核苷酸重复大于5次,三核苷酸重复大于4次,四核苷酸重复大于3次,五核苷酸重复大于3次和六核苷酸重复大于2次。
2.3 引物设计用Primer Premier 5.0软件根据SSR的侧翼区域设计引物,引物设计原则GC含量40%~ 60%,退火温度为50~65 ℃,引物长度为18~27 bp,预期片段长度为150~280 bp。使用Oligo 6.0评估引物,挑选评分在90分以上的EST-SSR引物交由上海生工生物工程技术服务有限公司合成。
2.4 引物筛选选择表型性状差异较大的16份广西莪术品种的进行引物筛选。根据聚丙烯酰胺电泳结果,选取扩增条带清晰、重复性好、多态性高的引物记录分析。参照文献[12-13],PCR反应体系15 μL:其中DNA模板3 µL,引物l µL;2×Taq PCR MasterMix 6 µL(Taq DNA Polymerase(recombinant):0.05 units·µL-1;MgCl2:4 mmol·L-1;dNTPs(dATP,dCTP,dGTP,dTTP):0.4 mmol·L-1)。PCR扩增程序:94 ℃预变性5 min,94 ℃变性30 s,55~65 ℃退火30 s,72 ℃延伸45 s,35个扩增循环,最后72 ℃延伸10 min。
2.5 50份广西莪术材料遗传多样性分析通过引物筛选获得在试验材料中能产生较清晰主带的引物,初步认为这些引物是有效引物,适用于广西莪术材料。利用这些引物对50份莪术材料统一进行PCR扩增,统计多态性率,对结果进行多态性分析。利用NTSYS-PC 2.10软件,根据电泳结果,在相同迁移位置有带的记为1,无带的记为0,建立0、1统计数据。使用UPGMA法进行聚类分析,生成遗传关系树状图。
3 结果与分析 3.1 姜黄EST中SSR的总体特点和分布规律对姜黄属12 678条EST前处理,获得2 435条非冗余EST,其中935条序列含SSR位点,发生频率7.37%,与国外相关研究结果近似[14-15]。其中含SSR位点情况:712条序列含1个位点,163条序列含2个位点,60条序列含有3个或3个以上位点,合计1 243个SSR位点,占无冗余EST的9.60%。所有SSR位点中,712个位点完全重复,273个位点不完全重复。从分布情况看,姜黄EST不同重复类型间较大差异(表 2),不同重复核苷酸出现频率见表 2、3。
|
|
表 2 姜黄EST中SSR类型及分布频率 Table 2 The types and occurrence of SSRs in ESTs of Curcuma kwangsiensis |
|
|
表 3 SSR位点中不同重复单元出现频率 Table 3 The frequency of different repeat unit in SSR loci |
搜索出的姜黄EST-SSR中,观察统计得到SSR位点特征表,见表 4。搜索出SSR位点1 243个,其中含二核苷酸重复序列的SSR位点最多,其次是三核苷酸和四核苷酸,分别为626(50.36%)个、392(31.54%)个和128(10.30%)。二核苷酸重复中,以AT/TA和CT/GA出现频率最高,分别占SSR总数的13.84%和4.42%,其次是GA/CT(4.10%)和CA/GT(1.69%);三核苷酸重复中,CCG/GGC(2.01%)、CTT/GAA(1.61%)、CGG/GCC(1.61%)、AAT/TTA(1.37%)、TTC/AAG(1.13%)、CCA/GGT(1.13%)以较高的频率出现;四核苷酸重复中,TATA/ATAT出现频率最高,所占比例为(1.53%),其次为GAGA/CTCT(1.21%),CTCT/GAGA(1.13%);六核苷酸中,TATATA/ATATAT所占比例较高,为0.965%。
|
|
表 4 SSR位点特征 Table 4 Characteristic of SSR loci |
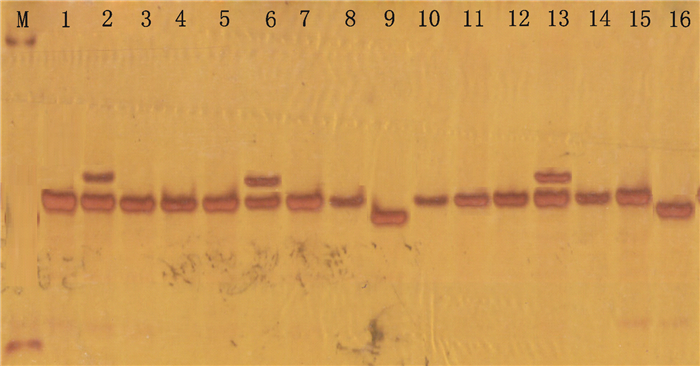
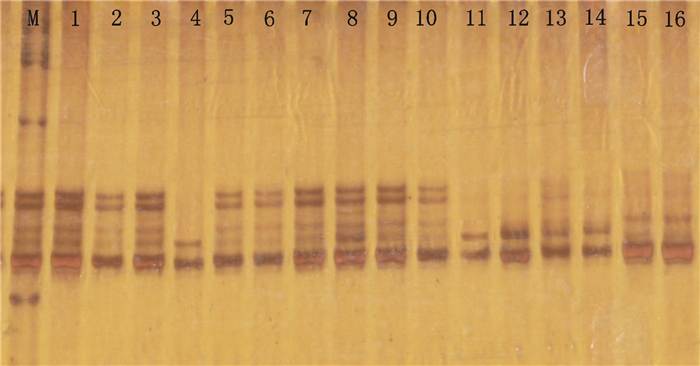
随机挑选符合筛选条件的评分90以上的126对引物合成,选用表现型差异较大的16份广西莪术品种的基因组DNA为模板对这批引物进行PCR扩增、筛选。结果:所有扩增引物中有9对无法扩增出清晰条带,13对无法扩增出条带,其余能扩增出较理想产物,扩增有效率为82.54%,说明利用姜黄EST开发广西莪术SSR引物是可行的。引物SSR-29、SSR-31对16份不同产地广西莪术材料扩增情况见图 1、2。
|
图 1 16份广西莪术材料对引物SSR-29 PCR扩增条带图 Figure 1 16 copies of Curcama kwangsinesis germplasm resources with SSR-29 for PCR amplification bands figure |
|
图 2 16份广西莪术材料对引物SSR-31 PCR扩增条带图 Figure 2 16 copies of Curcama kwangsinesis germplasm resources with SSR-31 for PCR amplification bands figure |
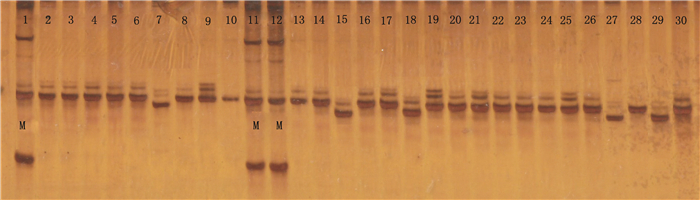
利用126对SSR引物扩增30种不同广西莪术品种,用以初步分析标记的多态性(如图 3)。104对EST-SSR全部成功获得产物,其中,92对(88.46%)扩增出的片段大小符合期望值,12对(11.54%)存在偏差。48对引物至少在30份广西莪术材料中产生多态性,占设计引物的38.09%,共产生90个等位变异,平均每对引物产生1.875个,其余22对经退火温度降低6 ℃条件下仍扩增失败,占设计引物的17.46%,48对引物信息见表 5。
|
图 3 30份广西莪术材料对引物SSR-03扩增所得条带图 Figure 3 30 copies of Curcama kwangsinesis germplasm resources for primers SSR-03 for PCR amplification bands figure |
|
|
表 5 莪术多态性EST-SSR引物信息 Table 5 EST-SSR primers with polymorphism in Curcama kwangsinesis |
利用NTTSYS-PC 2.10软件,以20对SSR引物扩增的0、1统计数据使用UPGMA法进行聚类分析,得到50份供试材料的遗传关系树状图(图 4),由图可以看出,在相似系数0.7处,聚类为2类。第1类包含了8份种质,分别为13-D2-2、26-加1、50-玉11-2、50-玉18-3、52-玉18-2、55-玉1-3、86-B94-1、87-B10-2。在这一类中,除13-D2-2来自金秀、86-B94-1、87-B10-2来自钦州外,其余都产自玉林及管辖县份兴业。在相关系数0.87处,55-玉1-3独自成一类,说明55-玉1-3与其它种质亲缘关系较远。相关系数为0.98处,26-加1和50-玉18-3聚类一类,这两类可能来自同一亲本。在相关系数0.95处,86-B94-1、87-B10-2聚为一类,它们都是同一亲本产生的后代,来源都是钦州。
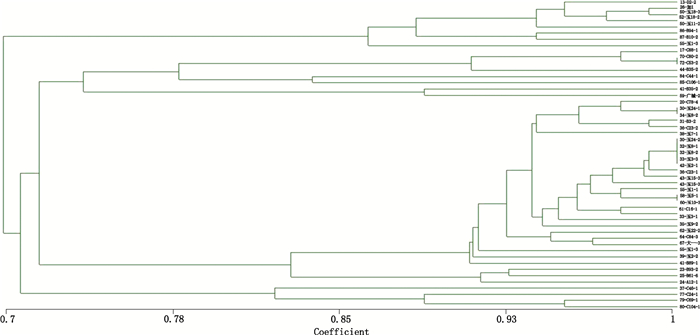
|
图 4 50份莪术种质聚类结果图 Figure 4 The cluster results of fifty germplasm resources of Curcuma kwangsiensis |
第2类包含了42份种质资源。主要包括来源于平南、贵港、兴业、桂平等地的莪术种质。在相关系数为0.71,42份种质又聚为2类。37-C46-1,77-C24-1,79-C69-1,80-C104-1聚为一类,它们来源于金秀,与其他种质亲缘关系较远。其余38份种质在不同相关系数又聚为多类。在相关系数为0.93处,分为2类,第1类包括了21份种质,分别来源贵港、桂平、平南等地。这些品种由于所处地理位置接近,因此当地生长环境及种植制度存在一定相似性,因此也能表现出一定的遗传相似性。第2类包括了62-玉22-2、64-C84-3、67-大一-3共3份种质,来自地域较接近的玉林、兴业。在相关系数为1.0处,30-玉24-2、32-玉8-1、32-玉8-2、33-玉3-3、42-玉2-1聚为一类。可以看出这几份种质亲缘关系非常接近,猜测可能是同一株系的后代。它们产地也相同,均来自玉林。通过聚类分析图,可以将混乱的50个品种进行分类,初步确定亲缘关系。
4 讨论本研究对姜黄EST中SSR进行信息分析,并探讨了EST-SSR在广西莪术品种分类和遗传多样性分析研究中的可行性。在对12 678条姜黄EST搜索时发现了1 243个SSR位点,发生率为7.37%。其中二核苷酸出现频率为50.36%,三核苷酸31.54%,四核苷酸10.30%,以AT/TA和CT/GA出现频率最高。利用Primer 5.0设计引物共325对,PCR检测表明,104对引物可以扩增出理想PCR产物,在至少30份不同种质广西莪术中检测到48对SSR引物具有多态性,占设计引物的38.09%。50份广西莪术聚类分析结果表明,相关系数0.7处,聚类为2类,遗传相似性系数变化范围较窄。
本研究结果表明,姜黄EST中的SSR出现频率高,类型丰富,SSR有着高度保守的侧翼序列,因而能在不同物种间通用。本研究应用NCBI中姜黄EST序列开发近缘种广西莪术的SSR标记能省去引物开发中的构建文库等前期工作,大量节约成本,并且一定程度实现多个物种图谱整合,达到使物种间的连锁信息迅速转换。本研究下载的12 678条序列(截止2014年12月),数量较大,能够满足开发足够数量SSR标记的需要,在一定程度上可弥补SSR标记多态性偏低和EST序列相对保守的不足。尽管EST-SSR具信息量大、通用性好、开发简单成本低、简单快捷等优点,但还存在一定不足,迄今为止,在莪术亲缘关系研宄中,应用SSR标记的报道还较少,因此还需要进行更多的对比研究实验。
以往研究表明姜黄属是三倍体,多态性扩增结果也说明了广西莪术多倍体品种资源多态性相对比较丰富。但从聚类树状图上看,50份供试药材间的相关系数介于0.7~1.0之间,遗传相似性系数变化范围较窄,有研究认为这与生态、地理环境相近,加之相互引种等因素有关。此外,本研究所用的引物数目相对较少,因此选用的50个广西莪术品种的聚类结果并不能完全反映出不同来源品种间彼此的亲缘关系。广西莪术遗传背景复杂,通过常规的形态学方法对莪术进行分类存在一定的局限性,要进一步研究广西莪术遗传多样性,不仅要结合前期的形态学研究、药材产量、成分分析研究等进行深入探讨,还要充分利用近年来快速发展的分子标记技术。本文利用SSR分子标记技术,从分子水平上分析了不同来源莪术品种遗传多样性,并对它们之间的亲缘关系进行了探讨,对广西莪术的优良品种鉴定及栽培选育提供了分子生物学依据。
本研究结果也揭示了50份莪术资源间具有较高的遗传多样性.广西各地莪术品种样品之间的遗传相似系数差别较大,不同产地种质之间差异显著,有较明显的遗传分化,这和已报道采用其他分子标记技术研究莪术资源遗传多样性的结果相似,即不同居群的莪术与种的特性和地理分布有一定相关性。例如:王佐元等[10]应用ISSR标记技术对5个居群的温郁金遗传多样性进行分析,筛选6个引物用于ISSR-PCR扩增,共检测到多态位点34个,多态位点百分率是80.95%,说明温郁金有着较高的遗传多样性水平.王晓慧[16]对蓬莪术、广西莪术和温郁金共8个居群的37个样本进行ISSR-PCR分析,5条引物共扩增出65个位点,其中34个位点是多态性位点,多态位点百分率为52.3%。认为莪术居群问的遗传变异较大,而居群内部的分化程度很低。本研究结果于上述研究存在一致性。
姜黄EST含有丰富的、多种类型的SSR位点,通过姜黄EST开发近原种广西莪术SSR标记是一种简单、快速、经济和有效的途径。本研究明确了姜黄EST序列中SSR的总体特征,开发了48个具有多态性的广西莪术EST-SSR标记,为进一步开发广西莪术EST-SSR标记提供了含SSR位点的候选序列。本研究对50份广西莪术遗传多样性进行初步分析,结果表明按照聚类图来判断植物之间的亲缘关系远近具有可行性,该研究中所有供试药料的聚类分析结果与供试药材区域来源有较好的一致性,同一栽培区域育成的品种(系)在不同程度上聚为一类,不同品种(系)间的亲缘关系与地区来源基本相对应。因此,本研究为利用EST-SSR标记开展广西莪术遗传多样性分析和分子育种研究提供了参考。
| [1] |
王洪振, 王姝, 邝盼盼, 等. DNA分子标记技术及其在植物育种中的应用[J]. 吉林师范大学学报(自然科学版), 2016(1): 108. WANG HZ, WANG Z, GUANG PP, et al. Application of molecular marking technology in plant breeding[J]. J Jilin Norm Univ(Nat Sci), 2016(1): 108. |
| [2] |
杨林栋. 分子标记技术及其在大白菜遗传育种中的应用[J]. 安徽农业科学, 2015, 43(4): 30. YANG LD. A review of DNA molecular marking and application in genetics and breeding of chinese cabbage[J]. J Anhui Agric Sci, 2015, 43(4): 30. |
| [3] |
上官凌飞, 李晓颖, 宁宁, 等. 杏EST-SSR标记的开发[J]. 园艺学报, 2011, 38(1): 43. SHANG GLF, LI XY, NING N, et al. Development of EST-SSR markers in apricot[J]. Acta Horticul Sin, 2011, 38(1): 43. |
| [4] |
黄海燕, 杜红岩, 乌云塔娜, 等. 基于杜仲转录组序列的SSR分子标记的开发[J]. 林业科学, 2013, 49(5): 176. HUANG HY, DU HY, WUYUN TN, et al. Development of SSR molecular markers based on transcriptome sequencing of eucommia ulmoides[J]. Sci Silvae Sin, 2013, 49(5): 176. DOI:10.11707/j.1001-7488.20130523 |
| [5] |
信朋飞, 臧巩固, 赵立宁, 等. 大麻SSR标记的开发及指纹图谱的构建[J]. 中国麻业科学, 2014, 36(4): 174. XIN PF, ZANG GG, ZHAO LN, et al. Development of SSR markers and construction of fingerprint for cannabis(Cannabis sativa L.)[J]. Plant Fiber Sci China, 2014, 36(4): 174. |
| [6] |
王建, 赵应学. 不同种质类型广西莪术挥发油成分多样性研究[J]. 药物分析杂志, 2010, 30(6): 1072. WANG J, ZHAO YX. Diversity of research of volatile oil components of different types of germplasm Curcuma kwangsiensis[J]. Chin J Pharm Anal, 2010, 30(6): 1072. |
| [7] |
肖小河, 刘峰群, 史成和, 等. 国产姜黄属药用植物RAPD分析与分类鉴定[J]. 中草药, 2000, 31(3): 209. XIAO XH, LIU FQ, SHI CH, et al. RAPD polymorphism and authentication of medicinal plants from turmeric(Curcuma L.)in China[J]. Chin Tradit Herb Drugs, 2000, 31(3): 209. |
| [8] |
冷春鸿, 陶正明, 吴志刚, 等. 不同产地温郁金遗传多样性的SRAP分析[J]. 中药材, 2009, 32(l0): 1507. LENG CH, TAO ZM, WU ZG, et al. Study on genetic diversity of Curcuma wenyujin from various habitats by SRAP[J]. J Chin Med Mater, 2009, 32(l0): 1507. |
| [9] |
陶银龙, 王佐元, 丁文勇, 等. 5个温郁金居群遗传多样性的RAPD分析[J]. 绍兴文理学院学报, 2013, 33(9): 53. TAO YL, WANG ZY, DING WY, et al. The genetic diversity of the populations of Curcuma wenyujin by RAPD analysis[J]. J Shaoxing Univ, 2013, 33(9): 53. |
| [10] |
王佐元, 陶银龙, 郑蔚虹, 等. 5个温郁金居群遗传多样性的ISSR分析[J]. 高师理科学刊, 2013, 33(33): 53. WANG ZY, TAO YL, ZHENG WH, et al. The genetic diversity of the populations of Curcuma wenyujin by RAPD analysis[J]. J Gaoshi Univ, 2013, 33(9): 53. |
| [11] |
杨妮, 苏伟敏, 靳雅惠, 等. 适用于SSR分析的广西莪术DNA提取方法考察[J]. 中国实验方剂学杂志, 2015, 21(4): 81. YANG N, SU WM, JIN YH, et al. Investigation of extraction methods of DNA from Curcuma kwangsiensis for simple sequence repeat analysis[J]. Chin J Exp Tradit Med Form, 2015, 21(4): 81. |
| [12] |
朱晓敏, 王弦云, 陈龙灿, 等. 杜仲SSR-PCR反应体系建立及引物筛选[J]. 安徽农业大学学报, 2013, 40(3): 387. ZHU XM, WAGN XY, CHEN LC, et al. Establishment of SSR-PCR reaction system and primers screening for Eucommia ulmoides[J]. J Anhui Agric Univ, 2013, 40(3): 387. |
| [13] |
郭敏, 李毅, 马彦军, 等. 山生柳SSR-PCR反应体系优化[J]. 草业科学, 2012, 29(5): 13. GUO M, LI Y, MA YJ, et al. Establishment and optimization of SSR-PCR system of Salix oritrepha[J]. Pratacult Sci, 2012, 29(5): 13. |
| [14] |
SIJIU S, DHANYA K, SYAMKUMAR S., et al. Parthasarathy development, characterization and cross species amplificationof polymorphic microsatellite markers from expressed sequence tags of turmeric(Curcuma longa L.)[J]. Mol Biotechnol, 2010, 63(44): 140. |
| [15] |
KOMATSU K, SASAKI Y, TANAKA K, et al. Morphological, genetic, and chemical polymorphismof Curcuma kwangsiensis[J]. J Nat Med, 2008, 62(4): 413. DOI:10.1007/s11418-008-0272-x |
| [16] |
王晓慧, 汤晓闯, 杨恩秀, 等. 莪术不同种和居群的ISSR-PCR分析[J]. 中国中药杂志, 2008, 33(18): 2037. WANG XH, TANG XC, YANG EX, et al. ISSR-PCR analysis in different species and populations of Rhizoma Curcumae[J]. China J Chin Mater Med, 2008, 33(18): 2037. DOI:10.3321/j.issn:1001-5302.2008.18.006 |
 2017, Vol. 37
2017, Vol. 37 
