近些年来市场上补肾、抗疲劳类中药及保健食品中出现添加西地那非等磷酸二酯酶-5(PDE5)型抑制剂的现象。为了加强监管,国家食品药品监督管理局发布了补充检验方法和检验项目批准件2009030,用于11种PDE5型抑制剂非法添加的检验。但是一些厂家对PDE5型抑制剂做了结构修饰,合成了大量衍生物。目前,见诸于文献报道的非法添加PDE5型抑制剂衍生物已接近40种[1],而且数目在不断增多[2-5]。这就对日常的检验工作造成了严重影响。近些年来,随着高分辨质谱的发展,利用其高分辨率和高质量数精度已经能够实现对未知化合物的快速筛查和结构确认[6]。但是目前对于PDE5型抑制剂的筛查仍集中于目标化合物的分析策略,需要使用对照品作为参考[7-8]。但是这类对照品尤其是未知衍生物的对照品,价格昂贵而且不容易获得,因此在筛查过程中常常会遗漏未知的衍生物。
PDE5型抑制剂主要通过对西地那非、伐地那非、他达拉非的结构修饰衍生而来,因此具有相同的母核结构,在裂解过程中会出现相同结构的诊断离子(diagnostic fragment ion),通过这类共有的诊断离子可以快速识别目标及非目标的PDE5型抑制剂[9-10]。
本文利用了HPLC-QTOF/MS结合MassHunter软件的自动扫描功能建立了一种基于诊断离子的PDE5型抑制剂的非目标筛查策略(见图 1)。首先分析了典型PDE5抑制剂的裂解规律后选择诊断离子,通过自动扫描模式Auto MS/MS得到化合物高质量数精度的一级质谱和二级质谱信息。再提取可能的非法添加物,根据裂解规律推测结构。在缺少对照品的情况下,通过1次进样扫描即可对PDE5型抑制剂进行筛查。
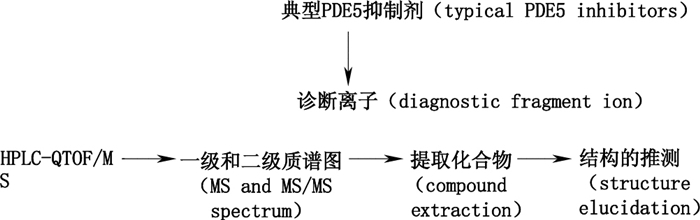
|
图 1 基于诊断离子的非目标分析策略 Figure 1 The non-targeted screening approach based on diagnostic fragment ion |
Agilent 6530 HPLC-QTOF/MS液质联用仪(Agilent公司),KQ-200KDB超声仪(昆山市超声仪有限公司)。Poroshell EC-C18色谱柱(4.6 mm×50 mm,2.7 μm;填料:十八烷基硅烷键合硅胶;Agilent公司)。
对照品西地那非(批号1358-057A1)、他达拉非(批号1156-051A1)、那红地那非(批号1591-080A3)、红地那非(批号1947-006B2)、氨基他达拉非(批号1638-004A2)、羟基豪莫西地那非(批号1441-048A6)、伐地那非盐酸盐(1132-035A1)、豪莫西地那非(1220-030A3)、伪伐地那非(1217-011A2)、硫代艾地那非(批号1214-006A3)、那莫西地那非(1646-055A2)均购于加拿大TLC PharmaChem公司。乙腈、冰醋酸均为色谱纯。所有样品均为金华市食品药品监督管理局日常监督抽验样品。
2 实验条件 2.1 混合对照品储备液及混合对照品溶液的制备分别称取上述对照品各10 mg于10 mL量瓶中,加乙腈溶解并稀释至刻度,即得混合对照储备液。临使用前用50%乙腈稀释成相应浓度的混合对照品溶液。
2.2 供试品溶液的制备若供试品为固体制剂,取适量置于研钵中,研磨均匀成粉末状。精密称取0.5 g(精确至0.001 g),置50 mL量瓶中,加乙腈约30 mL,超声(功率200 W,频率40 kHz)处理15 min,冷却至室温,用乙腈稀释至刻度,摇匀,滤过;若供试品为液体制剂,混匀后,精密量取1.0 mL,置50 mL量瓶中,加乙腈约30 mL,超声处理10 min,冷却至室温,用乙腈稀释至刻度,摇匀,滤过。取滤液,以50%乙腈稀释10至1 000倍,用微孔滤膜(0.22 μm)作为供试品溶液。
2.3 色谱质谱条件色谱柱:Poroshell EC-C18色谱柱(4.6 mm×50 mm,2.7 μm),流动相A为0.1%的乙酸水溶液,B为乙腈,梯度洗脱(0~15 min,25%B→40%B;15~20 min,40%B→80%B;20~30 min,80%B),柱温40 ℃;质谱条件:采用ESI(+)离子源,参比离子m/z 121.050 9和922.009 79,雾化气(N2)241 kPa,干燥气(N2)流速12 L·min-1,温度200 ℃,毛细管电压3.5 kV,碎裂电压180 V,碰撞能电压35 eV。MassHunter软件,版本B 04.00。
2.4 诊断离子筛查策略的参数Auto MS/MS扫描模式通过判定各离子流峰的强度后对符合规定的峰进行裂解得到全扫描图谱。将母离子强度设置为200,相对阈值设置为1%,扫描范围为m/z 50~1 000,在此范围内的离子将被自动筛选出进行MS/MS分析。一级质谱、二级质谱扫描速度均为2 spectra·s-1,最大扫描离子数设定为2个。利用Find by Auto MS/MS的碎片离子过滤功能,根据诊断离子提取母离子。质量提取窗口设置为10×10-6,相对离子丰度阈值设置为5%。
3 结果与讨论 3.1 诊断离子的选择根据结构的相似性,将PDE5型抑制剂分为西地那非类、伐地那非类、他达拉非类、硫代西地那非类和红地那非类(见图 2)。按实验条件,将质量浓度为500 ng·mL-1的混合对照品溶液注入质谱仪器中得到一级、二级质谱图,结合精确相对分子质量推断主要裂解规律(图 2)。西地那非类物质的结构修饰主要位于苯环上的氧取代基和哌嗪环上。这类物质首先发生N-S键的断裂,然后发生C-S键的断裂并脱去苯环烷氧基上的烷基中性碎片,形成m/z 283.119 0(C15H15N4O2+)诊断离子[11]。硫代西地那用S取代了西地那非类物质吡唑并嘧啶环上的O,特征诊断离子m/z 299.096 1(C15H15N4OS+)比西地那非大16 amu[12]。伐地那非类物质与西地那非类物质结构相似,但是这类物质中S=O双键、苯环与五元杂氮环通过共享的N原子形成大的共轭体系,产生了奇电子离子的诊断离子m/z 284.126 8(C15H16N4O2+),其丰度要远高于偶电子离子m/z 283.119 0(C15H15N4O2+)[13]。红地那非类的诊断离子为m/z 297.134 6(C16H17N4O2+),是经过脱去苯环上的羰基及烷氧基上的烷基得到[14]。他达拉非类物质的结构与其他PDE5型抑制剂差异较大。这类物质的结构修饰集中于哌嗪二酮的N原子上,因此能通过反Diels-Alder反应得到m/z 262.086 3(C17H12NO2+)的诊断离子[2-5]。
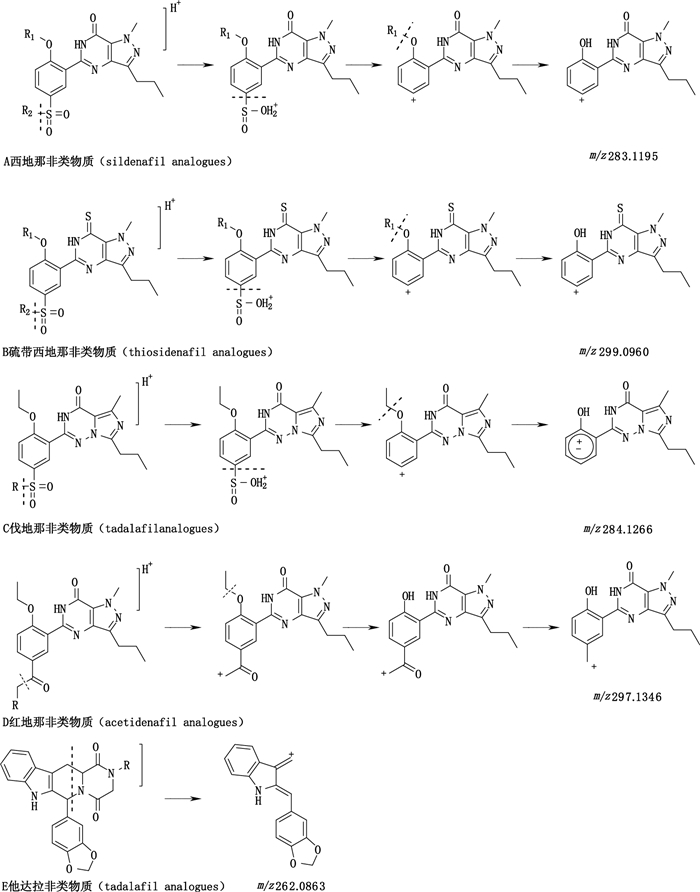
|
图 2 不同类型的PDE5型抑制剂及其诊断离子的裂解途径 Figure 2 Fragmentation pattern of different kinds of PDE5 and their diagnostic fragment ions |
对多种流动相系统进行筛选后发现,乙腈与0.1%乙酸水系统能够获得更好的分离度。在此条件下将质量浓度为500 ng·mL-1的混合对照品溶液注入质谱仪进行质谱条件的优化,通过优化碎裂电压使得母离子获得最大离子响应,然后优化碰撞能量使诊断离子响应最大。11种物质最佳质谱参数见表 1。除他达拉非类物质的以外,大部分物质在碎裂电压为180 V,碰撞能为35 eV左右能够获得最大的响应。综合考虑后选择碎裂电压为180 V,碰撞能量为35 eV。在此色谱质谱条件下,通过诊断离子提取的离子流图见图 3。
|
|
表 1 11种PDE5抑制剂的保留时间、最优裂解电压和碰撞能 Table 1 Retention time, optimum fragmentor and collision energy of 11 PDE5 inhibitors |
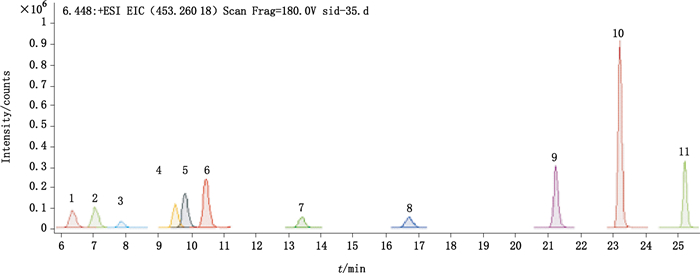
|
1.那红地那非(noracetildenafil) 2.红底那非(acetildenafil) 3.伐地那非(vardenafil) 4.羟基豪莫西地那非(hydroxyhomosildenafil) 5.西地那非(Sildnafil) 6.豪莫西地那非(homosildenafil) 7.氨基他达拉非(aminotadalafil) 8.他达拉非(tadalafil) 9.硫代艾地那非(thiodimethysildenafil) 10.伪伐地那非(psudovardenafil) 11.那莫西地那非(norneosidenafil) 图 3 11种PDE5型抑制剂的提取离子流图 Figure 3 The extracted ion chromatogram of 11 PDE5 inhibitors |
通过诊断离子提取PDE5型抑制剂时,质量提取窗口的设置会影响到诊断离子的识别,质量准确度太高时造成无法识别,产生假阴性的结果;太低则容易出现假阳性物质。对30批阴性样品溶液(阴性口服液,阴性胶囊剂和阴性片剂各10批)添加质量浓度分别为50 ng·mL-1和500 ng·mL-1混合对照品溶液的分析表明,在质量提取窗口为±10×10-6时,能够识别发现全部11种PDE5抑制剂。随着质量提取窗口的增加到±20×10-6时会出现假阳性物质的干扰(见图 4)。假阳性物质的另1个来源是背景噪声中的低丰度离子。虽然可以通过裂解规律等信息人工检查排除,但是更有效的方式是通过设置相对离子丰度阈值过滤这类假阳性物质。在设置质量提取窗口为±10×10-6,诊断离子相对离子丰度过滤值为0.01%时,30批样品中分别发现31及28个假阳性物质。但是随着过滤阈值的变大假阳性物质数量不断减少,在阈值为5%时可排除所有的假阳性物质(见图 4)。因此将质量提取窗口设置为±10×10-6,相对离子丰度阈值设置为5%,可以过滤大部分假阳性物质同时保证识别所有的11种PDE5抑制剂。
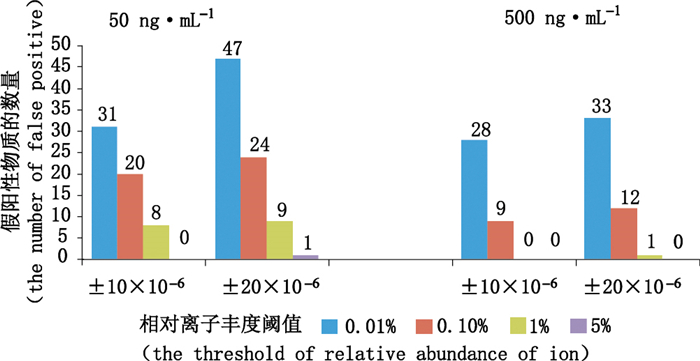
|
图 4 质量提取窗及相对离子强度对假阳性物质的影响 Figure 4 Influence of mass accuracy and relative abundance on false positive |
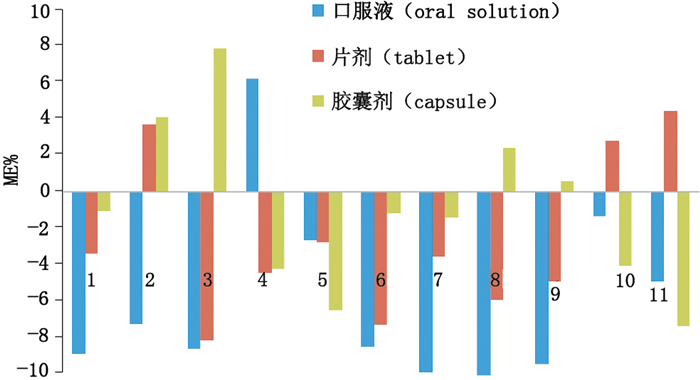
通常基质效应强弱的表示方法为[15]基质效应(ME)=[(基质匹配对照品溶液所作曲线的斜率/无基质对照品溶液所作曲线的斜率)-1]×100%,基质效应为负值表示存在基质抑制效应,正值表示存在基质增强效应,绝对值大于20%则表明具有较强的基质效应。实验用50%乙腈和阴性样品溶液(阴性口服液、阴性胶囊和阴性片剂各5批),加入混合对照品溶液适量,配制成质量浓度为50、200、500 ng·mL-1的无基质对照品溶液和基质匹配对照品溶液,对11种化合物进行基质效应的评价,结果见图 5。11种化合物的基质效应的绝对值在0~10%之间,并没有表现出强的基质效应。
|
1.那红地那非(noracetildenafil) 2.红底那非(acetildenafil) 3.伐地那非(vardenafil) 4.羟基豪莫西地那非(hydroxyhomosildenafil) 5.西地那非(Sildnafil) 6.豪莫西地那非(homosildenafil) 7.氨基他达拉非(aminotadalafil) 8.他达拉非(tadalafil) 9.硫代艾地那非(thiodimethysildenafil) 10.伪伐地那非(psudovardenafil) 11.那莫西地那非(norneosidenafil) 图 5 11种PDE5抑制剂基质效应的评价 Figure 5 Evaluation of matrix effects of 11 PDE5 inhibitors |
采用质量浓度分别为50、100、200、400、600、800、1 000 ng·mL-1的11种PDE5抑制剂混合对照品溶液,在最优条件下进行测定,以各组分质量浓度(ng·mL-1)为横坐标,峰面积为纵坐标绘制标准曲线。11种PDE5型抑制剂在50~1 000 ng·mL-1的质量浓度范围内呈良好的线性关系,其相关系数均大于0.99(见表 2)。高分辨质谱提取的分子离子色谱图经常出现无基线噪声的情况,因此本文采用了统计学的方法计算检出限[16],以被分析物浓度 > 0时并能以99%置信度报告的物质浓度作为检出限,平行测定7个低浓度的阴性样品的混合对照品加标溶液,加标浓度约预期值的1~5倍,按给定的方法测定,检出限的计算公式为LOD=S×t(n-1,α=0.99),S为重复测定的标准偏差,t为自由度n-1时,99%置信区间的t分布,用阴性胶囊样品溶液的混合对照品加标溶液(他达拉非、氨基他达拉非、羟基豪莫西地那非、伐地那非添加质量浓度为15 ng·mL-1,其余添加质量浓度均为5 ng·mL-1)平行测定7份,确定检出限(t=3.143),其结果见表 2。
|
|
表 2 11种PDE5抑制剂的线性方程、检出限和回收率 Table 2 Linear equation, limit of determination and recoveries of 11 PDE5 inhibitors |
取阴性口服液、阴性胶囊和阴性片剂各15份,分别添加50、200、500 ng·mL-1 3个浓度水平的混合对照品溶液适量,制备不同添加水平的供试溶液各5份,进行加标回收试验,结果见表 2。11种PDE5抑制剂的平均回收率为83.7%~110.0%,RSD为1.5%~10.2%。
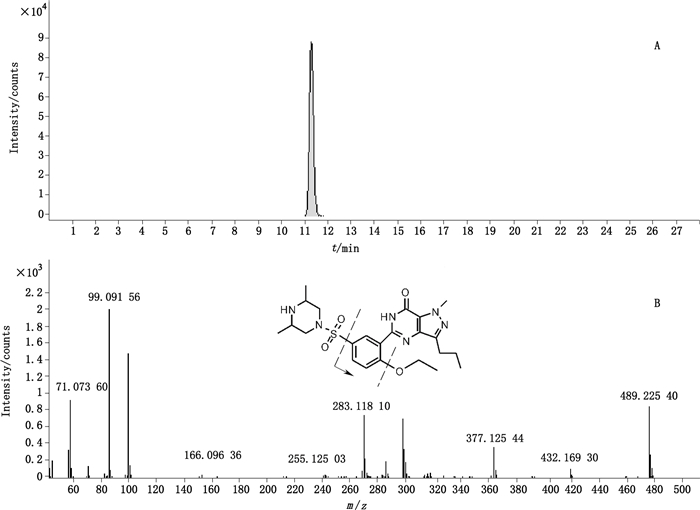
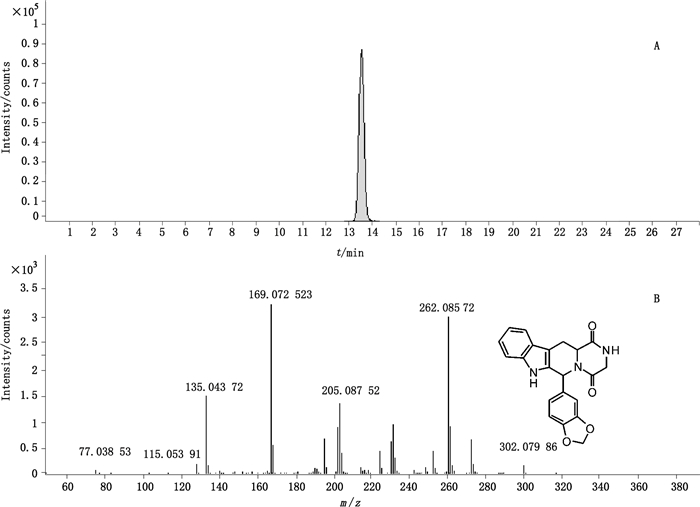
3.7 实际样品的测定采用诊断离子筛查策略,对25批抽检样品进行筛查,8批发现了已知的西地那非,另外2批样品中发现11种以外的PDE5抑制剂的非法添加,其诊断离子提取后离子流图及质谱图见图 6、7。化合物1的特征诊断离子为m/z 283.118 1,为西地那非类物质,其母离子相对分子质量为489.227 3,推测分子式为C23H33N6O4S+(理论m/z 489.227 9,Δm=-1.2×10-6),结合m/z 377.112 5和m/z 311.150 3的碎片离子推测其吡啶环上比西地那非多了1个甲基。比对二级质谱图[14]推测应该为艾地那非。化合物2中的m/z 262.085 7诊断离子表明是1个他达拉非类衍生物,其精确相对分子质量为376.130 1,推测母离子分子式为C21H18N3O4+(理论m/z 376.129 2,Δm=2.4×10-6),较他达拉非缺少1个甲基,推测为去甲基他达拉非。这个物质最近才见诸于报道[17]。近些年来不断有他达拉非类的新型衍生物的报道[2-5],这是一个检验过程中值得注意的现象。
|
图 6 诊断离子提取的化合物1离子流图(A)及二级质谱图(B) Figure 6 The extracted ion chromatogram(A)and MS/MS spectrum(B)of compound 1 |
|
图 7 诊断离子提取的化合物2离子流图(A)及二级质谱图(B) Figure 7 The extracted ion chromatogram(A)and MS/MS spectrum(B)of compound 2 |
采用目标化合物模式的扫描策略对筛查结果进行验证。对11种PDE5抑制剂混合对照品和实际样品进行全扫描,检查色谱图及一级质谱图,再用Target MS/MS扫描模式对目标物质进行二级质谱扫描,比较对照品和样品的色谱图、一级和二级质谱图进行定性检查。其验证结果与特征离子筛查策略相同。阴性样品中并未筛查出11种PDE5抑制剂;非法添加已知PDE5型抑制剂的阳性样品测定结果也一致。但是目标化合物模式的筛查策略对未知物的筛查效率较低,需要仔细检查一级质谱图筛查可疑的母离子,再对其裂解获得子离子信息;对于基质复杂的样品容易出现假阴性的漏筛情况,因此相比较而言基于诊断离子的非目标扫描策略更为高效和可靠。
4 结论本文利用了诊断离子建立了非目标化合物的快速筛查方法,在数据采集后,利用诊断离子寻找发现PDE5型抑制剂,具有高选择性和高灵敏度的特点。相较于常规的目标化合物筛查模式,无需多次进样,简便快速,能够同时识别发现已知及未知的PDE5型抑制剂。这种非目标扫描策略为保健食品和中药中的非法添加物的检测提供了一种新的思路和手段,为相关的监督和监管提供了依据。
| [1] |
Venhuis BJ, Kaste DD. Towards a decade of detecting new analogues of sildenafil, tadalafil and vardenafil in food supplements:A history, analytical aspects and health risks[J]. J Pharm Biomed Anal, 2012, 69(8): 196. |
| [2] |
Kern SE, Nickum EA, Flurer RA, et al. Isolation and structural characterization of a new tadalafil analog(2-hydroxyethylnortadalafil)found in a dietary supplement[J]. J Pharm Biomed Anal, 2015, 103C: 99. |
| [3] |
Huang YC, Lee HC, Lin YL, et al. Separation and identification of a novel tadalafil analogue adulterant in a dietary supplement[J]. Food Addit Contam A, 2015, 15(1): 37. |
| [4] |
Xu Y, Kee CL, Ge X, et al. Isolation and characterization of a tadalafil analogue, N-cyclopentylnortadalafil in health supplement[J]. J Pharm Biomed Anal, 2015, 118(8): 235. |
| [5] |
Kern SE, Lorenz LM, Lanzarotta A, et al. Isolation and structural characterization of a new tadalafil analog(chloropropanoylpretadalafil) found in a dietary supplement[J]. J Pharm Biomed Anal, 2016, 128: 360. DOI:10.1016/j.jpba.2016.05.038 |
| [6] |
Vaclavik L, Krynitsky AJ, Rader JI. Mass spectrometric analysis of pharmaceutical adulterants in products labeled as botanical dietary supplements or herbal remedies:a review[J]. Anal Bioanal Chem, 2014, 406(27): 6767. DOI:10.1007/s00216-014-8159-z |
| [7] |
王美玲, 颜鸿飞, 曾乐, 等. 高效液相色谱-离子阱飞行时间串联质谱法快速筛查保健食品中非法添加的磷酸二酯酶-5抑制剂及其类似物)[J]. 分析测试学报, 2014, 33(3): 239. WANG ML, YAN HF, ZENG L, et al. Rapid screening and confirmation of illegally added phosphodiestrase-5 inhibitors and analogues in health foods by liquid chromatography-trap-time of flight tandem mass spectrometry[J]. J Instrum Anal, 2014, 33(3): 239. |
| [8] |
于泓, 胡青, 张甦, 等. 补肾壮阳类中药及保健食品中31种5型磷酸二酯酶抑制剂的高分辨四极杆飞行时间质谱定性定量检测方法[J]. 中国药学杂志, 2013, 48(15): 1312. YU H, HU Q, ZHANG G, et al. Qualitative and quantitative analysis of 31 PDE-5 inhibitors in herbal products and dietary supplements by UPLC/Q-TOF-MS[J]. Chin Pharm J, 2013, 48(15): 1312. |
| [9] |
Zhang JY, Zhang Q, Li N, et al. Diagnostic fragment-ion-based and extension strategy coupled to DFIs intensity analysis for identification of chlorogenic acids isomers in Flos Lonicerae Japonicae by HPLC-ESI-MSn[J]. Talanta, 2013, 104(2): 1. |
| [10] |
Chen JF, Song YL, Guo XY, et al. Characterization of the herb-derived components in rats following oral administration of Carthamus tinctorius extract by extracting diagnostic fragment ions(DFIs)in the MS(n)chromatograms[J]. Analyst, 2014, 139(24): 6474. DOI:10.1039/C4AN01707B |
| [11] |
梁祈. 中成药保健食品中西地那非的液质联用确证方法研究[J]. 质谱学报, 2008, 29(5): 295. LIANG X. Verification method for sildenafil in Chinese patent medicine preparations and dietary supplements by LC-MS/MS[J]. J Chin Mass Soc, 2008, 29(5): 295. |
| [12] |
Kee CL, Ge X, Low MY. Application of orbitrap-mass spectrometry to differentiate isomeric sildenafil-and thiosildenafil-like analogues used for the adulteration of dietary supplements[J]. Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2015, 32(10): 1737. DOI:10.1080/19440049.2015.1062923 |
| [13] |
Choi DM, Park S, Yoon TH, et al. Determination of analogs of sildenafil and vardenafil in foods by column liquid chromatography with a photodiode array detector, mass spectrometry, and nuclear magnetic resonance spectrometry[J]. J AOAC Int, 2008, 91(3): 580. |
| [14] |
Mustazza C, Borioni A, Rodomonte AL, et al. Characterization of sildenafil analogs by MS/MS and NMR:a guidance for the detection and structure elucidation of phosphodiesterase-5 inhibitors[J]. J Pharm Biomed Anal, 2014, 96(6): 170. |
| [15] |
Munaretto JS, May M, Saibt N, et al. Liquid chromatography with high resolution mass spectrometry for identification of organic contaminants in fish fillet:screening and quantification assessment using two scan modes for data acquisition[J]. J Chromatogr, 2016, 1456: 205. DOI:10.1016/j.chroma.2016.06.018 |
| [16] |
Code of Federal Regulations(CFR)40.Appendix B to Part 136-Definition and Procedure for the Determination of the Method Detection Limit -Revision 1.11[S].2014:344
|
| [17] |
黄朝辉, 蔡丹丹, 陈仲益, 等. 保健食品中他达拉非类似物去甲他达拉非的检测研[J]. 中国药学杂志, 2015, 50(4): 371. Hunag ZH, Cai DD, Cheng ZY, et al. Discovery of nortadalafil in health foods[J]. Chin Pharm J, 2015, 50(4): 371. |
 2017, Vol. 37
2017, Vol. 37 