2. 安徽省食品药品检验研究院, 合肥 230051
2. Anhui Institute for Food and Drug Control, Hefei 230051, China
依托红霉素(erythromycin estolate)又名无味红霉素,属大环内酯类抗生素,为红霉素丙酸酯的十二烷基硫酸盐,在肠道中以酯化物的形式被吸收,进而部分水解为活性成分红霉素[1]。其作用机制与红霉素相同,可透过细菌细胞膜,与细菌核糖体的50S亚基成可逆性结合,阻断了转肽作用和信使核糖核酸(t-RNA)的位移,抑制细菌蛋白质合成。中国药典2015年版[2]、美国药典[3]均收载依托红霉素片剂,但均未设立有关物质检查项。关于依托红霉素有关物质研究的报道较少,仅见依托红霉素含量及有关物质分析方法的研究[4-6],未见对依托红霉素片剂主要有关物质及有关物质含量分布的报道。本文参照相关文献中红霉素类原料及其制剂的分析方法[7-9],建立HPLC法测定14家生产企业130批样品中有关物质;另采用质谱技术[10-15]对样品中的未知主要有关物质进行了分析,并通过破坏实验、原料考察等手段对有关物质进行溯源。
1 仪器与试药 1.1 仪器岛津公司LC-20A高效液相色谱仪;资生堂株式会社CAPCELLPAK MGⅡC18色谱柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶,有机硅聚合物包被填料);AB Sciex triple quad 5500质谱仪;Waters公司Xevo G2QTOF质谱仪;梅特勒-托利多公司METTLER TOLEDO XP-205分析天平(d=0.000 01 g);Elma公司E300H Elmasonic超声仪。
1.2 试药及对照品乙腈、乙醇、乙酸铵为色谱纯,磷酸氢二钾、磷酸为分析纯,实验用水为Milli-Q纯化水。红霉素B对照品(美国药典对照品,批号1242010);脱水红霉素A对照品(依据欧洲药典[16]条件制备);表红霉素A烯醇醚对照品,红霉素A烯醇醚对照品(依据欧洲药典条件制备);N-去甲基红霉素A对照品(美国药典对准品,批号1242032);红霉素对照品(美国药典对照品,批号1242000);红霉素C对照品(美国药典对照品,批号1242021);依托红霉素对照品(美国药典对照品,批号1243002);红霉素系统适用性对照品(中国食品药品检定研究院,批号130670-201501)。
1.3 样品依托红霉素原料药来自台山市化学制药有限公司(厂家Ⅰ)和黄石世星药业有限责任公司(厂家Ⅱ)。130批依托红霉素片样品,分别来自福建汇天生物药业有限公司、江苏平光制药有限责任公司、广东台城制药股份有限公司、台山市化学制药有限公司、靖宇天池制药有限公司、西安利君制药有限责任公司、上海信谊药厂有限公司、湖北绿金子药业有限责任公司、上海玉瑞生物科技(安阳)药业有限公司、岳阳同联药业有限公司、国药集团广东环球制药有限公司、上海新亚药业闵行有限公司、上海腾瑞制药有限公司、山西远景康业制药有限公司14家生产企业。
2 方法 2.1 色谱、质谱条件色谱条件:采用CAPCELLPAK MGⅡC18色谱柱(4.6 mm×250 mm,5 μm),以磷酸氢二钾溶液(称取磷酸氢二钾8.7 g,加水1 000 mL溶解,用20%磷酸调节pH至8.2)-乙腈(40: 60)为流动相,流速1.5 mL·min-1,柱温35 ℃,检测波长205 nm,进样量20 μL。
质谱条件:将上述色谱条件中的流动相磷酸氢二钾溶液替换成0.02 mol·L-1乙酸铵溶液进行杂质制备后,直接进样,离子化方式为ESI(-),质量采集范围m/z 500~1 200,干燥气温度350 ℃,碰撞能量10~30 eV,毛细管电压4.5 kV。
2.2 供试品溶液的制备取样品研细,取细粉适量(约相当于依托红霉素125 mg),置25 mL量瓶中,加乙腈溶解并稀释至刻度,滤过,取续滤液即得。
3 结果 3.1 HPLC方法学验证 3.1.1 专属性曾试用更高比例的乙腈加入流动相,样品中并未检出新的有关物质,且当流动相中乙腈比例超过70%时,缓冲盐会析出而发生浑浊,故未采用更高有机相比例的梯度洗脱方法。取处方量空白辅料适量,置25 mL量瓶中,加乙腈溶解并稀释至刻度,摇匀,过滤后取续滤液作为空白辅料溶液,精密量取20 μL注入液相色谱仪,记录色谱图。空白辅料无干扰。将已知有关物质对照品制成0.2 mg·mL-1的混合溶液后进样,各峰分离度良好。
3.1.2 线性与范围精密称取红霉素A对照品适量,用乙腈配制成0.010、0.050、0.10、0.20、0.40、0.80 mg·mL-1的系列溶液,进样测定,以质量浓度X为横坐标,以峰面积Y作纵坐标,绘制线性关系图,得出回归方程:
Y=1.505×106X-8.051×103 r=0.999 9
结果表明,红霉素A质量浓度在0.01~0.80 mg·mL-1范围内线性关系良好。
3.1.3 重复性及精密度取同一批次样品6份,分别按“2.2”项下方法制备供试品溶液,按“2.1”项下条件进样测定,结果6份样品中红霉素A的含量分别为3.05%、3.04%、3.07%、3.01%、3.11%、3.06%,平均值为3.06%,RSD为1.1%,说明方法重复性良好。精密量取1 mg·mL-1红霉素A对照品溶液20 μL注入液相色谱仪,连续进样6次,依法测定峰面积,RSD为0.80%,说明进样精密度良好。
3.1.4 供试品溶液的稳定性取依托红霉素原料(厂家Ⅰ)制备成质量浓度为5 mg·mL-1的供试品溶液,分别在0、5、10、15、20、30 min进样20 μL,红霉素A峰面积值分别为444 029、442 094、440 406、434 312、433 377、416 811,红霉素A烯醇醚峰面积值分别为82 150、88 765、89 492、91 225、91 473、92 655,有关物质19峰面积值分别为32 385、117 498、202 427、415 484、477 562、819 204;说明供试品溶液不稳定,随着供试品溶液放置时间的延长,红霉素A的峰面积逐渐减少,红霉素A烯醇醚逐渐增加,有关物质19迅速增加,故供试品溶液应临用现配,立即进样。
3.1.5 检测限和定量限将红霉素A对照品溶液逐级稀释,进行测定,当信噪比S/N=3和S/N=10时计算红霉素A检测限和定量限,分别为0.005 mg和0.015 mg。
3.2 依托红霉素片有关物质含量分布不同生产企业的产品,各有关物质的大小有明显不同。依据最小峰纯度系数法(从峰中的每一检测到的点的相似度指数减去相应的阈值,计算峰纯度指数)计算DAD检测器(二极管阵列检测器)获得的数据,峰纯度指数为1.000 0,单点阈值为0.996 4,最小峰纯度指数为362,表明主成分峰纯度较高。按其出峰时间的先后顺序对其编号,典型色谱图如图 1,主要检出20个有关物质。其中已知的有关物质有:1号,N-去甲基红霉素A;2号,红霉素C;5号,红霉素A;6号,脱水红霉素A;8号,表红霉素A烯醇醚;9号,红霉素B;14号,红霉素A烯醇醚。
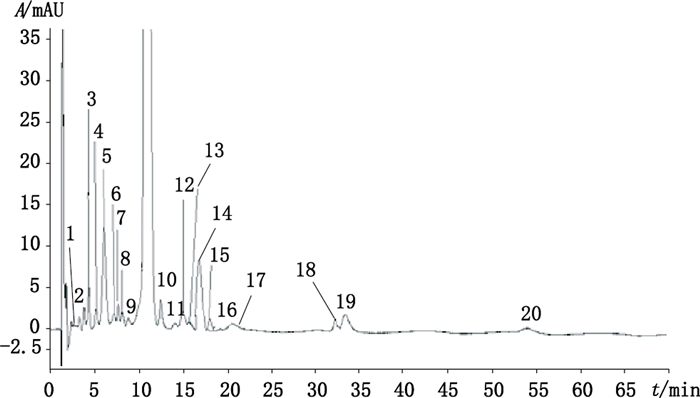
|
图 1 依托红霉素片有关物质典型色谱图 Figure 1 Typical chromatogram of related substances in erythromycin estolate tablets |
将样品中各有关物质峰面积与主成分峰面积比较,计算相对含量。20个有关物质中,有关物质5、14、19为主要有关物质(其含量分布分别为0.122%~10.351%,0~5.611%,0~9.827%),检出的批数均占总批数的93.8%以上,不同企业生产的样品中上述有关物质含量值离散度较大,有关物质含量及方差分布图见图 2。有关物质19在130批样品中几乎都有检出且含量较高,本文“3.4”项对该成分进行了结构分析。
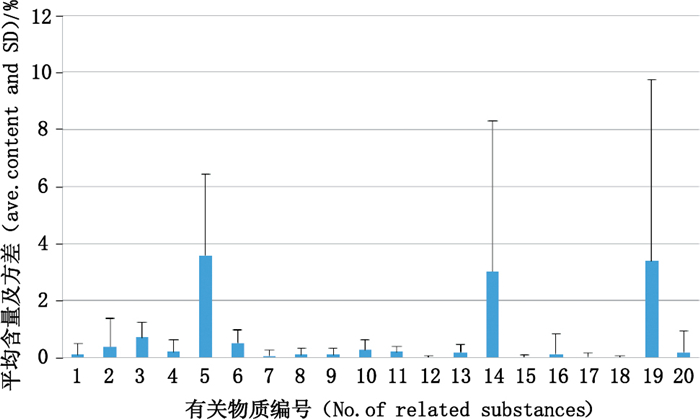
|
图 2 样品中20个有关物质含量分布图 Figure 2 Distribution of 20 related substances in samples |
取依托红霉素原料(厂家Ⅰ、Ⅱ),分别进行酸破坏、碱破坏、高温破坏及氧化破坏。取依托红霉素样品(约相当于依托红霉素125 mg),置25 mL量瓶中,分别加乙醇2 mL使溶解(高温破坏的直接置130 ℃放置3 h后测定),再加入0.1 mol·L-1盐酸溶液1 mL,或0.1 mol·L-1氢氧化钠溶液1 mL,或5%双氧水溶液1 mL,放置30 min后,酸破坏的样品加入0.1 mol·L-1的氢氧化钠溶液1 mL中和,碱破坏的样品加入0.1 mol·L-1的盐酸溶液1 mL中和;上述酸、碱、及氧化破坏的溶液再分别加乙醇10 mL,加水解液(20 g·L-1磷酸氢二钾,20%磷酸调节pH至8.0)10 mL,24 h后用水解液定容,过滤后测定。破坏后有关物质的变化情况见表 1。
|
|
表 1 依托红霉素破坏后有关物质的含量变化 Table 1 Content changes of related substances in erythromycin estolate after destruction |
厂家Ⅰ、Ⅱ的依托红霉素原料在酸、碱、高温、氧化破坏加速破坏条件下的降解产物基本相同,其中酸破坏产物主要有脱水红霉素A,碱破坏及氧化破坏产物主要是红霉素A,高温破坏产物主要为红霉素A烯醇醚、表红霉素A烯醇醚。N-去甲基红霉素A的含量虽然在加速破坏试验过程中无变化,但在多数样品中均有检出,其主要来源于合成反应产生的副产物。
3.4 主要未知有关物质结构分析将高效液相色谱系统的流动相磷酸氢二钾溶液(称取磷酸氢二钾8.7 g,加水1 000 mL溶解,用20%磷酸调节pH至8.2)-乙腈(40: 60)变换为0.02 mol·L-1乙酸铵溶液-乙腈(40: 60)后,对有关物质19溶液进行制备,测定质谱数据;同时对比依托红霉素主成分的质谱裂解规律,推测了有关物质19的可能结构为红霉素A丙酸酯烯醇醚。已知依托红霉素的主成分红霉素A丙酸酯相对分子质量789.5,负离子扫描模式下的准分子离子峰为m/z 848.5,二级质谱碎片主要有m/z 788.2、612.4和554.4,由于流动相中含有醋酸铵,推断负离子扫描模式下的准分子离子峰为主成分结合流动相中的醋酸根离子形成;而有关物质19在负离子扫描模式下的分子离子峰为m/z 830.4,二级质谱碎片主要有m/z 770.4、594.4、463.3,推断有关物质19在负离子扫描模式下,准分子离子峰的形成方式与红霉素A丙酸酯相同,其结构式及裂解途径如图 3所示。采用高分辨率的飞行时间质谱测定有关物质19的精确分子量,质谱条件为离子化方式为ESI(-),干燥气温度350 ℃,毛细管电压2.05 kV,得到的分子离子峰为m/z 830.483 5、m/z 770.461 4,与理论值相吻合,证明推测相对合理。
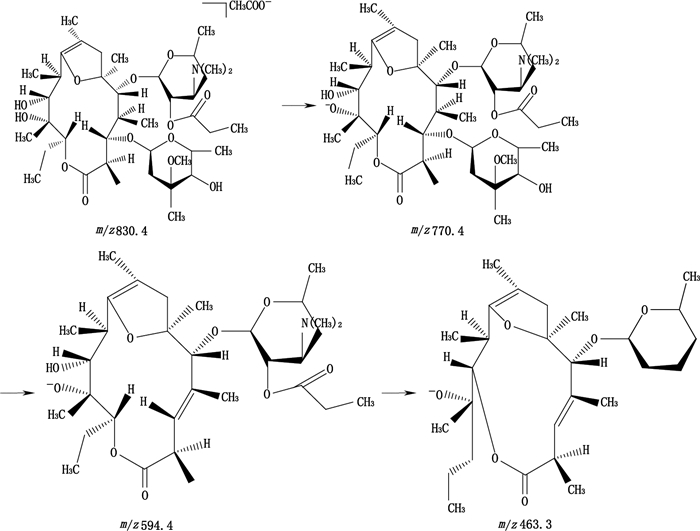
|
图 3 有关物质19可能裂解途径 Figure 3 Possible fragmentation pathway of the related substance 19 |
在130批药品中,红霉素A的含量平均值最高,红霉素A烯醇醚(EP中的杂质E)的含量较高,且数据离散程度较大,该成分与8号有关物质表红霉素A烯醇醚(EP中的杂质F)同为高温条件下的产物。6号有关物质为脱水红霉素A(EP中的杂质D),为酸解产物,在130批药品中,有18.5%的产品中检测不到该有关物质,在不同企业产品中的差异较大,表明这些有关物质应在生产过程中注意控制。
将130批样品的20个有关物质含量数据,运用SPSS 21.0统计分析软件,选用组间联结法(between-groups linkage)、Pearson相关性法进行聚类分析,结果见图 4。可见,14个厂家的130批依托红霉素片样品大致可分为2类。
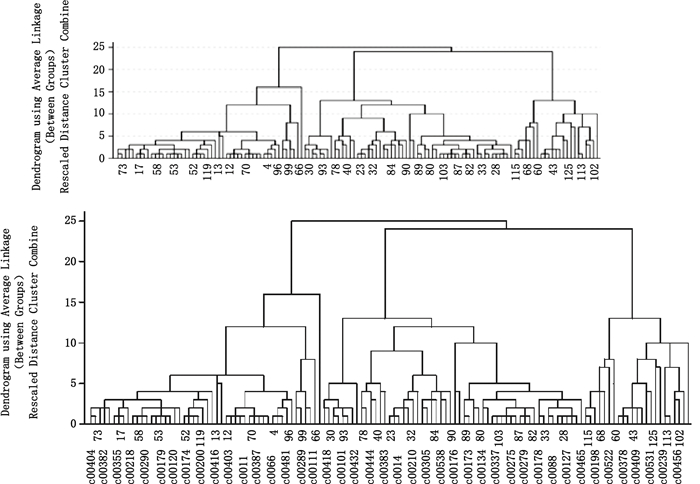
|
图 4 聚类分析图 Figure 4 Clustering analysis diagram |
将130批样品的20个有关物质含量数据,用SPSS 21.0统计分析软件进行主成分分析。对因子进行提取后,发现前3个公共因子的累积贡献率达94.089%,因此提取3个公共因子分别作为X、Y、Z坐标轴作图,其进行分类的结果见图 5。
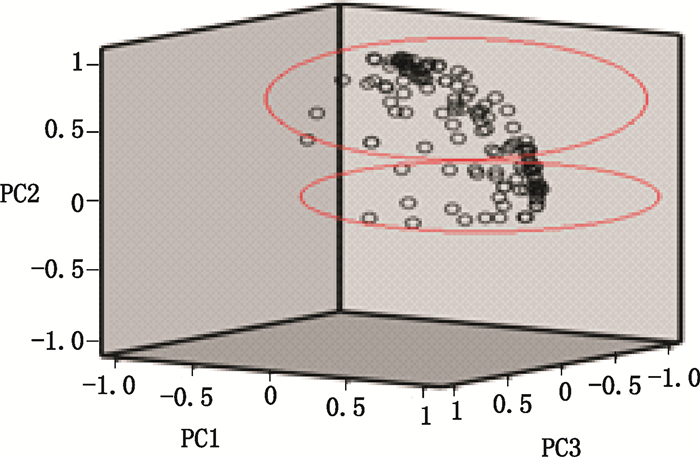
|
图 5 主成分分析图 Figure 5 Principal component analysis |
聚类分析与主成分分析的结果基本一致,可以将130批依托红霉素片样品分为2类,分析这2类样品之间的差异发现,所有130批制剂生产所用的依托红霉素原料均来自于厂家Ⅰ和Ⅱ,而这2类制剂样品所用的原料来源恰好不同。说明使用不同的原料,生产出的制剂产品的有关物质很可能存在差异。
对制剂生产企业提供的原料进行有关物质考察,将含量平均值与对应制剂样品(使用原料分别来源于这2家企业)中3、5、6、14、19号这5个主要有关物质的含量平均值进行了比较,结果见表 2。
|
|
表 2 不同原料来源的制剂产品、不同原料中的5个主要有关物质含量平均值(%) Table 2 Average content of the five main impurities in different drug products and bulk samples |
直观上看,制剂中的红霉素A、脱水红霉素A和有关物质19与原料中对应的红霉素A、脱水红霉素A和有关物质19的含量可能有关。进一步分别以有关物质3、红霉素A、脱水红霉素A、红霉素A烯醇醚和有关物质19为指标,将分别以厂家Ⅰ和Ⅱ原料生产的2类制剂的检测结果进行独立样本t检验的统计学分析,结果显示:有关物质3,P=0.401 > 0.05;红霉素A,P=0.000 < 0.05;脱水红霉素A,P=0.000 < 0.05;红霉素A烯醇醚,P=0.001 < 0.05;有关物质19,P=0.000 < 0.05。说明130批依托红霉素片剂中,原料来源不同的2类制剂样品中,有关物质3的含量差异并不显著,但含有的红霉素A、脱水红霉素A、红霉素A烯醇醚、有关物质19有显著性差异。结合表 2中的有关物质数据分析,说明依托红霉素片剂中的2个已知有关物质(红霉素A、脱水红霉素A)及有关物质19(推断为红霉素A丙酸酯烯醇醚)的含量与原料来源密切相关。
将14个不同厂家的依托红霉素片置于温度60 ℃、相对湿度80%的恒温恒湿箱内,放置3个月后依法测定,杂质个数无明显增加,杂质总量平均值增加2.36%,单个杂质平均值最大增加0.60%。样品在高温、高湿的强力破坏试验中变化并不十分剧烈,说明该样品在流通领域过程中质量指标变化可能相对较小,而控制原料有关物质含量是降低制剂有关物质含量的关键。
| [1] |
万兴平. 依托红霉素片制备工艺优化的研究[J]. 海峡药学, 2014, 26(6): 24. WAN XP. Studies on the optimization process for erythromycin estolate tablets[J]. Strait Pharm J, 2014, 26(6): 24. |
| [2] |
中国药典2015年版. 二部[S]. 2015: 661 ChP 2015.Vol Ⅱ[S].2015:661 |
| [3] |
USP 38-NF 33[S].2015:3451
|
| [4] |
CACHET TH, DELRUE M, PAESEN J, et al. Analysis of erythromycin estolate by liquid chromatography[J]. J Pharm Biomed Anal, 1992, 10(10-12): 851. DOI:10.1016/0731-7085(91)80091-M |
| [5] |
LAI CC, TSAI PL, YU C, et al. Analysis of a commercial preparation of erythromycin estolates by tandem mass spectrometry and high performance liguid chromatography/electrospray ionization tandem mass spectrometry using an ion trap mass spectrometer[J]. Rapid Commun Mass Spetrom, 2000, 14(6): 468. DOI:10.1002/(ISSN)1097-0231 |
| [6] |
KUMAR CHITNENI S, GOVAERTS C, ADAMS E, et al. Identification of impurities in erythromycin by liquid chromatography mass spectrometric detection[J]. J Chromatogr A, 2004, 1056(1-2): 111. DOI:10.1016/j.chroma.2004.07.091 |
| [7] |
刘珂. HPLC法测定注射用乳糖酸红霉素中的有关物质[J]. 中国药事, 2010, 24(5): 486. LIU K. Determination of related substances of erythromycin lactobionate for injection by HPLC[J]. Chin Pharm Aff, 2010, 24(5): 486. |
| [8] |
陈悦. 反相HPLC分析硫氰酸红霉素的相关物质及主组分含量[J]. 中国药学杂志, 2007, 42(23): 1822. CHEN Y. Determination of erythromycin thiocyanate and its related substances by reversed phase-high performance liquid chromatography[J]. Chin Pharm J, 2007, 42(23): 1822. DOI:10.3321/j.issn:1001-2494.2007.23.017 |
| [9] |
傅蓉, 赵晓冬, 刘杨. 红霉素眼膏中红霉素组分测定的研究[J]. 中国抗生素杂志, 2015, 40(12): 938. FU R, ZHAO XD, LIU Y. Research on the determination of erythromycin components of erythromycin ophthalmic ointment[J]. Chin J Antibiot, 2015, 40(12): 938. DOI:10.3969/j.issn.1001-8689.2015.12.011 |
| [10] |
DEBREMAEKER D, VISKY D, CHEPKWONY HK, et al. Analysis of unknown compounds in azithromycin bulk samples with liquid chromatography coupled to ion trap mass spectrometry[J]. Rapid Commun Mass Spectrom, 2003, 17(4): 342. DOI:10.1002/(ISSN)1097-0231 |
| [11] |
胡守刚, 郭寅龙, 吕龙. 红霉素类抗生素的自身化学电离质谱研究[J]. 有机化学, 2000, 20(5): 778. HU SG, GUO YL, LÜ L. Study of erythromycin antibiotics by self-chemical ionization mass spectrometry[J]. Chin J Org Chem, 2000, 20(5): 778. |
| [12] |
王明娟, 胡昌勤. 采用串联质谱法建立大环内酯类抗生素杂质谱的思路[J]. 药学学报, 2013, 48(5): 642. WANG MJ, HU CQ. Impurity profiling of macrolide antibiotics by liquid chromatography-mass spectrometry[J]. Acta Pharm Sin, 2013, 48(5): 642. |
| [13] |
黄珊, 李悦, 朱红激. 大环内酯类抗生素杂质谱研究进展[J]. 中国医药工业杂志, 2015, 46(3): 299. HUANG S, LI Y, ZHU HJ. Research progress of impurity profiles in macrolide antibiotics[J]. Chin J Pharm, 2015, 46(3): 299. |
| [14] |
金婵, 王敏, 娜琴, 等. 盐酸特拉唑嗪有关物质的色谱-质谱结构鉴定[J]. 药物分析杂志, 2014, 34(11): 2010. JIN C, WANG M, NA Q, et al. Identification of related substances in terazosin hydrochloride with hyphenated techniques[J]. Chin J Pharm Anal, 2014, 34(11): 2010. |
| [15] |
顾霄, 康铁纯, 郑金琪. 西洛他唑有关物质的色谱-质谱结构鉴定[J]. 药物分析杂志, 2015, 35(11): 1971. GU X, KANG TC, ZHENG JQ. Structure identification of related substances in cilostazol with hyphenated techniques[J]. Chin J Pharm Anal, 2015, 35(11): 1971. |
| [16] |
EP 8.0[S].2015:2154
|
 2017, Vol. 37
2017, Vol. 37 
