2. 沧州医学高等专科学校, 沧州 061001
2. Cangzhou Medical College, Cangzhou 061001, China
山楂叶为蔷薇科山楂属植物山里红Grataegus pinnatifida Bge. var. major N. E. Br.或山楂Grataegus pinnatifida Bge.的干燥叶[1], 多产于我国北部, 野生资源丰富, 是一种常用天然药用植物。山楂叶主要含有黄酮类、有机酸类和一些微量元素, 具有活血化瘀、理气通脉、化脂降浊之功效[2-5]。
近年来, 采用HPLC-UV测定山楂叶中1个或多个黄酮成分[6-10]时有报道, 但该法必须在有对照品的情况下才能进行定性和定量分析, 据此所建立的山楂叶质量控制方法只能针对牡荆素鼠李糖苷、牡荆素葡萄糖苷等紫外吸收较强, 含量较高的成分进行测定, 对于山楂叶中的表儿茶素、山楂叶苷A等紫外吸收较弱的成分进行测定比较困难。
液质联用(LC-MS)是目前应用广泛的分析技术之一, 它将LC的高分离能力与MS的强大结构测定功能相结合, 为中药化学成分的快速分析提供了一个重要的新技术[11-15]。对于一些微量、痕量成分和紫外吸收弱的化合物, 用HPLC-UV分析可能找不到, 而MS具有较高的灵敏度, 很容易检测这些化合物。
本研究采用HPLC-DAD/ESI-MS联用技术, 对山楂叶中表儿茶素、绿原酸、牡荆素、金丝桃苷、牡荆素鼠李糖苷、牡荆素葡萄糖苷、芦丁、山楂叶苷A 8种化学成分进行鉴定和含量测定, 该法专属性强, 操作简便, 灵敏度高, 尤其增加了紫外吸收弱、不宜HPLC-UV检测的表儿茶素和山楂叶苷A的测定, 为提高山楂叶质量、增加检测指标提供了一种简单、高效的分析方法。
1 仪器、试剂与试药Agilent 1200 Series高效液相色谱仪, 6310型质谱仪(Agilent公司);Poroshell 120 SB-C18色谱柱(2.1 mm×100 mm 2.7 μm;填料:多孔层十八烷基硅烷键合硅胶;Agilent公司), AG-245型十万分之一电子分析天平(梅特勒-托利多公司);KQ-700型超声波清洗器(昆山市超声仪器有限公司)。
对照品表儿茶素(批号151107)、绿原酸(批号120416)、牡荆素(批号111009)、金丝桃苷(批号120105)、牡荆素鼠李糖苷(批号151024)、牡荆素葡萄糖苷(批号151103)、芦丁(批号120221)纯度均 > 98%, 均购于上海融禾医药科技有限公司, 山楂叶苷A(实验室自制, 纯度 > 98%);甲醇、乙腈为色谱纯, 哇哈哈纯净水, 其他试剂为分析纯。
10个产地33批山楂叶收集产地:河北(S1~S15)、山东(S16~S20)、辽宁(S21)、湖北(S22)、河南(S23~S24)、江苏(S25~S26)、四川(S27)、山西(S28~S30)、浙江(S31)、安徽(S32-S33), 经承德民族师范学院董建新教授鉴定为蔷薇科植物山里红Crataegus pinnatifida Bge. var. major N. E. Br.或山楂Crataegus pinnatifida Bge.的干燥叶。
2 方法与结果 2.1 测定条件色谱条件:采用Poroshell 120 SB-C18色谱柱(2.1 mm×100 mm 2.7 μm), 以0.1%甲酸水为流动相A, 乙腈为流动相B, 梯度洗脱(0~10 min, 10%B→18%B;10~25 min, 18%B→20%B;25~35 min, 20%B;35~40 min, 20%B→60%B;40~41 min, 60%B→90%B;41~50 min, 90%B), 流速0.15 mL·min-1, 检测波长320 nm, 柱温30 ℃, 进样量1 μL。
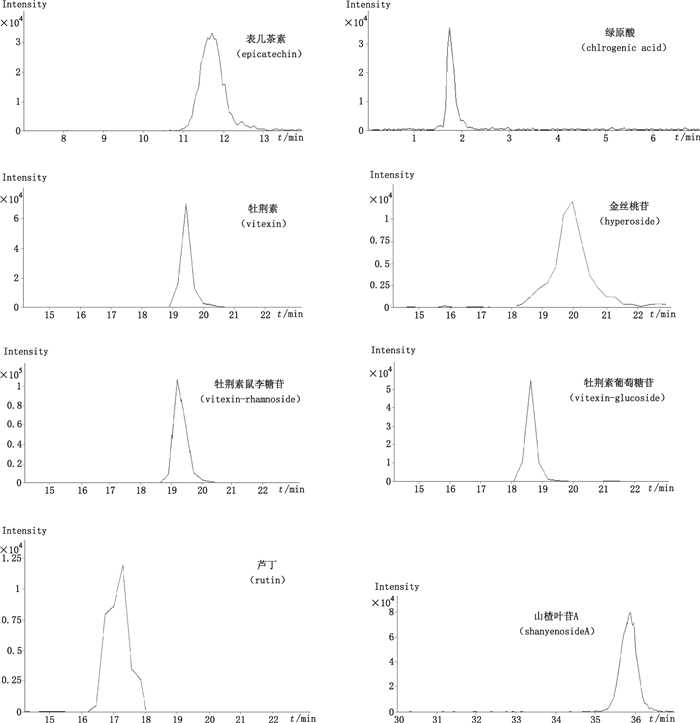
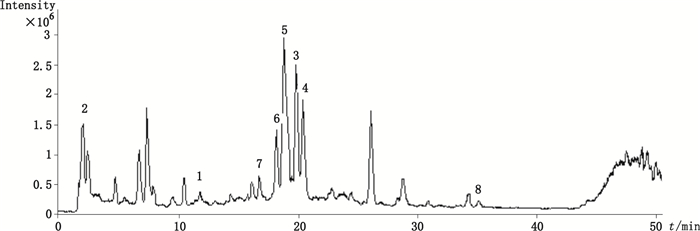
质谱条件:采用大气压电喷雾离子源(ESI), 负离子扫描, 采用多反应监测(MRM)模式(参数见表 1), 毛细管电压+3.750 kV, 毛细管出口电压-180.0 V, 扫描范围m/z 100~700, 氮气压力1.38×105 Pa, 干燥气流速12.0 L·min-1, 干燥气温度350 ℃。各对照品提取离子流色谱图见图 1, 样品(S8)总离子流色谱图见图 2。
|
|
表 1 8个化合物MRM模式参数 Table 1 The parameters of 8 compounds in MRM mode |
|
图 1 8个对照品多反应监测提取离子流图 Figure 1 Multiple reaction monitoring(MRM)chromatograms of 8 standards |
|
1.表儿茶素(epicatechin)2.绿原酸(chlrogenic acid)3.牡荆素(vitexin)4.金丝桃苷(hyperoside)5.牡荆素鼠李糖苷(vitexin-rhamnoside)6.牡荆素葡萄糖苷(vitexin-glucoside)7.芦丁(rutin)8.山楂叶苷A(shanyenoside A) 图 2 样品(S8)负离子模式总离子流图 Figure 2 The TIC of sample 8 in negative mode |
精密称取各对照品适量, 分别用甲醇制得含表儿茶素0.023 mg·mL-1, 绿原酸0.022 mg·mL-1, 牡荆素0.011 mg·mL-1, 金丝桃苷0.020 mg·mL-1, 牡荆素鼠李糖苷0.142 mg·mL-1, 牡荆素葡萄糖苷0.074 mg·mL-1, 芦丁0.033 mg·mL-1, 山楂叶苷A 0.020 mg·mL-1的单一对照品储备液, 使用时用甲醇稀释成不同浓度梯度的对照品溶液。
2.2.2 供试品溶液取山楂叶药材粉末(过60目筛)约0.5 g, 精密称定, 置具塞锥形瓶中, 精密加入60%甲醇水溶液25 mL, 称量, 超声(700 W, 40 kHz)提取30 min, 取出放冷至室温, 再称量, 用60%甲醇水溶液补足损失的量, 摇匀, 提取液于12 000 r·min-1离心10 min, 0.20 μm微孔滤膜过滤, 取续滤液, 即得。
2.3 方法学考察 2.3.1 线性关系考察及检测限、定量限测定按“2.2.1”项下方法, 制备各对照品溶液作为1号溶液, 倍比稀释, 制得单一对照品系列浓度溶液2、3、4、5、6号溶液。分别按“2.1”项下条件进样测定峰面积, 以浓度X为横坐标, 峰面积Y为纵坐标进行线性回归, 分别以S/N=3及S/N=10求得各组分的检测限及定量限, 结果见表 2。
|
|
表 2 8个化合物的回归方程、线性范围和LOD、LOQ Table 2 Regression equations, linear ranges, LOD and LOQ of 8 compounds |
精密吸取表儿茶素5.75 μg·mL-1、绿原酸5.5 μg·mL-1、牡荆素2.75 μg·mL-1、金丝桃苷5. 00 μg·mL-1、牡荆素鼠李糖苷35.5 μg·mL-1、牡荆素葡萄糖苷18.5 μg·mL-1、芦丁8.25 μg·mL-1、山楂叶苷A 5.00 μg·mL-1的对照品溶液各1 μL, 按“2.1”项下分析条件, 分别连续进样6次, 测定各个离子对峰面积, 计算表儿茶素、绿原酸、牡荆素、金丝桃苷、牡荆素鼠李糖苷、牡荆素葡萄糖苷、芦丁、山楂叶苷A的RSD均低于2.7%, 表明精密度良好。
2.3.3 稳定性试验取河北省山楂叶(S8)的供试品溶液, 按“2.1”项下分析条件分别在0、4、8、12、24、48 h进样测定, 结果表儿茶素、绿原酸、牡荆素、金丝桃苷、牡荆素鼠李糖苷、牡荆素葡萄糖苷、芦丁、山楂叶苷A峰面积的RSD均低于2.5%, 说明供试品溶液在48 h内稳定性良好。
2.3.4 重复性试验取河北省山楂叶(S8)6份, 每份约0.5 g, 按“2.2.2”项下方法制备供试品溶液, 按“2.1”项下分析条件进行测定, 结果表儿茶素、绿原酸、牡荆素、金丝桃苷、牡荆素鼠李糖苷、牡荆素葡萄糖苷、芦丁、山楂叶苷A含量的平均值分别为0.09、1.39、1.39、0.36、2.60、0.65、0.20、0.07 mg·g-1, RSD均低于2.3%, 表明试验重复性良好。
2.3.5 加样回收率试验取已知含量的河北省山楂叶(S8)6份, 每份约0.25 g, 精密称定, 分别精密加入对照品表儿茶素、绿原酸、牡荆素、金丝桃苷、牡荆素鼠李糖苷、牡荆素葡萄糖苷、芦丁、山楂叶苷A相当于0.25 g山楂叶所含的量, 按“2.2.2”项下方法制备供试溶液, 按“2.1”项下分析条件测定, 计算表儿茶素、绿原酸、牡荆素、金丝桃苷、牡荆素鼠李糖苷、牡荆素葡萄糖苷、芦丁、山楂叶苷A的回收率分别为101.7%、99.41%、96.20%、99.56%、101.3%、103.8%, 99.82%、100.2%, RSD分别为0.89%、2.6%、2.4%、2.7%, 1.5%、1.8%、1.6%、1.5%。
2.4 样品测定取33批山楂叶样品, 照“2.2.2”项下方法制备供试品溶液, 照“2.1”项下分析条件进行测定, 并作随行标准曲线计算, 测定结果见表 3。
|
|
表 3 33批样品含量测定结果(mg·g-1, n=3) Table 3 Results of the determination of 33 samples |
前期采用HPLC-UV同时测定了绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、牡荆素、芦丁、金丝桃苷6个成分的含量, 但表儿茶素和山楂叶苷A紫外吸收弱, 用HPLC-UV很难检测到, 采用HPLC-MS/MS法, MRM检测模式, 既可以增加检测灵敏度, 又可以增加检测指标, 实现了待测化合物的准确定量。
3.2 质谱条件优化遵循化合物的裂解规律, 优化质谱条件, 通过对照品筛选出子母离子的质荷比、MRM模式下最优的毛细管电压、毛细管出口电压、碰撞电压等参数。
3.3 含量比较分析本实验对10个产地33批山楂叶进行了8个成分的含量测定, 其中以河北省、山东省为主, 发现8个成分含量差别较大, 河北产山楂叶中8个成分含量范围分别为0.00~0.94、0.39~4.95、0.00~2.41、0.10~2.93、0.03~6.36、0.01~3.95、0.00~4.41、0.01~0.44 mg·g-1;山东产山楂叶中8个成分含量范围分别为0.00~0.85、1.15~2.91、0.00~5.45、0.29~2.23、0.16~3.81、0.03~0.84、0.02~1.02、0.00~0.35 mg·g-1;33批样品中表儿茶素、牡荆素、芦丁和山楂叶苷A在部分样品中检测不到, 而绿原酸、金丝桃苷、牡荆素葡萄糖苷和牡荆素鼠李糖苷为山楂叶主要成分, 在各样品中均能检测到, 但有较大差别, 可能与各地域条件、品种有关。
| [1] |
中国药典2015年版. 一部[S]. 2015: 32 ChP 2015.Vol Ⅰ[S].2015:32 |
| [2] |
耿慧春, 满莹, 赵智勇. 山楂叶化学成分和药理作用研究进展[J]. 中国现代医生, 2009, 47(26): 12. GENG HC, MAN Y, ZHAO ZY. Hawthorn leaf chemical components and pharmacological activity research progress[J]. China Mod Doct, 2009, 47(26): 12. DOI:10.3969/j.issn.1673-9701.2009.26.006 |
| [3] |
杨明宇, 潘伟东, 潘海峰. 山楂叶的化学成分研究[J]. 承德医学院学报, 2015, 32(6): 522. YANG MY, PAN WD, PAN HF. Studies on chemical constituents of hawthorn leaves[J]. J Chengde Med Coll, 2015, 32(6): 522. |
| [4] |
王领弟, 李艳荣, 潘海峰, 等. 山楂叶指纹图谱研究[J]. 中国实验方剂学杂志, 2011, 17(19): 74. WANG LD, LI YR, PAN HF, et al. HPLC fingerprint study of hawthorn leaf[J]. Chin J Exp Tradit Med Form, 2011, 17(19): 74. DOI:10.3969/j.issn.1005-9903.2011.19.023 |
| [5] |
王芳. 山楂叶总黄酮的药理作用[J]. 浙江中医药大学学报, 2010, 34(2): 295. WANG F. Discussion on pharmacological action of hawthorn leaves flavonoids[J]. J Zhejiang Chin Med Univ, 2010, 34(2): 295. |
| [6] |
王肖, 杜义龙, 赵胜男, 等. 承德产山楂叶中总黄酮和5种黄酮类成分含量的动态分析[J]. 中国实验方剂学杂志, 2013, 19(17): 171. WANG X, DU YL, ZHAO SN, et al. Dynamic analysis of total flavonoids and five flavonoid components in hawthorn leaves from Chengde[J]. Chin J Exp Tradit Med Form, 2013, 19(17): 171. |
| [7] |
潘海峰, 王领弟, 李艳荣, 等. HPLC法同时测定山玫胶囊中8个成分的含量[J]. 药物分析杂志, 2012, 32(11): 1962. PAN HF, WANG LD, LI YR, et al. Simultaneous determination of eight components in Shanmei capsules by HPLC[J]. Chin J Pharm Anal, 2012, 32(11): 1962. |
| [8] |
马坤芳, 王德旺, 都述虎, 等. HPLC法测定山楂叶中总黄酮的含量[J]. 中国药房, 2008, 19(33): 2599. MA KF, WANG DW, DU SH, et al. Determination of total flavonoids in leaves of Crataegus pinnatifida by HPLC[J]. China Pharm, 2008, 19(33): 2599. |
| [9] |
邹录惠, 邱莉, 焦杨, 等. SPE-HPLC-UV法测定山楂药材特征图谱研究[J]. 药物分析杂志, 2014, 34(9): 1597. ZOU LH, QIU L, JIAO Y, et al. Study on the characteristic chromatogram of hawthorn berries by SPE-HPLC-UV method[J]. Chin J Pharm Anal, 2014, 34(9): 1597. |
| [10] |
李化, 杨滨. RP-HPLC法测定山楂中黄酮类成分的含量[J]. 药物分析杂志, 2006, 26(7): 881. LI H, YANG B. RP-HPLC analysis of flavonoids in hawthorn fruits[J]. Chin J Pharm Anal, 2006, 26(7): 881. |
| [11] |
金力超, 范玉明, 侯晓蓉, 等. 色谱联用技术在药物分析中的应用特点和新趋势[J]. 药物分析杂志, 2015, 35(9): 1520. JIN LC, FAN YM, HOU XR, et al. Application and tendency of chromatographic hyphenated techniques in pharmaceutical analysis[J]. Chin J Pharm Anal, 2015, 35(9): 1520. |
| [12] |
任琦, 谢媛媛, 祖双, 等. 灯盏细辛中多酚类成分定性、定量的分析[J]. 药物分析杂志, 2013, 33(7): 1176. REN Q, XIE YY, ZU S, et al. Qualitative and quantitative analysis of polyphenols in Erigeron breviscapus[J]. Chin J Pharm Anal, 2013, 33(7): 1176. |
| [13] |
ZHU SR, YAN HY, NIU K, et al. Simultaneous determination of seven components from hawthorn leaves flavonoids in rat plasma by LC-MS/MS[J]. J Chromatogr Sci, 2015, 53: 909. DOI:10.1093/chromsci/bmu143 |
| [14] |
YANG HT, SHI H, ZHANG QY, et al. Simultaneous determination of five components in Aster tataricus by ultra performance liquid chromatography-tandem mass spectrometry[J]. J Chromatogr Sci, 2016, 54(4): 500. DOI:10.1093/chromsci/bmv171 |
| [15] |
LIANG XR, ZHAO C, SU WK. Multi-constituent determination and fingerprint analysis of Scutellaria indica L.using ultra high performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry[J]. J Sep Sci, 2015, 38(21): 3704. DOI:10.1002/jssc.201500485 |
 2017, Vol. 37
2017, Vol. 37 