亚胺培南(imipenem,IMP)是一种碳青霉烯类抗生素,其作用特点是抗菌谱广、抗菌活性强以及对β内酰胺酶高度稳定,是治疗重症感染的一线用药。IMP在体内会被肾脏中的肾肽(DHP-1)酶快速代谢,其肾毒性也会因此增加。临床上,IMP常与DHP-1酶抑制剂西司他丁以1:1的比例同用[1]。有研究表明,当IMP的血药浓度达到致病菌MIC的4倍以上,且该浓度的维持时间占给药间隔的40%以上时,IMP才能发挥其最大的杀菌效应,减少耐药菌的产生,提高重症感染患者的治愈率[2-4]。
接受CRRT的重症感染患者,因为其病理、生理等多方面的原因,其体内药代动力学会发生较大的变化,因此,监测患者体内IMP的浓度、及时调整给药剂量及给药间隔对于提高临床治疗效果具有非常重要的意义[5-8]。
传统测定IMP浓度的方法多是高效液相色谱(HPLC)法,目前国内尚未有报道测定IMP血药浓度的HPLC-MS/MS法。为研究IMP在接受CRRT的重症患者体内的药代动力学以及为IMP的治疗药物浓度监测提供方法参考,本实验拟建立一种灵敏度高、特异性强、操作简单、稳定的UHPLC-MS/MS法。
1 实验材料 1.1 实验药品及试剂试验制剂注射用亚胺培南西司他丁钠(商品名:俊特,浙江海正药业股份有限公司);IMP对照品、内标美罗培南对照品(纯度≥98%)及2-(N-吗啉基)乙磺酸(MES)(纯度≥99%)(美国sigma公司);色谱纯乙腈(美国Fisher Scientific公司);色谱纯甲酸及醋酸铵(美国Mreda Technology Inc.公司);蒸馏水(香港屈臣氏公司);其它试剂均为分析纯及以上。
1.2 实验仪器超高液相色谱-三重四极杆质谱联用仪系统:自动进样器、二元泵、柱温箱以及控制系统(日本岛津公司);API 45000三重四极杆质谱仪(美国AB公司);v1.6.1 Analyst software工作站(美国AB公司);Allegra 64R高速低温离心机(美国Beckman Coulter公司)等。Phenomenex Kinetex® HILIC色谱柱(100mm×2.1 mm,2.6 μm,填料为纯硅胶)。
1.3 试验对象研究对象为2013年8月至2015年2月间收治于本院ICU中重症感染合并急性肾衰竭接受CRRT及IMP治疗的8例患者,体重(68.1±6.6)kg,血肌酐>195 μmol·L-1,24 h尿量 < 4.6 mL·h-1。该试验方案经河北医科大学第四医院伦理委员会批准,且所有患者均签署知情同意书。
2 方法与结果 2.1 标准溶液的配制精密称取5.00 mg亚胺培南对照品,加水溶解并转移至5 mL量瓶中,定容至刻度,得到浓度为1.00 mg·mL-1的对照品储备液,储存于-80 ℃冰箱,临用时稀释成浓度为80.00、50.00、25.00、12.50、6.25、3.13、1.56、0.78、0.39、0.20、0.10 μg·mL-1系列标准曲线工作液及高(80.00 μg·mL-1)、中(4.00 μg·mL-1)、低(0.20 μg·mL-1)3个浓度的质控(QC)工作液。
精密称取内标10.03 mg于10 mL量瓶中,加水溶解并定容至刻度,得到浓度为1.00 mg·mL-1的内标储备液,用50%乙腈溶液继续稀释得到浓度为2.00 μg·mL-1的内标工作液。
2.2 色谱条件色谱柱为Phenomenex Kinetex® HILIC(100mm× 2.1 mm,2.6 μm;填料:纯硅胶);流动相为0.1%甲酸、8 mmol·L-1乙酸铵溶液(B)-0.1%甲酸乙腈溶液(A);梯度洗脱程序见表 1;流速为0.3 mL·min-1;进样体积为5 μL,进样器温度为4 ℃;柱温为40 ℃。
|
|
表 1 IMP梯度洗脱程序 Table 1 The gradient elution program for IMP |
电喷雾离子源(ESI),扫描方式为正离子模式,MRM扫描;IMP定量离子对为m/z 300.0→m/z 142.0,内标为m/z 384.1→m/z 141.1;离子喷雾电压为5.5 kV;干燥气温度为500 ℃;IMP离子去簇电压(DP)为60 V,内标为65 V;IMP碰撞能电压(CE)为30 V,内标为25 V。IMP及内标的二级质谱图见图 1。
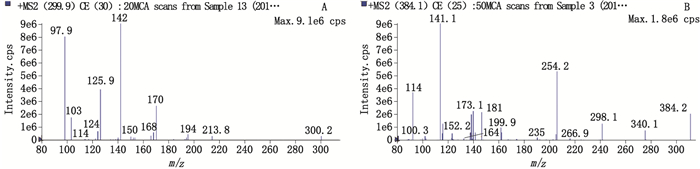
|
图 1 亚胺培南(A)及内标(B)的二级质谱图 Figure 1 Two stage mass spectrum of IMP(A) and IS(B) |
标曲及质控样品:100 μL空白人血浆-0.5 mol·L-1 MES混合物(1:1,v/v)加入30 μL内标、30 μL QC或标曲工作液、100 μL水以及800 μL乙腈,涡旋混匀1 min,4 ℃,12 000 g离心10 min,取上清液5 μL进样。
2.5 方法学验证 2.5.1 专属性考察取空白人血浆与MES混合物100 μL,内标及IMP样品以等量溶剂代替,其余按“2.4”项下操作,得到空白基质样品色谱图(图 2-A);按“2.4”项下操作,得到空白基质加IMP及内标色谱图(图 2-B);取临床血样依法操作,得到生物样品色谱图(图 2-C)。结果显示,IMP及内标的保留时间分别为4.5 min及4.6 min,基质对测定无干扰。
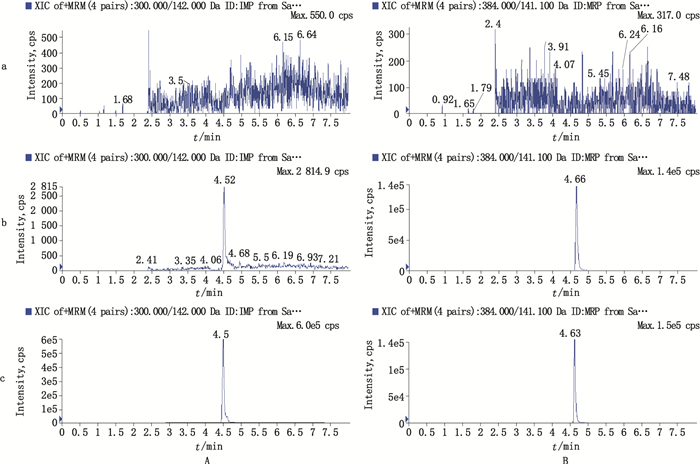
|
a.空白血浆(blank human plasma) b.空白血浆加亚胺培南(LLOQ:0.10 μg·mL-1和内标(2.00 μg·mL-1)(blank human plasma spiked with IMP(LLOQ:0.1 μg·mL-1)and IS(2 μg·mL-1)) c.给药后0.5 h患者血浆(patient plasma sample 0.5 h after intravenous infusion) 图 2 亚胺培南(A)及内标(B)的典型色谱图 Figure 2 Typical chromatograms of IMP(A) and IS(B) |
取空白人血浆与MES混合物100 μL,加入系列标准曲线工作液,按“2.4”项下操作,建立标准曲线。以待测物与内标的峰面积之比(A/Ai)为纵坐标,IMP浓度为横坐标进行加权回归(权重为1/X2),得到回归方程:
| $ Y = 0.221X + 0.000608\;\;\;\;\;\;r = 0.9973 $ |
结果显示,本法定量范围为0.10~80.00 μg·mL-1,最低定量限为0.10 μg·mL-1,信噪比为10.6,r>0.99。
2.5.3 精密度、准确度、回收率及基质效应考察按“2.4”项下加入QC工作液操作,结果显示,不同浓度IMP的日内、日间精密度及准确度均符合要求。
另取空白血浆-MES混合物,取蛋白沉淀后的上清液加入QC工作液,得到提取后添加样品峰面积,以QC样品峰面积/提取后添加样品峰面积(%)表示提取回收率。结果显示,方法的提取回收率在86%~92%之间。
以溶剂100 μL代替上述空白血浆-MES混合物,按“2.4”项下操作,得到标准溶液样品峰面积;以QC样品峰面积/标准溶液样品峰面积(%)表示基质效应。结果显示,方法的基质效均小于15%,符合规定,结果见表 2。
|
|
表 2 方法精密度、准确度、回收率及基质效应考察结果(mean±SD,n=5) Table 2 The precise, accuracy, recovery and matrix effect for IMP in human plasma |
分别考察QC血浆样品处理前室温放置4 h、-80 ℃冻存2个月的稳定性,样品处理后自动进样器放置12 h的稳定性以及冻融稳定性。结果表明,IMP在各条件下均较稳定,RSD小于11%,结果见表 3。
|
|
表 3 血浆中IMP中不同放置条件下的稳定性结果(n=5) Table 3 The stability of IMP in human plasma in different storage conditions(data were expressed as mean±SD) |
每名患者接受注射用亚胺培南西司他丁钠1 g(亚胺培南0.5 g,西司他丁钠0.5 g)静脉滴注30 min,给药间隔时间为8 h。待达到稳态后,分别于0 h(输注前),0.25、0.5、0.75、1、2、5、8 h取血于肝素化离心管中,4℃,3 000 g离心10 min,取上清,立即以1:1的比例加入0.5 mol·L-1 MES混匀,-80℃保存待测。测定时室温融化,100 μL血浆-0.5 mol·L-1 MES混合物(1:1)加入30 μL内标、130 μL水以及800 μL乙腈,其余按“2.4”项下操作。
采用DAS 3.0非房室模型计算IMP的药动学参数。8名患者30 min内静脉滴注IMP后的平均血药浓度-时间曲线见图 3,药动学参数见表 4。
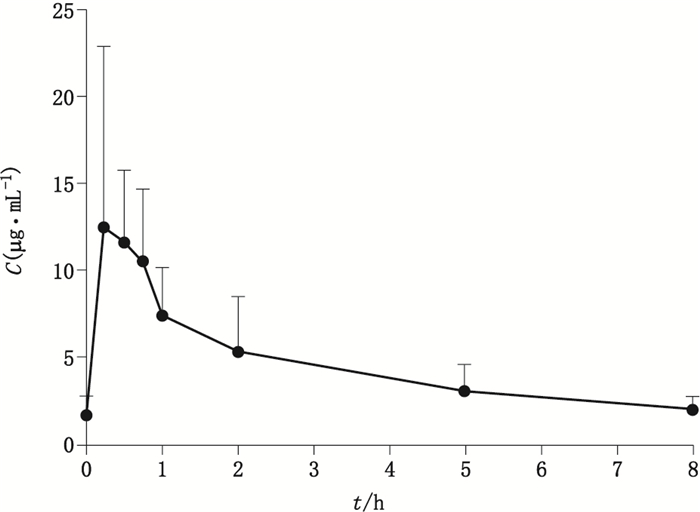
|
图 3 CRRT患者静脉滴注亚胺培南后的平均药时曲线(n= 8) Figure 3 Plasma concentration-time profiles of IMP after intravenous infusion.(Data were expressed as mean±SD) |
|
|
表 4 不同受试者体内亚胺培南的主要药动学参数 Table 4 The main pharmacokinetic parameters of IMP in healthy volunteers and patients(data were expressed as mean±SD) |
传统测定IMP血药浓度的方法HPLC法[2, 11-17]、微生物法[9, 18-19]以及琼脂扩散法[10, 20]等等,这些方法或操作烦琐耗时、或灵敏度低、或需要的样本量大等,都不太适用于IMP的TDM。近些年来快速发展起来的高效液相串联质谱(HPLC-MS/MS)法,其高选择性、高灵敏度、所需样本量小等特点使其在TDM中具有明显的优势,但是目前国内却没有测定人血浆中IMP相关的方法报道。
参考文献报道[21-25],本实验考察了不同的色谱及质谱条件,并通过优化DP、CE、洗脱溶剂、洗脱梯度等,最终确定了目标化合物峰形、保留时间、响应值及信噪比等都较好的条件,并进行了系统的方法学考察,建立了测定人血浆中IMP浓度的UPLC-MS/MS方法。
IMP水溶液在室温及4℃都不稳定,为了确保IMP对照品浓度的准确性,本实验将标准溶液储备液置于-80 ℃保存,临用时才稀释成工作液[11, 26]。同时为了保证血浆样品中IMP的稳定性,通过查阅文献[2, 11],本实验采用了0.5 mol·L-1 MES作为稳定剂,并对此进行了考察。稳定性考察结果显示,加入MES的血浆样品在处理过程中,IMP相对稳定。血浆样品冻融1次(-20 ℃冻存,室温融化)的稳定性良好,而反复冻融2次或3次,样品均不稳定(准确度 < 80%)。该结果提示,在样品测定中应避免样品反复冻融,以免影响测定结果的准确性。
对本院ICU患者体内药动学研究结果显示,与文献报道的健康受试者相比,CRRT患者的t1/2延长,表观分布容积(V)增加,而清除率(CL)、药时曲线下面积(AUC)及达峰浓度相差不大;与文献报道的CVVH患者体内药代动力学参数相似,见表 4。临床在制订治疗方案时,应考虑这些因素的影响。
综上所述,本文建立了一种UPLC-MS/MS法测定人血浆中亚胺培南的浓度,该法快速、灵敏,可用于IMP药代动力学研究和临床治疗药物浓度监测。
| [1] |
BAUGHMAN RP. The use of carbapenems in the treatment of serious infections[J]. J Intensive Care Med, 2009, 24(4): 230. DOI:10.1177/0885066609335660 |
| [2] |
FISH DN, TEITELBAUM I, ABRAHAM E. Pharmacokinetics and pharmacodynamics of imipenem during continuous renal replacement therapy in critically ill patients[J]. Antimicrob Agents Chemother, 2005, 49(6): 2421. DOI:10.1128/AAC.49.6.2421-2428.2005 |
| [3] |
DRUSANO GL. Prevention of resistance:a goal for dose selection for antimicrobial agents[J]. Clin Infect Dis, 2003, 36(Suppl 1): S42. |
| [4] |
TAM VH, MCKINNON PS, AKINS RL, et al. Pharmacodynamics of cefepime in patients with Gram-negative infections[J]. J Antimicrob Chemother, 2002, 50(3): 425. DOI:10.1093/jac/dkf130 |
| [5] |
TROTMAN RL, WILLIAMSON JC, SHOEMAKER DM, et al. Antibiotic dosing in critically ill adult patients receiving continuous renal replacement therapy[J]. Clin Infect Dis, 2005, 41(8): 1159. DOI:10.1086/444500 |
| [6] |
BELZBERG H, ZHU J, CORNWELL EE, et al. Imipenem levels are not predictable in the critically ill patient[J]. J Trauma, 2004, 56(1): 111. DOI:10.1097/01.TA.0000056164.26493.28 |
| [7] |
COTTON A, FRANKLIN BD, BRETT S, et al. Using imipenem and cilastatin during continuous renal replacement therapy[J]. Pharm World Sci, 2005, 27(5): 371. DOI:10.1007/s11096-005-1636-x |
| [8] |
姜利. 持续性肾脏替代治疗的药物剂量调整[J]. 中国实用内科杂志, 2012, 32(06): 426. JIANG L. Drug dosing in continuous renal replacement therapy[J]. Chin J Prac Intern Med, 2012, 32(06): 426. |
| [9] |
曹国颖, 孙春华, 万一英, 等. 健康人静滴泰宁的药代动力学研究[J]. 中国新药杂志, 1992, 1(06): 51. CAO GY, SUN CH, WAN YY, et al. Pharmacokinetics of tienam in healthy volunteers[J]. Chin J New Drugs, 1992, 1(06): 51. |
| [10] |
张存海, 蔡洪流, 方强. 亚胺培南在无尿CVVH治疗患者的药代动力学研究[J]. 中国实用医药, 2008, 3(01): 5. ZHANG CH, CAI HL, FANG Q. Study on pharmacokinetics of imipenem in patients during continuous venovenous hemofiltration[J]. China Pract Med, 2008, 3(01): 5. DOI:10.3969/j.issn.1673-7555.2008.01.003 |
| [11] |
DAILLY E, BOUQUIé R, DESLANDES G, et al. A liquid chromatography assay for a quantification of doripenem, ertapenem, imipenem, meropenem concentrations in human plasma:application to a clinical pharmacokinetic study[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2011, 879(15-16): 1137. DOI:10.1016/j.jchromb.2011.03.038 |
| [12] |
FERNáNDEZ-TORRES R, BELLO-LóPEZ MA, CALLEJóN-MOCHóN M, et al. Determination of imipenem and rifampicin in mouse plasma by high performance liquid chromatography-diode array detection[J]. Anal Chim Acta, 2008, 608(2): 204. DOI:10.1016/j.aca.2007.12.026 |
| [13] |
温爱萍, 李哲, 李任, 等. HPLC法测定人血浆中游离亚胺培南浓度[J]. 中国药物应用与监测, 2015, 12(03): 151. WEN AP, LI Z, LI R, et al. Determination of free imipenem in human plasma by HPLC[J]. Chin J Drug Appl Monit, 2015, 12(03): 151. |
| [14] |
APARICIO I, BELLO MA, CALLEJóN M, et al. Liquid chromatographic method for the simultaneous determination of imipenem and sulbactam in mouse plasma[J]. J Chromatogr Sci, 2006, 44(9): 548. DOI:10.1093/chromsci/44.9.548 |
| [15] |
ABDEL-MOETY EM, ELRAGEHY NA, HASSAN NY, et al. Selective determination of ertapenem and imipenem in the presence of their degradants[J]. J Chromatogr Sci, 2010, 48(8): 624. DOI:10.1093/chromsci/48.8.624 |
| [16] |
LóPEZ KJ, BERTOLUCI DF, VICENTE KM, et al. Simultaneous determination of cefepime, vancomycin and imipenem in human plasma of burn patients by high-performance liquid chromatography[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2007, 860(2): 241. DOI:10.1016/j.jchromb.2007.10.041 |
| [17] |
郭楠, 詹莹, 邵华, 等. 高效液相色谱法测定重症患者的亚胺培南血药浓度[J]. 中国临床药理学杂志, 2015, 31(08): 645. GUO N, ZHAN Y, SHAO H, et al. Determination of imipenem in plasma of critically ill patients by high performance liquid chromatography method[J]. Chin J Clin Pharmacol, 2015, 31(08): 645. |
| [18] |
ADAMIS G, PAPAIOANNOU MG, GIAMARELLOS-BOURBOULIS EJ, et al. Pharmacokinetic interactions of ceftazidime, imipenem and aztreonam with amikacin in healthy volunteers[J]. Int J Antimicrob Agents, 2004, 23(2): 144. DOI:10.1016/j.ijantimicag.2003.07.001 |
| [19] |
曹国颖, 万冀英. 泰宁在健康人及血液透析尿毒症患者中药代动力学研究[J]. 中国新药杂志, 1994, 3(01): 48. CAO GY, WAN JY. Pharmacokinetics of tienam in healthy volunteers and uremic patients undergoing hemodialysis[J]. Chin J New Drugs, 1994, 3(01): 48. |
| [20] |
NOVELLI A, ADEMBRI C, LIVI P, et al. Pharmacokinetic evaluation of meropenem and imipenem in critically ill patients with sepsis[J]. Clin Pharmacokinet, 2005, 44(5): 539. DOI:10.2165/00003088-200544050-00007 |
| [21] |
HUANG L, HAAGENSEN J, VEROTTA D, et al. Determination of meropenem in bacterial media by LC-MS/MS[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2014, 961: 71. DOI:10.1016/j.jchromb.2014.05.002 |
| [22] |
XU Y, XIE W, MILLER-STEIN CM, et al. Hydrophilic interaction chromatography/tandem mass spectrometry for the simultaneous determination of three polar non-structurally related compounds, imipenem, cilastatin and an investigational beta-lactamase inhibitor, MK-4698, in biological matrices[J]. Rapid Commun Mass Spectrom, 2009, 23(14): 2195. DOI:10.1002/rcm.v23:14 |
| [23] |
HU ZY, BOUCHER BA, LAIZURE SC, et al. Nonvolatile salt-free stabilizer for the quantification of polar imipenem and cilastatin in human plasma using hydrophilic interaction chromatography/quadrupole mass spectrometry with contamination sensitive off-axis electrospray[J]. J Mass Spectrom, 2013, 48(8): 945. DOI:10.1002/jms.3240 |
| [24] |
CARLIER M, STOVE V, ROBERTS JA, et al. Quantification of seven β-lactam antibiotics and two β-lactamase inhibitors in human plasma using a validated UPLC-MS/MS method[J]. Int J Antimicrob Agents, 2012, 40(5): 416. DOI:10.1016/j.ijantimicag.2012.06.022 |
| [25] |
OHMORI T, SUZUKI A, NIWA T, et al. Simultaneous determination of eight β-lactam antibiotics in human serum by liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2011, 879(15-16): 1038. DOI:10.1016/j.jchromb.2011.03.001 |
| [26] |
VIAENE E, CHANTEUX H, SERVAIS H, et al. Comparative stability studies of antipseudomonal beta-lactams for potential administration through portable elastomeric pumps(home therapy for cystic fibrosis patients) and motor-operated syringes(intensive care units)[J]. Antimicrob Agents Chemother, 2002, 46(8): 2327. DOI:10.1128/AAC.46.8.2327-2332.2002 |
 2017, Vol. 37
2017, Vol. 37 
