血管支架植入术是介入治疗动脉血管狭窄的一种非常有效治疗手段,但在临床实践中,普通金属裸支架植入血管后,容易产生增生反应和细胞外基质的沉淀导致血管再狭窄[1-2]。针对术后再狭窄的防治,涌现出许多良好的改进方法,其中药物洗脱支架(drug eluting stent,DES)临床应用越来越多[3],它既能为血管提供弹性支撑,又能通过局部缓慢释放雷帕霉素来抑制血管平滑肌细胞的增殖和迁移,从而减少血管再狭窄。
药物体外释放度是评估DES的一个关键参数。目前,药物体外释放度有恒温振荡法[4],溶出度法[5],改装的USP < 724 > Drug release第七法[6],以及陈玉成[7]等设计模拟心脏泵血的装置。其中前两种方法基于口服药物原理模拟体内释放试验,完全没有考虑血管植入支架的特殊生理环境,后两种实验只模拟了血液冲刷的流速,也没有考虑血管内支架承受的脉冲压力以及血管壁的作用。本文采用创新设计的新型模拟心脏血流形态释放装置测定支架上雷帕霉素药物的释放度,充分模拟血管支架在体内承受的脉冲频率、脉冲压力、脉冲流量和血管的顺应性,保证释放试验更加贴合临床应用的实际,为其释放度研究提供参考。
1 仪器与试药Waters2695高效液相色谱仪(柱温箱,紫外检测器,四元泵,在线脱气机,自动进样器);微量电子天平(Mettler Toledo XP6,分辨率0.001 mg);模拟血管(顺应性5%~7%,东易中美科技(北京)有限公司)。色谱柱:Agilent ODS(250 mm×4.6 mm,5μm;填料:十八烷基硅烷键合硅胶;安捷伦仪器公司)
雷帕霉素对照品(北京世纪奥科生物技术有限公司,HPLC含量为98.48%,批号:151207);冠脉雷帕霉素洗脱钴基合金支架系统(上海微创医疗器械(集团)有限公司,规格:2.5 mm×13 mm);甲醇、乙腈和丙酮(HPLC级,Merck公司);十二烷基硫酸钠(SDS)(Genebase公司,生物纯);超纯水(18.2 MΩ)来自经计量后自购设备(Milli-Q Advantage A10,Millipore公司)。
2 新型的模拟心脏血流形态释放装置的工作原理血管支架大多数植入具有一定顺应性的血管中,其轴向承受一定脉动频率的血液冲刷,径向承受80~160 mmHg的脉动压力。本文使用的模拟心脏血流形态释放装置如图 1所示。该装置完全模拟血管支架在体内承受的脉冲频率[(72±1)次·min-1]、脉冲压力(80~160 mmHg)、脉冲流量(80 mL·min-1)的生理环境,使DES体内药物释放过程更加符合临床应用的实际状况。
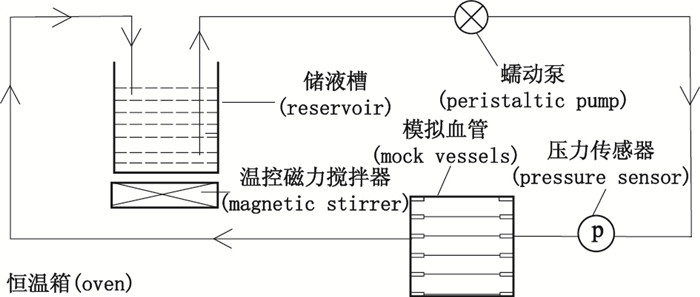
|
图 1 药物释放装置示意图 Figure 1 Schematic diagram of simulating dissolution device for drug release of DES |
标准溶液:用微量电子天平精密称取雷帕霉素对照品约5 mg置于10 mL量瓶中,用适量乙腈溶解后,加入丙酮0.5 mL,再用乙腈定容至刻度,混匀作为储备液。稀释上述对照品溶液至0.5~50 μg·mL-1(n≥5)的标准系列溶液,用高效液相色谱法测其吸收峰面积,绘制标准曲线方程。
样品溶液:小心压扁支架后置于10 mL量瓶中,用加入0.5 mL丙酮浸提支架3 min,用乙腈定容至10 mL,混匀后作为样品溶液。
3.2 雷帕霉素药物支架的体外释放试验本次共采用20根含药支架进行药物释放试验,其中2根作为初始载药量测定,其余18根支架用于6个释放点试验,其中每个释放点试验平行3份。释放介质为0.1%(g·mL-1)的十二烷基硫酸钠水溶液1 000 mL,置于三角锥形瓶中,超声(53 kHz)脱气15 min,然后置于药物释放装置的磁力搅拌器上。将药物支架依次间隔的扩充安装到6根平行的模拟血管上。启动蠕动泵并调节泵流速为80 mL·min-1,开启外箱空气加热部分,待恒温箱温度稳定在(37±1)℃后开始计时。到达释放时间点(2 h、24 h、3 d、7 d、14 d和28 d)后,取下相应的支架,用纯化水冲洗支架表面的释放介质,再用无尘纸吸干水分,然后按照上述雷帕霉素载药量测定方法,通过测定支架上残留的药物含量来间接计算药物的释放率。
3.3 色谱条件色谱柱:Agilent ODS(250 mm×4.6 mm,5 μm,填料:十八烷基硅烷键合硅胶);流动相:甲醇-乙腈-水(60:16:24);流速:1.0 mL·min-1;柱温:40 ℃;检测波长:277 nm;进样体积:20 μL。
3.4 雷帕霉素载药量测定的方法学验证 3.4.1 方法的专属性空白溶液测定时在雷帕霉素出峰位置处未见干扰峰,样品溶液色谱图中雷帕霉素的保留时间是标准溶液色谱图中雷帕霉素的保留时间的99.8%(见图 2)。结果显示,方法具有良好专属性。
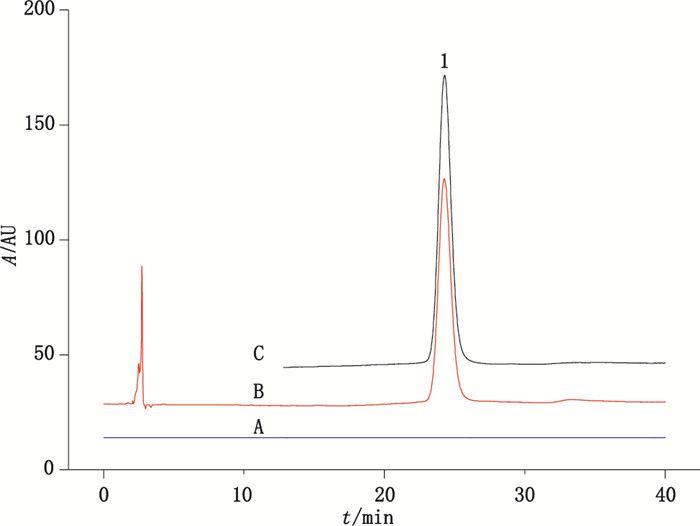
|
1.雷帕霉素(rapamycin)。 图 2 空白溶液(A)、标准溶液(B)和样品溶液(C)测定的色谱叠加图 Figure 2 Overlaid chromatograms of blank solution(A), standard solution(B) and sample solution(C) |
按照上述色谱条件测定雷帕霉素的标准溶液0.5、1.0、5.0、10.0、50.0 μg·mL-1,绘制标准曲线回归方程:
Y=6.198×104X–1.826×103 r=1.000
结果显示方法具有良好的线性关系。以0.5 μg·mL-1的雷帕霉素标准溶液作为定量限溶液,测定HPLC色谱图中雷帕霉素的信噪比为24,满足信噪比不小于10的要求。
3.4.3 精密度精密度试验分别取0.5、5、50 μg·mL-13个低中高浓度水平雷帕霉素标准溶液连续测定6次,计算RSD%为2.3%、1.5%、0.3%。
3.4.4 药物支架上雷帕霉素含量的测定取雷帕霉素支架2个,按照样品溶液制备方法进行处理,雷帕霉素含量为27.6 μg·mL-1。
3.4.5 回收率取9个裸支架于9个10 mL量瓶中,分别加入0.5 mL丙酮浸提支架3 min,然后向上述量瓶中分别加入雷帕霉素标准溶液使其浓度为5、15、25 μg·mL-1,每个浓度水平平行3份样,最后用乙腈定容至10 mL。测得的回收率结果为98.8%±1.6%、99.1%±0.9%、99.6%±0.6%(x±s,n=3)。
3.4.6 稳定性试验分别取“2.1”项下标准溶液(5 μg·mL-1)和样品溶液,置于室温环境中,测定24 h前后溶液中雷帕霉素的含量,结果标准溶液回收率为98.6%,样品溶液回收率为99.5%。表明溶液在24 h内是稳定的。
3.5 雷帕霉素体外释放试验结果按上述实验条件进行雷帕霉素释放度试验,结果如下图 3所示。从图 3可知,新型的模拟心脏血流形态释放装置在释放时间点2 h、24 h、3 d、7 d、14 d和28 d的放率结果分别为17.2%、39.2%、51.3%、66.9%、72.4%、82.8%。雷帕霉素的药物释放呈先快后慢的规律,当释放到28 d时,药物的释放率达到82.8%左右,该释放试验包含了释放初期,中期和后期3个阶段,能够起到考察药物体外释放规律的目的。
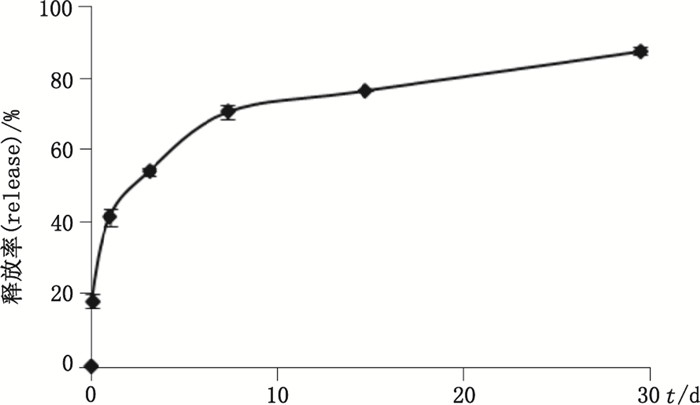
|
图 3 药物支架中雷帕霉素释放曲线(x±s,n=3) Figure 3 In vitro release profile of rapamycin from drug-eluting stents |
释放介质一般首选水作为基体,再根据具体药物给药途径添加合适的溶出介质。考虑血液的正常pH是在7.3~7.4之间,本文选择最常规pH约为7.4的0.1%SDS作为释放介质,通过水中添加SDS表面活性剂来调节药物的释放速率,同时满足血液pH使用环境。
4.2 漏槽试验本试验以0.1%SDS溶液为释放介质来了解雷帕霉素药物在该溶液中的漏槽条件。根据该释放装置的设计及支架载药量的规格,其体外释放试验中最大的雷帕霉素释放量为2.5 mg。当释放介质为1 000 mL,能溶解50 mg雷帕霉素,满足药物释放最大浓度的10倍小于雷帕霉素的饱和溶液浓度,所以该试验满足漏槽条件。
4.3 雷帕霉素在0.1%SDS溶液的稳定性本试验以0.1%SDS溶液作为释放介质,溶解雷帕霉素对照品至5 μg·mL-1,在(37±1)℃条件下放置72 h考察溶液的稳定性,结果显示,24、48、72 h的雷帕霉素含量回收率为94.4%、90.6%和80.7%。试验表明,雷帕霉素在0.1%SDS溶液中24 h就已经不稳定,所以本文选择测定支架上残留的雷帕霉素含量,来间接计算释放到溶液中的雷帕霉素含量,作为释放率的计算方法。
4.4 释放时间点的选择根据中国药典[8]及美国食品药品监督管理局针对冠状动脉洗脱支架的临床试验和非临床试验发布的作业指导文件[9],体外释放曲线图至少需要3个时间点,来分别体现药物释放的初期,中期和后期。基于本释放装置支架安放数量的限制,本文设计2 h、24 h、3 d、7 d、14 d和28 d6个时间点来监测雷帕霉素的释放率,包括了释放初期,中期和后期3个阶段,能够起到考察释放规律的目的。
4.5 雷帕霉素体外体内释放相关性的探讨药物体外释放性能的研究,能为处方筛选的指标及控制产品质量提供参考,如果能建立体内外相关性,则体外释放度测定不仅可以作为控制产品质量的指标,还可以在一定程度上预测产品的体内行为。目前,国内很少见药物血管支架释放的体内外相关性报道,国外相关研究有Wahid Khan等[10]将药物支架植入体内(兔子皮下)28 d,结果表明药物以持续释放的方式进行,而不是瞬间的释放方式。但该研究采用皮下植入的方式进行,与支架植入人体血管后所承受血流形态冲刷的生理环境并不一致。Ma[11]等研究了紫杉醇和雷帕霉素混合药物支架植入雄鼠的腹主动脉21 d的体内释放行为,结果表明,药物在体内的释放呈现前快后慢的趋势,当释放试验达到21 d后,雷帕霉素释放率为91.7%,药物基本释放完全。而本文设计的药物体外释放试验也呈现前快后慢的释放趋势,释放28 d后,药物也基本释放完全,与上述文献报道的体内释放趋势一致。因此,通过体内体外的释放规律比较可以看出,药物在体内外的释放具有相似性。
4.6 雷帕霉素释放曲线的拟合分析一般用数学模型对溶出度试验数据进行拟合来预测体外释放规律及释放机理,常用的缓释制剂的拟合模型列举如表 1,其中k为比例常数,t为释放时间(d),Mt为t时间内的药物释放量,M∞是当t趋向∞时的药物释放量。本文对上述雷帕霉素累计释放结果进行常规几种曲线的拟合[12-13],包括一级模型、Higuchi模型、Weibull模型、Ritger-Peppa模型、扩散-松弛模型、溶蚀模型和综合模型。拟合时相关系数(R)越大,拟合结果越佳,结果见表 1。由表 1结果可知,新型药物释放装置试验结果的拟合曲线比较符合综合模型。本文的综合模型是扩散松弛模型与溶蚀模型的综合体,从综合模型的拟合曲线可以看出,k1t1/2与Fick扩散有关,k2t项与松弛和溶蚀相关,而k3t2+k4t3项与溶蚀相关。因此,在药物体外释放初期,k1t1/2对综合模型的贡献最大,表明释放初期药物释放机理以扩散为主。随着时间的推移,k1t1/2项的扩散机理仍起到较大作用,同时k3t2+k4t3项溶蚀的贡献也越来越大,而k2t项表明在药物释放由扩散溶蚀机理为主的同时,受限于释药体系中可降解聚合物的溶胀松弛速度。
|
|
表 1 雷帕霉素释放拟合结果 Table 1 The fitted curve of rapamycin from drug-eluting release in vitro |
对于本文的DES而言,支架上的药物涂层由雷帕霉素和聚乳酸均匀混合后涂附于支架表面,其中聚乳酸属于可降解材料。药物在释放初期释放量较大,其突释现象主要由涂附于支架表面的药物释放导致,此时,药物支架表面浓度较浓,浓度梯度较大,药物释放以扩散为主。待表面层药物释放完后,药物的释放以聚合物的溶蚀和药物的扩散机理为主,同时聚合物的溶胀松弛又起到了限速缓释的作用[14-15],直到聚乳酸最终降解为二氧化碳和水,完成了载体作用,药物的释放才达到基本完全的程度。此过程与综合模型分析的机理基本一致。
综上所述,本新型药物释放装置的体外释放规律是前快后慢,释放机理为前期是扩散机理为主,中后期则以药物扩散和溶蚀共同协作为主,并受限于可降解聚合物溶胀松弛和降解速度。
本文采用了新型药物释放装置,完全模拟血管支架在体内承受的脉冲频率、脉冲压力、脉冲流量的生理环境,使DES体内药物释放过程更加符合临床应用的实际状况。对于DES而言,药物的扩散和溶蚀与药物载体聚合物的成分和特性密切相关。因此,载药支架在控制药物释放设计时,可降解聚合物的药物释放动力学不仅受到药物在释放介质中的扩散性能和溶解度所影响,同时也受到载体的降解与溶胀松弛特性影响,因此聚合物载体的选择对药物体外释放性能影响较大。此外,含药医疗器械产品属于药物研究领域特殊类型,药物分析尤其是药物体外释放性能的研究既需要借鉴成熟的药物制剂释放体系,同时也需要考虑医疗器械产品在体内植入时的特殊位置和释药时产品真实状态。
| [1] |
SCHIELE TM. Current understanding of coronary in-stent restenosis[J]. ZKardiol, 2005, 94(11): 772. |
| [2] |
钟杨, 武衡, 成志, 等. 雷帕霉素抑制血管平滑肌细胞增殖的研究进展[J]. 临床和实验医学杂志, 2009, 8(4): 130. ZHONG Y, WU H, CHENG Z, et al. The research progress of rapamycin in inhibiting the proliferation of vascular smooth muscle cells[J]. J Clin Experim Med, 2009, 8(4): 130. |
| [3] |
BRAMBILA N, FERRARIO M, REPETTO A, et al. Use of sirolimus-eluting stents for treatment of in-stent restenosis:long-term follow-up[J]. J Cardiov Med, 2007, 8(9): 699. DOI:10.2459/JCM.0b013e328010395d |
| [4] |
PAN CJ, TANG JJ, WENG YJ, et al. Preparation and characterization of rapamycin loaded PLGA coating stent[J]. J Master Sci:Master Med, 2007, 18(11): 2193. DOI:10.1007/s10856-007-3075-9 |
| [5] |
刘产明, 杜金梁. 不同调控方法对不锈钢支架表面紫杉醇释放性能的影响[J]. 南京中医药大学学报, 2004, 20(6): 353. LIU CM, DU JL. Experiment on in vitro dissolution rate of drug-bearing Nickel-titanium Alloy Stent[J]. J Nanjing Univ Chin Med, 2004, 20(6): 353. |
| [6] |
章娜, 冯晓明, 陈华. 雷帕霉素药物支架释放度测定[J]. 药物分析杂志, 2010, 30(7): 1385. ZHANG N, FENG XM, CHEN H. Release test of rapamycin in drug-eluting stents[J]. Chin J Pharm Anal, 2010, 30(7): 1385. |
| [7] |
陈玉成, 熊素彬, 幸浩洋, 等. 雷帕霉素缓释涂层支架在模拟心脏泵血状态下的体外释药研究[J]. 中国药学杂志, 2008, 43(9): 688. CHEN YC, XIONG SB, XING HY, et al. In vitro release of rapamycin in sustained eluting stent detected by a new designed circulating device[J]. Chin Pharm J, 2008, 43(9): 688. |
| [8] |
中国药典2015年版, 四部[S]. 2015: 通则9013: 368 ChP 2015.Vol Ⅳ[S].2015:General Chapter 9013:368 |
| [9] |
FDA Guidance for Industry Coronary Drug-Eluting Stent-Nonclinical and Clinical Studies[EB/OL].(2015-10-10)[2016-8-16].http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm228704.pdf,
|
| [10] |
KHAN W, FARAHS, NYSKAA, et al. Carrier free rapamycin loaded drug eluting stent:In vitro and in vivoevalution[J]. J Controll Rel, 2013, 168(1): 70. DOI:10.1016/j.jconrel.2013.02.012 |
| [11] |
MA XD, OYAMADA S, GAO F, et al. Paclitaxel/sirolimus combination coated drug-eluting stent:In vitro and in vivodrug release studies[J]. J Pharm Biomed Anal, 2011, 54(4): 807. DOI:10.1016/j.jpba.2010.10.027 |
| [12] |
周承刚. 药物洗脱支架的体外释放研究[D]. 南京: 东南大学, 2011 ZHOU CG.The In-vitro Release Study of Drug-elutingstents[D].Nanjing:Southeast University, 2011 http://d.wanfangdata.com.cn/Thesis/Y2021886 |
| [13] |
袁媛, 马元辉, 余璐, 等. 不同调控方法对不锈钢支架表面紫杉醇释放性能的影响[J]. 中国药学杂志, 2004, 39(7): 517. YUAN Y, MA YH, YU L, et al. Influence of different controlling methods on release property of paclitaxel from stainless steel stent surface[J]. Chin Pharm J, 2004, 39(7): 517. |
| [14] |
陈力, 刘砚韬, 黄亮, 等. 缓控释系统药物释放的数学模型研究进展[J]. 中国药业, 2008, 17(11): 1. CHENG L, LIU YT, HUANG L, et al. Research progress of mathematic model of sustained and controlled release system of drug release[J]. China Pharm, 2008, 17(11): 1. DOI:10.3969/j.issn.1006-4931.2008.11.001 |
| [15] |
刘洪泽, 齐民, 魏志勇, 等. 本体溶蚀型药物传输系统的数学模型[J]. 中国组织工程研究, 2009, 13(52): 10340. LIU HZ, QI M, WEI ZY, et al. Mathematic models of drug release for bulk erosion type drug delivery system[J]. Chin J Tissue Eng Res, 2009, 13(52): 10340. DOI:10.3969/j.issn.1673-8225.2009.52.029 |
 2017, Vol. 37
2017, Vol. 37 
