2. 中国食品药品检定研究院, 北京 102629;
3. 北京万泰生物药业股份有限公司, 北京 102206
2. National Institutes for Food and Drug Control, Beijing 102629, China;
3. Beijing Wantai Biological Pharmacy Enterprise Co., Beijing 102206, China
动物源性生物材料由于在结构和组织相容性等方面比金属、陶瓷、高分子聚合物等人工材料更具有优势,在组织修复、器官重建等再生医疗领域的应用越来越广泛。然而,动物源性生物材料用于人体的安全性风险受到极大的关注,尤其是免疫排斥反应等问题。已有研究发现,所有低等哺乳动物器官中都含有一种糖基表位抗原,称作α-Gal抗原[1],而人和类人猿、古世纪猴体内不含有该抗原[2]。但是在人肠道微生物刺激下,人体会表达高水平的抗Gal抗体(约占总免疫球蛋白的1%~3%)[3]。因此,当动物源性材料作为生物材料植入人体内时,残留的Gal抗原可能会引起严重的急性或慢性排斥反应,影响组织修复或愈合[4-6]。通常情况下,作为动物源材料需要进行免疫原清除处理。然而,为了保证处理过程中不影响材料的结构,需要权衡脱抗原力度,这就导致动物源材料中残留的Gal抗原可能导致宿主的排异反应风险。因此,对动物源材料的Gal抗原含量进行定量检测,成为该类材料质量控制和免疫原去除工艺控制及工艺验证的重要手段。
对Gal抗原含量的检测,最早使用的是免疫组化方法。该方法通过使用显色剂对植物凝集素(如西非单叶豆凝集素,GS-IB4)进行标记,从而确定细胞内抗原的数量[7-8]。然而,GS-IB4对于Gal抗原的识别需要4个表位,对于抗原表位数低的样品其检测灵敏度不够。有学者通过方法改进,开发出酶联免疫吸附抑制法(ELISA inhibition assay)[5, 8-10]。该方法使用过量的特异性抗Gal抗体(M86抗体)与待测样品反应,使用包被了Gal抗原的包被板与剩余M86抗体反应,然后加入酶标记的二抗,最后加入底物显色。然而,该方法使用兔血红细胞(细胞膜含有Gal抗原)作为标准曲线样品,而兔血红细胞中Gal抗原数目为间接的估算值,无法溯源,因此,定量并不科学。另外,兔血红细胞膜Gal抗原与抗体的反应和待检测生物材料中的Gal抗原与抗体的反应,因其两者的反应体系不同,很难科学定量。本课题组通过使用人工合成的Gal抗原与不含Gal抗原的生物材料组合后制备Gal抗原定量检测的标准曲线样品(标准品),同时使用了特异性抗Gal单克隆抗体,对Gal抗原定量检测方法进行优化,于2015年研发了标准化的Gal抗原检测方法[11-12],并制定了医疗器械行业标准《YY/T 1561—2017组织工程医疗器械产品动物源性支架材料残留α-Gal抗原检测》[13]。
然而,由于标准方法中所用的固相抗原和标准曲线样品中的Gal抗原为市售人工合成的Gal抗原(Gal-BSA,为BSA骨架接枝的Gal抗原),其不同批次的产品中,单位BSA骨架分子中所接枝Gal抗原表位数不同[14-15],需要对每个批次的包被浓度和标准曲线样品的使用浓度进行优化。另外,方法中使用的抗Gal抗体为市售未经纯化的融合细胞上清液,其成分复杂,批次间活性差异较大,同样需要对每个批次的使用浓度进行优化。其次,由于标准中所述试剂配制比较烦琐,也会引起不同实验人员之间的操作差异,导致试验的可重复性欠佳。这样,可能会导致不同实验室虽然执行的是同一个标准,对于同一样品的测定却不一定得出同样的结果。为提高行业标准的可实施性,本研究以行业标准的方法为基础,研究开发出美坛牌“α-Gal抗原定量检测试剂盒”。试剂盒包含有固相抗原包被的96孔板、抗Gal抗体、酶标二抗、显色液、终止液、裂解液、PMSF、洗液、Gal-BSA标准品、Gal抗原阳性生物材料参考品和Gal抗原阴性生物材料参考品。在试剂盒研制时,对每一批次的固相抗原包被浓度、标准品的使用浓度、抗Gal抗体和酶标二抗的使用浓度进行优化,有效地改善实验方法的可重复性,提高实验方法的灵敏性,从而增加检测结果的可信度。
1 材料与方法 1.1 材料 1.1.1 仪器设备恒温摇床(HZQ-X100,豪诚公司);酶标仪(M5,Molecular Devices);低温高速离心机(3k15,Sigma);96孔板震荡器(MX-M,Dragon Lab);分析天平(0.000 1 g,FA1104N,菁华电子公司);匀浆仪(D1000-E,Benchmark)。
1.1.2 主要试剂耗材96孔板(2592,Corning Costar);Gal α-1,3-Gal-BSA抗原(简称Gal-BSA抗原,3-Atom Spacer,NPG0203,DextraLaboratories Ltd,本批次每个BSA分子含20个Gal抗原表位);抗Gal抗体(M86,ALX-801-090-1,EnzoLifescience);HRP标记羊抗小鼠IgM(SC-2064,Santa Cruz Biotechnology);牛血清白蛋白(BSA,A7030,Sigma);四甲基联苯胺(TMB,SE1005,北京科悦达生物科技有限公司);RAPI裂解液(P0013,碧云天生物技术公司);苯甲基磺酰氟(PMSF,ST506,碧云天生物技术公司);其他常规化学试剂为分析纯试剂。
1.1.3 试验材料小鼠脏器新鲜组织由中国食品药品检定研究院实验动物资源研究所提供。生物型硬脑膜补片和其原材料由冠昊生物科技有限公司提供,该产品取材于牛心包组织,在加工制备过程中进行了抗原的清除。Gal抗原阴性生物材料参考品(阴性参考品)与Gal抗原阳性生物材料参考品(阳性参考品)由中国食品药品检定研究院提供。阴性参考品将被用于每次试验的阴性对照,其检测A值将被作为最大反应A值(因不含Gal抗原,所以不存在Gal抗体的竞争或抑制)及剩余抗体100%反应的对照;其他含Gal抗原样品的抗体结合抑制率计算时均以100%反应的对照组相比,计算抗体结合抑制率[13]。
1.2 方法 1.2.1 工艺优化方案和评价方法参照医疗器械行业标准YY/T 1561—2017[13]的方法和操作规程,对其所述方法进行优化。
1.2.1.1 抗-Gal抗体使用浓度的优化和稳定性评价使用专用抗体保护剂,对抗Gal抗体(M86)进行不同梯度稀释,通过考察系列稀释的抗Gal抗体与标准品(用阴性参考品裂解液上清,稀释Gal-BSA抗原)反应强度(A值)、检测回收率、反应相关系数(R2值)和抗体最大结合抑制率,确定最佳的抗Gal抗体使用浓度。
具体操作方法:使用质量浓度为2 mg·mL-1的阴性参考品裂解液上清,稀释Gal-BSA抗原至4 μg·mL-1,之后进行系列倍比稀释作为标准品。取一批次抗Gal抗体并记录批号,用专用的抗体保护液对其进行1/200、1/400和1/800的稀释,将不同浓度的抗Gal抗体与系列稀释的标准品反应,离心去除反应物。用2 μg·mL-1的固相抗原包被板检测剩余抗Gal抗体的量,通过ELISA方法显色并测定A值,做出标准曲线并计算R2值、最大结合抑制率和检测回收率。重复3次以确定最适浓度。
为了提高抗体稳定性,同时兼顾使用的方便,根据上述确定的最适浓度制备20倍抗体浓缩液,配专用稀释液以便使用。将制备的抗体试剂分别冻融5次和2~8 ℃贮存7 d,与-20 ℃存放品对比,进行稳定性评价。
1.2.1.2 固相抗原包被浓度优化和稳定性评价由于不同批次的Gal-BSA抗原中Gal抗原表位数不同,用1个批次的Gal-BSA,配制1、2和4 μg·mL-1 3个浓度,制备固相抗原包被板,按照行业标准YY/T 1561的操作规程测定标准品的A值。重复3次以考察最佳包被浓度。
根据优化的结果制备Gal抗原包被板并密封。将包被板置于37 ℃放置7 d进行加速稳定性实验,并与4 ℃放置的包被板对比,测定A值并计算最大结合抑制率和标准曲线的R2,考察包被板的稳定性。
1.2.1.3 酶标二抗的优化和稳定性评价酶标二抗的浓度直接影响到最终显色的A值,使用专用的二抗稀释液将羊抗鼠IgM-HRP进行1/500、1/1000和1/2 000的稀释,按照行业标准YY/T 1561的操作规程测定Gal-BSA标准品的A值,重复3次以考察最佳浓度。
根据优化的结果配制二抗试剂,并将酶标二抗试剂于37 ℃贮存7 d进行加速稳定性实验,并与4 ℃放置的酶标试剂对比,测定Gal-BSA标准品的A值并计算结合抑制率以及R2值,考察酶标二抗的稳定性。
1.2.2 试剂盒终产品的评价将各种所需试剂组装成试剂盒,进行灵敏性、均一性和稳定性评价,并确定有效期。
1.2.2.1 灵敏性评价通过检测系列稀释标准品的最低检测浓度,确定最低检测限。具体方法:制备标准品,用2 mg·mL-1阴性参考品裂解液上清进行倍比稀释至少8个浓度(2、1、0.5、0.25、0.125、0.062 5、0.031 25、0.015 625 μg·mL-1),检测A值并分析各样品的检测回收率,确定满足检测回收率的最低检测浓度为试剂盒的最低检测限。
1.2.2.2 板内和板间均一性评价通过使用不同批次固相抗原包被板以及同板不同孔与标准品反应,检测不同孔之间A值差异,从而考察板间和孔间的均一性。具体方法:随机取6块包被板,每个板随机选3个孔,按照优化的方法检测质量浓度为0.1 μg·mL-1的标准品溶液,计算A值之间的差别,考察RSD。
1.2.2.3 稳定性评价试剂盒的实时稳定性评价方案设计如下:将生产的试剂盒在规定温度下贮存0、1、2、3、6个月后进行标准品的检测,对检测的A值、最大结合抑制率、R2值以及检测回收率进行趋势分析和/或统计学分析,评价试剂盒整体的稳定性。
加速稳定性实验方案:将试剂盒的抗原包被板在37 ℃贮存7 d,检测A值、计算最大结合抑制率、R2值以及检测回收率,通过统计学分析,考察试剂盒加速稳定性。
1.2.3 试剂盒的应用 1.2.3.1 小鼠脏器组织Gal抗原含量的检测已有大量研究证明Gal抗原存在于所有低等动物体内,但不同动物及同一动物不同组织表达量不尽相同[16]。本研究利用优化的试剂盒,按照行业标准(YY/T1561-2017)中所述检测流程检测野生型小鼠不同脏器组织Gal抗原含量,考察其Gal抗原表达的差异。按照行业标准(YY/T 1561-2017)[13]中的计算方法,根据样品相当于标准品的浓度计算样品中Gal抗原表位数目。由于标准品批次差异,本批次标准品中单位BSA分子接枝的Gal抗原表位数为20个,因此样品单位质量的Gal抗原数计算公式为[11]:N=X×1.82×1014/M,式中:N—样品单位质量Gal抗原表位数(个·μg-1);X—样品Gal抗原检测值(相对于Gal-BSA标准品的质量(μg);M—样品质量(μg);1.82×1014,单位质量Gal-BSA标准品的Gal抗原表位数(个·μg-1),其由来:根据公式n=N/NA,n=m/M(n为摩尔数;N为微粒数;NA为阿伏伽德罗常数6.02×1023;m为质量;M为BSA相对分子质量,66330 Da);同时根据Gal-BSA蛋白浓度的测定结果(考马斯亮蓝法),Gal-BSA质量≈BSA含量,因此,BSA单位质量分子数:n=9.08×1018个·g-1;即,单位质量Gal-BSA中BSA分子数:9.08×1018个·g-1;根据Gal -BSA中每个BSA分子含有的Gal抗原残基数约20个(来自产品信息),因此得到单位质量Gal-BSA中Gal抗原残基数=1.82×1020个·g-1,即:1.82×1014个·μg-1。
1.2.3.2 生物型硬脑膜补片产品Gal抗原含量的检测生物型硬脑膜补片原材料取材于牛心包组织,加工制备为成品的过程中,进行了抗原清除。本研究使用试剂盒,按照行业标准(YY/T1561-2017)中所述检测流程对生物型硬脑膜补片的原材料(牛心包组织)和产品进行Gal抗原含量检测,计算Gal抗原残留量和抗原清除率。
2 结果与分析 2.1 试剂盒工艺优化结果 2.1.1 抗Gal抗体的优化和稳定性评价本批次抗Gal抗体的使用浓度(因原抗体为非纯化的融合细胞培养上清,故抗体的浓度以稀释倍数表示,即:1/800,1/400,1/200),优化结果见表 1。此处A值反映的是体系中剩余抗-Gal抗体的反应量。每次实验,A值应该比较稳定且适中。A值太高,说明抗体过剩太多,导致抗原含量低的样品抗体结合抑制率过低;A值太低,说明抗体不足,剩余抗体过少,导致抗原含量高的样品不能充分反应。一般情况下,最大反应A值在1.5左右为宜。表 1中结果显示,在2 μg·mL-1固相抗原包被条件下,随着抗Gal抗体稀释倍数增大,整体反应的A值梯度下降,其中1/400稀释的抗Gal抗体反应的A值比较适中,最大反应A值在1.566,最大结合抑制率在60%~90%之间,R2满足>0.95且回收率满足(100±20)%的检测需要。
|
|
表 1 不同浓度抗Gal抗体反应结果 Table 1 Results of anti-Gal antibody reaction in different concentration |
将上述优化实验重复2次,得到抗Gal抗体在1/400稀释下,标准品的最大反应A值分别为1.565和1.586,最大结合抑制率为73.3%和72.9%,R2分别为0.968和0.988,回收率满足检测需要。
按照1/400稀释浓度,配制抗Gal抗体20倍工作液,并进行稳定性评价,结果见表 2。
|
|
表 2 抗Gal抗体的稳定性评价结果 Table 2 The evaluation results of anti-Gal antibody stability |
抗Gal抗体推荐的保存温度为-20 ℃,分别在2~8 ℃和冻融环境中考察抗Gal抗体的稳定性。表 2中,在2 μg·mL-1固相抗原包被条件下,抗体在冻融5次和2~8 ℃贮存7 d后,检测标准品最大A值分别为1.353和1.357,与-20 ℃贮存标准品A值无明显差异,最大结合抑制率在70%左右,且R2值>0.98,回收率满足检测要求。说明抗Gal抗体在这2个试验环境下,有较好的稳定性。
2.1.2 固相抗原包被板的优化和稳定性评价在优化的抗体浓度使用条件下,本批次固相抗原包被浓度的优化结果见表 3。由表 3可见,采用4 μg·mL-1和2 μg·mL-1的Gal-BSA包被,检测标准品最大结合抑制率仅有49.21%和66.55%,相对偏低;采用1 μg·mL-1的Gal-BSA包被,检测的最大结合抑制率为71.17%,较为理想,R2和回收率满足要求。
|
|
表 3 不同抗原包被浓度的评价结果 Table 3 The evaluation results of the different concentration antigen-coated plate |
将上述优化实验重复2次,得到1 μg·mL-1的Gal-BSA包被板检测最大A值分别为1.536和1.611,最大结合抑制率为74.20%和74.11%,R2值分别为0.987和0.977,回收率满足检测要求。
按照最优的包被浓度制备包被液,加工抗原包被板,并进行稳定性评价,结果见表 4。表 4中,抗原包被板在37 ℃和2~8 ℃保存下,最大结合抑制率分别为76.91%和75.02%,标准曲线的R2分别为0.991和0.996,37 ℃放置7 d的检测结果与2~8 ℃的推荐保存条件相比无明显差异。加速稳定性实验结果显示抗原包被板的稳定性能良好。
|
|
表 4 抗原包被板稳定性评价结果 Table 4 The evaluation results of stability of antigen-coated plates |
在已优化的抗体和抗原包被浓度条件下,本次酶标二抗浓度(抗体Ⅱ,以稀释倍数表示,即:1/500,1/1 000,1/2 000)优化的结果见表 5。表 5中可见,抗体Ⅱ在浓度C(1/2 000稀释后),最大结合抑制率为72%,R2为0.9934,回收率在80%~120%之间,该浓度整体反应比其他2个浓度更为适合,满足检测要求。
|
|
表 5 不同浓度抗体Ⅱ评价结果 Table 5 The evaluation results of different concentration of antibodyⅡ |
将上述优化实验重复2次,得到最大的A值分别为1.552和1.529,最大结合抑制率分别为75.66%和73.28%,R2分别0.988和0.983,回收率满足要求。
将抗体Ⅱ按照上述浓度(稀释比例)配制成即用型试剂,在37 ℃贮存7 d与2~8 ℃贮存进行对比,考察稳定性,结果见表 6。表 6中抗体Ⅱ在37 ℃和2~8 ℃贮存条件下,整体反应最大结合抑制率分别为73.48%和73.28%,R2分别为0.995和0.996,37 ℃放置7 d的检测结果与2~8 ℃贮存标准品的检测结果均无显著性差异。
|
|
表 6 抗体Ⅱ稳定性评价 Table 6 The evaluation results of antibodyⅡstability |
根据以上优化结果,确定试剂盒生产的最终优化条件:抗原包被浓度为1 μg·mL-1,抗Gal抗体1/400稀释,酶标二抗1/2 000稀释。按照上述结果制备试剂并组装试剂盒。
2.2 试剂盒产品的评价结果 2.2.1 灵敏性评价试剂盒灵敏性评价结果见表 7。表 7可见,最大结合抑制率为74.21%,最大A值1.385,阴性对照的A值为1.385±0.069,标准品的质量浓度为0.016 μg·mL-1时其反应A值为1.352±0.042,与阴性对照组的A值相比无显著性差异,因此,此浓度下未检出Gal抗原。按照标准中的规定,本次实验的最低检测限为相当于0.031 μg·mL-1的Gal-BSA标准品,其抗原表位数为5.64×1012个。
|
|
表 7 灵敏性评价结果 Table 7 The evaluation results of sensitivity |
通过检测6块同批次抗原包被板,评价其均一性,结果见表 8。板内和板间重复性表征了抗原包被工艺和试剂配制的均一性。由表 8结果可见,板内和板间RSD均小于5%,通过统计学分析,板间数据无显著性差异。
|
|
表 8 均一性评价结果 Table 8 The evaluation results of homogeneity |
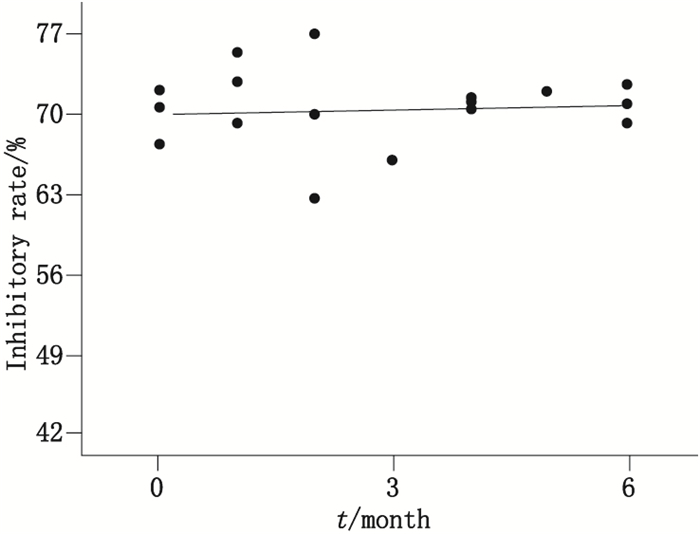
试剂盒制备后在0、1、2、3、6、8个月时对全套试剂盒产品进行实时稳定性评价,计算其结合抑制率,并做出最高浓度标准品的结合抑制率趋势图,如图 1所示。图 1可见,最大浓度(2 μg·mL-1)标准品的结合抑制率在6个月内的不同时间点的检测结果,经统计学分析变化趋势不显著(p=0.05)。
|
图 1 试剂盒实时稳定性趋势图 Figure 1 The trend of real-time stability test of the kit |
试剂盒在制备后对抗原包被板进行加速稳定性评价,其结果见表 9。表 9可见,试剂盒抗原包被板经过热加速实验后,检测的最大A值为1.703、标准品最大结合抑制为70.22%、标准曲线的R2值为0.988。经统计学分析,热加速实验(37 ℃,6 d)的检测数据与推荐的稳定保存条件(4 ℃)抗原包被板的检测数据相比无显著性差异(p=0.05)。
|
|
表 9 加速稳定性评价结果 Table 9 The evaluation results of accelerated stability |
对于试剂盒中的阴性参考品、阳性参考品以及Gal抗原标准品,据已进行的均匀性和稳定性考察结果显示,在-20 ℃保存条件下的有效期为1年以上(资料未提供)。其中,阴性参考品和阳性参考品为正在报批中的国家标准物质(相关详细数据的论文在撰稿中)。
综合上述评价结果,试剂盒内抗体、抗原包被板等整体稳定性良好。根据6个月的实时稳定性实验评价结果,暂定试剂盒的有效期为4个月。根据加速稳定性实验评价结果,预测试剂盒的有效期为1年。同时,研发小组将继续跟踪试剂盒的实时稳定性评价。
2.3 试剂盒的应用示范利用所研制的试剂盒,按照行业标准(YY/T1561-2017)中所述检测流程检测小鼠各个脏器中Gal抗原含量,其结果见表 10。由表 10的结果可见,小鼠不同脏器中Gal抗原表达量不一,其中在脾脏和肺脏中的表达量较其他3个脏器高数倍。本实验室通过RT-PCR方法检测小鼠各脏器中Gal抗原调控基因mRNA的表达,发现该调控基因在小鼠脾脏和肺脏中的表达量显著高于其他脏器(数倍,相关数据的论文在投稿中)。小鼠不同脏器中Gal抗原表达趋势与其调控基因mRNA的表达趋势完全一致,间接地佐证了该试剂盒定量检测Gal抗原的可靠性。
|
|
表 10 小鼠脏器组织Gal抗原含量 Table 10 Gal antigen content in organ tissues of mice |
使用本次研制试剂盒,按照行业标准(YY/T1561-2017)中所述检测流程检测生物型硬脑膜补片的原材料(牛心包)和产品的Gal抗原含量,其检测结果见表 11。表 11中,阴性参考品A值为1.549±0.053,“裂解液+抗体”对照孔的A值为1.448±0.010,两者A值不存在统计学差异,认为阴性参考品无Gal抗原检出。阳性参考品的Gal抗原检测结果为(1.36±0.50)×1014mg-1冻干组织,符合本实验室的基础数值。生物型硬脑膜补片原材料经过Gal抗原清除工艺处理后,单位质量Gal抗原含量由(8.34±1.17)×1014/mg-1湿组织下降至(4.16±2.56)×1012/mg-1湿组织,Gal抗原清除率为99.5%。
|
|
表 11 补片产品的Gal抗原含量 Table 11 Gal antigen content of patch product |
本研究以行业标准YY/T1561-2017为基础,对该行业标准中所述Gal抗原定量检测酶联免疫抑制方法中使用的试剂和反应条件进行了优化。以抗原抗体反应的A值、抗体最大结合抑制率、标准曲线的R2值、检测回收率为考察因素,对其中的抗Gal抗体、固相抗原包被、酶标二抗的最适浓度进行优化并进行了稳定性考察。以此为基础,开发出Gal抗原定量检测试剂盒,并对组装的试剂盒进行整体稳定性评价,结果显示,该试剂盒能够满足检测要求。
本试剂盒为国内外首个动物源性生物材料Gal抗原残留量定量检测的试剂盒。该试剂盒的优化工艺解决了Gal抗原检测行业标准中因特异性抗-Gal抗体和人工合成Gal抗原(市售品)批次间差异导致的检测结果重现性差的问题。同时,通过预先制备好固相抗原包被版和稳定化的即用型配套试剂,从而减少了不同实验室及不同实验人员的操作误差,节省了实验操作时间。
采用该试剂盒检测小鼠脏器组织的Gal抗原表达量,结果与相关研究[14]一致。同时,我们发现小鼠不同脏器组织的Gal抗原表达趋势与其调控基因mRNA的表达趋势完全一致,间接地佐证了该试剂盒定量检测Gal抗原的可靠性。通过对生物型硬脑膜补片原材料和产品Gal抗原含量的检测,显示该试剂盒有足够的灵敏度,能够实现对样品脱抗原前后Gal抗原含量的科学定量。该试剂盒为Gal抗原定量检测行业标准(YY/T1561)的实施提供技术支持。
| [1] |
HENION TR, MACHER BA, ANARAKI F, et al. Defining the minimal size of catalytically active primate α1, 3 galactosyltransferase:structure function studies on the recombinant truncated enzyme[J]. Glycobiology, 1994, 4(2): 193. DOI:10.1093/glycob/4.2.193 |
| [2] |
GALILI U, SHOHET SB, KOBRIN E, et al. Man, apes, and old World monkeys differ from other mammals in the expression of alpha-galactosyl epitopes on nucleated cells[J]. J Biochem, 1988, 263(33): 17755. |
| [3] |
GALILI U, MANDRELL RE, HAMADEH RM, et al. Interaction between human natural anti-α-galactosyl immunoglobulin G and bacteria of the human flora[J]. Infect Immun, 1988, 56(7): 1730. |
| [4] |
CHOI HJ, KIM MK, LEE HJ, et al. Effect of alpha Gal on corneal xenotransplantation in a mouse model[J]. Xenotransplantation, 2011, 18(3): 176. DOI:10.1111/xen.2011.18.issue-3 |
| [5] |
NASO F, GANDAGLIA A, IOP L, et al. First quantitative assay of alpha-Gal in soft tissues:presence and distribution of the epitope before and after cell removal from xenogeneic heart valves[J]. Acta Biomater, 2011, 7(4): 1728. DOI:10.1016/j.actbio.2010.11.030 |
| [6] |
SHADDY RE, HAWKINS JA. Immunology and failure of valvedallografts in children[J]. Ann Thorac Surg, 2002, 74(4): 1271. DOI:10.1016/S0003-4975(02)03885-7 |
| [7] |
PETER G, GOLDSTEIN IJ. The use of fluorescein-conjugated Banderiaeasimplicifolia B4-lectin as a histochemical reagent for the detection of alpha-D-galactopyranosyl groups. Their occurrence in basement membranes[J]. Exp Cell Res, 1979, 120: 321. DOI:10.1016/0014-4827(79)90392-6 |
| [8] |
GALILI U, LATEMPLE DC, RADIC MZ. A sensitive assay for measuring alpha-Gal epitope expression on cells by a monoclonal anti-Gal antibody[J]. Transplantation, 1998, 65(8): 1129. DOI:10.1097/00007890-199804270-00020 |
| [9] |
孙晓霞, 刘佳, 刘成虎, 等. 应用抑制性ELISA法测定动物源性生物材料中α-Gal抗原[J]. 药物生物技术, 2015, 22(1): 33. SUN XX, LIU J, LIU CH, et al. Determination of α-Gal Epitope in animal-derived biomaterials Using ELISA Inhibition Assay[J]. Pharm Biotechnol, 2015, 22(1): 33. |
| [10] |
冯卫, 付丽, 福兴, 等. Alpha-Gal异种移植抗原在猪骨中的分布研究[J]. 中国实验诊断学, 2009, 13(3): 343. FENG W, FU L, FU X, et al. Distribution of the alpha-Gal epitope on porcine bone tissue[J]. Chin J Lab Diagn, 2009, 13(3): 343. |
| [11] |
单永强, 徐丽明, 柯林楠, 等. 动物源性生物材料中残留α-Gal抗原检测方法[J]. 生物医学工程学杂志, 2015, 32(2): 680. SHAN YQ, XU LM, KE LN, et al. Assessment method of remnant α-13-Galactosyle epitopes in animal tissue-derived biomaterilas[J]. J Biomed Eng, 2015, 32(2): 680. |
| [12] |
陆艳, 单永强, 邵安良, 等. ELISA抑制法检测动物组织中α1, 3-Gal抗原[J]. 药物分析杂志, 2015, 35(10): 1729. LU Y, SHAN YQ, SHAO AL, et al. Assessment of α1, 3-Gal antigen in animal tissues by ELISA inhibition method[J]. Chin J Pharm Anal, 2015, 35(10): 1729. |
| [13] |
YY/T 1561—2017组织工程医疗器械产品动物源性支架材料残留α-Gal抗原检测. 医疗器械行业标准[S]. 2017 YY/T 1561-2017 Tissue engineering medical device products-remnant α-Gal antigen detection of animal tissue derived biomaterials and their derivatives. Industry Standard of Medical Device[S].2017 |
| [14] |
MACHER BA, GALILI U. The Galα1, 3Galβ1, 4GlcNAc-R(α-Gal)epitope:a carbohydrate of unique evolution and clinical relevance[J]. Biochim Biophys Acta, 2008, 1780(2): 75. DOI:10.1016/j.bbagen.2007.11.003 |
| [15] |
LAVECCHIO JA, DUNNE AD, EDGE AS. Enzymatic removal of alpha-galactosyl epitopes from porcine endothelial cells diminishes the cytotoxic effect of natural antibodies[J]. Transplantation, 1995, 60(8): 841. DOI:10.1097/00007890-199510270-00014 |
| [16] |
GALILI U. The α-Gal epitope(Galα1-3Galβ1-4GlcNAc-R)in xenotransplantation[J]. Biochimie, 2001, 83(7): 557. DOI:10.1016/S0300-9084(01)01294-9 |
 2017, Vol. 37
2017, Vol. 37 
