2. 吉林大学白求恩第一医院创伤骨科, 长春 130021
2. Department of Orthopedic Trauma, The First Noman Bethune Hospital of Jilin University, Changchun 130021, China
牛樟芝(Antrodia camphorate)是我国台湾特有的一种珍贵药用真菌。经多项研究证实牛樟芝能抑制癌细胞生长,对化学性引起的肝损伤有保护作用,并具有抗氧化,抗过敏,增强免疫力,降血压,降血脂,预防心血管疾病的功效[1]。牛樟芝的主要活性成分包括多糖体、三萜类化合物、氨基酸、固醇类、维生素、超氧化物歧化酶(SOD)、腺苷等,其中主要活性成分是β-D-葡聚糖和三萜类化合物[2]。多糖和三萜的传统测定方法耗时费力且成本较高,因此,亟需开发一种能够满足牛樟芝样品作为原料药或保健品的质量监控的快速有效的检测技术。
近红外光谱(near infrared spectroscopy,NIRS)是电磁辐射波的一种,波长范围是780~2 500 nm[3],与分子中C-H、O-H、N-H和S-H基团振动的合频以及各级振频相关[4]。NIRS技术是一种新型的绿色分析技术,具有方便、准确、快速及非侵入式分析等优点,被广泛应用于食品和药品的定性及定量分析[5-9]。
偏最小二乘法(PLS)是一种最常用的光谱多元定量校正方法,是在光谱分析中建立线性定量校正模型的通用方法[10-11]。PLS可有效地除去噪声,提取光谱信息,解决光谱共线问题[12]。蒙特卡洛偏最小二乘法(monte carlo partial least square,MCPLS)通过大量的随机计算识别模型中异常样本并优选校正集数量[13]。
本文应用偏最小二乘法结合近红外光谱建立牛樟芝菌丝体中有效成分含量的定量分析技术,快速地测定牛樟芝菌丝体中多糖和三萜的含量。
1 实验部分 1.1 实验材料齐墩果酸对照品(纯度98%,中国标准物质中心);甲醇为色谱纯,香草醛、冰醋酸、高氯酸、苯酚、盐酸、硫酸、MgSO4·7H2O、KH2PO4·3H2O、葡萄糖均为分析纯;维生素B1、酵母浸粉、蛋白胨均为生化试剂。
1.2 样品的制备牛樟芝菌株(ATCC200183,美国模式培养物集存库)。采用亚硝基胍对原始菌株进行诱变,获得牛樟芝突变菌株共165株。采用液体深层发酵技术培养菌丝体,发酵条件:接种量5%(v/v),装液量100 mL/250 mL,发酵时间7 d,发酵温度26 ℃,摇床转速150 r·min-1;发酵培养基:葡萄糖20 g·L-1,酵母浸粉10 g·L-1,蛋白胨10 g·L-1,磷酸二氢钾0.1 g·L-1,硫酸镁0.05 g·L-1,维生素B1 0.01 g·L-1。发酵结束后,离心(3 500 r·min-1,10 min)处理发酵液,菌丝体沉淀经5倍体积的去离子水清洗3次,-40 ℃冷冻干燥24 h,粉碎,过80目筛处理,最终获得菌丝体粉末,即得供试样品。
1.3 仪器和收集样品光谱数据应用日本岛津UV-3150型紫外可见近红外分光光度计和日本岛津ISR-3100积分球附件对样品NIR光谱进行扫描,扫描波长的范围为800~2 500 nm,光谱通带密度为12 nm,以硫酸钡对照品作为空白对照,光谱采样的间隔为1 nm,每个样品进行3次光谱扫描取其均值作为样品的光谱数据。牛樟芝菌丝体样品的平均近红外光谱如图 1所示。
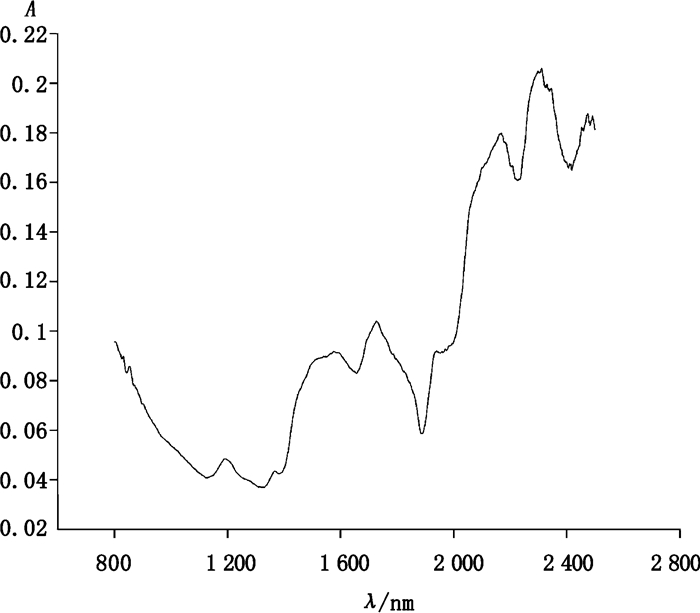
|
图 1 牛樟芝样品平均近红外光谱 Figure 1 The average NIR spectra of Antrodia camphorata |
采用蒽酮硫酸法测定胞内多糖的含量。料液比1:40,90 ℃提取4 h,3 500 r·min-1离心5 min,取上清,制得样品溶液;取样品溶液用去离子水稀释100倍,分别加入蒽酮试剂4.00 mL后一起浸于沸水浴中,煮沸10 min取出,用自来水冷却,室温放置10 min左右,于620 nm比色测定。
1.4.2 样品中三萜含量的测定[15]采用香草醛-高氯酸法测定提取液中三萜类化合物的含量。取样品溶液100 μL,置于EP管中蒸干,再加入新鲜配制的5%香草醛-冰醋酸溶液0.1 mL,高氯酸0.4 mL,60 ℃反应20 min,冰水冷却,随后加入冰醋酸5 mL,摇匀,550 nm处测定吸收度值。
1.5 建立PLS分析模型采用Matlab2010Ra(美国MathWorks)软件进行程序脚本的编写。
1.5.1 MCPLS识别异常样品按照交互验证均方根误差为评价指标来进行留一交互验证,以筛选各组分数据的初始隐变量数(hidden variables,nLV),同公式(1)所示,当代表校正集时,结果即为校正集均方根误差(root mean square errors of calibration,RMSEC),同公式(2)所示;当代表预测集时,结果显示为预测集均方根误差(root mean square errors of prediction,RMSEP),同公式(3)所示。
| $ {\rm{RMSE = }}\sqrt {\frac{{\sum {{\left( {{y_{\rm{p}}}-{y_{\rm{r}}}} \right)}^2}}}{n}} $ | (1) |
式中n为样品数量,yp为计算值或者预测值,yr为参考值或真实值。
| $ {\rm{RMSC = }}\sqrt {\frac{{\sum {{\left( {{C_{{\rm{Ni}}}}-{C_{{\rm{Ri}}}}} \right)}^2}}}{n}} $ | (2) |
| $ {\rm{RMSEP = }}\sqrt {\frac{{\sum {{\left( {{C_{\rm{N}}}-{C_{\rm{R}}}} \right)}^2}}}{n}} $ | (3) |
公式(2)、(3)两式中,n、m为用于建模的样品数,CNi和CRi分别表示用于校正和预测模型预测样品的含量和用标准分析方法测定样品的真实含量。RMSEC用来优化模型的稳定性,RMSEP用来对模型的预测性能进行优化。
预测集和校正集按照数量比1:1在总体样品中进行随机选择并建立PLS定量分析模型,重复10 000次以保证每个样品都至少充当1次预测集。记录每次计算过程中预测集样品的预测残差(predictive residual error,PRE),如公式(4)所示,计算平均值(the mean of the PRE,MPRE)和标准偏差(standard deviation of PRE,SDPRE),以筛选出偏离主体样品的异常值。
| $ {\rm{PRE = }}\left| {{y_{\rm{p}}}-{y_{\rm{r}}}} \right| $ | (4) |
式中yp为模型预测的浓度值,yr为参考方法测定的浓度值。
1.5.2 选择校正集样品数本研究随机选择总体样品数量的10%、20%、30%、40%、50%、60%、70%、80%和90%作为校正集,其余则作为预测集,建立PLS定量分析模型,计算拟合度(degree of fitting,Df),如公式(5)所示。重复计算50 000次,并计算其平均值(mean of Df,MDf),当MDf达到最高时,即选择该比例的样品数作为校正集样品数。校正集的选择可以有效防止模型出现过拟合。
| $ {{\rm{D}}_{\rm{f}}} = \frac{{\rm{c}}}{{\frac{{{\rm{RMSEC}}}}{{{n_{\rm{c}}}}} + \frac{{{\rm{RMSEP}}}}{{{n_{\rm{p}}}}} + \left| {{\rm{RMSEC-RMSEP}}} \right|}} $ | (5) |
式中,nc校正集样品数;np为预测集样品数,常数c在测定多糖和三萜中为0.1。
1.5.3 建立PLS定量分析模型采用快傅立叶变换(fast Fourier transform,FFT)、卷积平滑(savitzky-golay smoothing)、一阶导数(first derivative,1st)和二阶导数(second derivative,2nd)对原始光谱进行除噪处理,选择窗口为5、7、9、11、13和15时的除噪效果,利用可移动偏最小二乘法(moving window partial least square,MWPLS)优选PLS模型建立中的窗口大小(W)、隐变量数(nLV)和波长变量(nw),获得PLS定量分析模型。模型筛选中以逼近度(degree of approach,Da;如公式(6)所示)为评价指标,最高值则模型参数最优。其中nLV值范围为1~20,间隔为1;W值分别为17、34、51、68、85、102、119、136、153、170、187、204、221、238和255(所有波长点数1%~15%);nw范围值为5~75,间隔为5。
| $ {{\rm{D}}_{\rm{a}}} = \frac{c}{{\frac{{{n_{\rm{c}}}}}{{{n_{\rm{t}}}}} \times {\rm{RMSEC}} + \frac{{{n_{\rm{p}}}}}{{{n_{\rm{t}}}}}{\rm{RMSEP}} + \left| {{\rm{RMSEC-RMSEP}}} \right|}} $ | (6) |
式中,nt为所有样品数;nc为校正集样品数;np为预测集样品数;常数c在测定多糖和三萜中分别为1和0.025。
1.5.4 最优模型的比较筛选以Da值为评价指标,同时综合评价RMSEC和RMSEP,筛选最优的PLS模型,以确定牛樟芝菌丝体样品中多糖和三萜的最佳定量分析模型。
2 结果与讨论 2.1 异常值剔除及校正集样品数选择利用MCPLS法进行样品的筛选,将MPRE和SDPRE值均较高的样品作为异常值剔除。结果显示在建立牛樟芝菌丝体中多糖和腺苷的定量分析模型的过程中,分别剔除了16和40个异常样本。
按照“1.5.2”项所述,以MDf为评价指标,采用MCPLS法来选择建立牛樟芝菌丝体样品中多糖和三萜的NIRS定量分析模型的校正集样品数。通过计算可知,建立的牛樟芝菌丝体多糖和三萜分析模型中校正集所占比率分别为80%和70%,此时,MDf值达到最高。校正集与预测集样品中多糖和三萜含量的统计结果如表 1所示。
|
|
表 1 牛樟芝样本多糖和三萜含量统计 Table 1 The statistical data of polysaccharides and triterpene contents in Antrodia camphorata |
通过比较卷积光滑、一阶导数、二阶导数和快速傅里叶变换在各组分定量分析模型建立过程中起到的降噪作用,快速傅立叶变换和近红外原始光谱中的噪音及基线漂移的干扰最低(表 2),为模型进一步优化奠定基础。
|
|
表 2 多糖和三萜含量分析偏最小二乘法模型最佳结果 Table 2 Results of optimized quantitative PLS models for polysaccharides and triterpene |
在进一步优选建模参数W、nw和nLV的基础上,获得牛樟芝菌丝体中多糖和三萜组分的PLS-NIRS定量分析模型。当W为238和255,nw为5和45,nLV为6和5时,Da值最大,模型效果最好(表 2,图 2、3)。
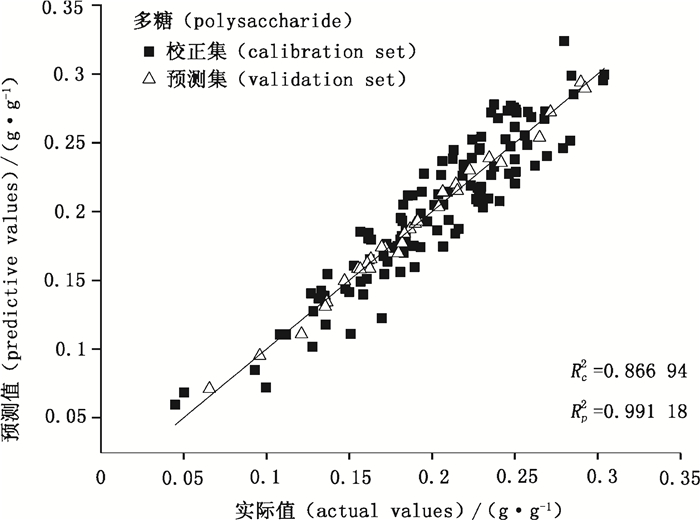
|
图 2 多糖的最佳PLS-NIRS分析模型中校正集和预测集样本实际值和预测值的相关性 Figure 2 The correlation between actual and predicting values of polysaccharides in both calibration set and validation set of optimum PLS-NIRS models |
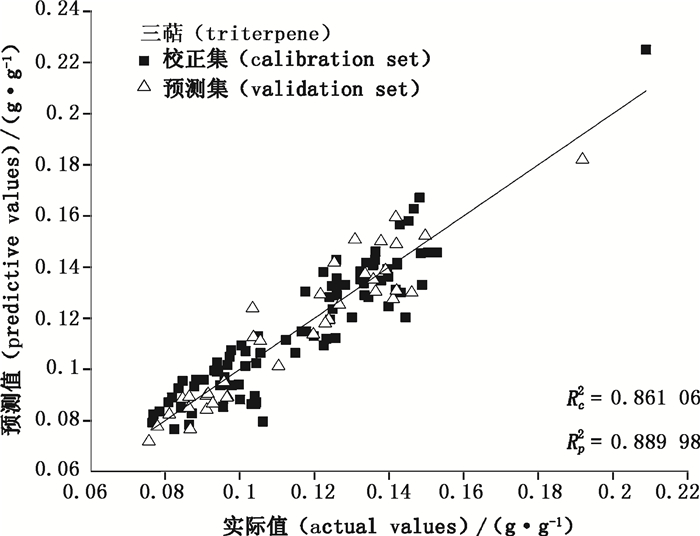
|
图 3 三萜的最佳PLS-NIRS分析模型中校正集和预测集样本实际值和预测值的相关性 Figure 3 The correlation between actual and predicting values of triterpene in both calibration set and validation set of optimum PLS-NIRS models |
在得到最优PLS的模型基础上,进行预测值与真实值之间的相关性考察。结果显示,模型预测效果较好,未出现过拟合现象,牛樟芝菌丝体中多糖和三萜含量的最优定量分析模型的校正集和预测集样品实验测定值与预测值间相关系数Rc和Rp分别为0.931 1 g·g-1和0.995 9 g·g-1、0.927 9 g·g-1和0.943 4g·g-1;RMSEC及RMSEP分别为0.031 33 g·g-1和0.010 72g·g-1、0.031 34 g·g-1和0.012 02 g·g-1,表明该模型的预测结果准确,可靠性高。
3 结论本研究以牛樟芝菌丝体中2种有效活性成分为研究对象,采用PLS结合NIRS建立牛樟芝菌丝体样品中多糖和三萜组分的定量分析模型,经过一系列优化筛选,牛樟芝菌丝体中多糖含量的最优定量模型的Rc和Rp分别为0.931 1 g·g-1和0.927 9 g·g-1;RMSEC及RMSEP值分别为0.031 33 g·g-1和0.031 34 g·g-1,牛樟芝菌丝体中多糖含量的最优定量模型的Rc和Rp分别为0.995 9 g·g-1和0.943 4 g·g-1;RMSEC及RMSEP值分别为0.010 72g·g-1和0.012 02g·g-1,优化模型的预测能力良好。
本研究证明,应用近红外光谱结合化学计量学方法建立牛樟芝菌丝体样品中多糖和三萜组分的定量分析模型,能够快速、准确和无损地对牛樟芝及其诱变菌株的菌丝体样品的有效成分进行定量分析,模型的预测精度良好,能够满足牛樟芝原料药及相关产品中多糖和三萜含量在实际检测中的分析精度。
| [1] |
战林华, 董云, 蒋丽芹. 樟芝的药用保健价值及市场研究分析[J]. 中外企业家, 2013(5): 63. ZHAN LH, DONG Y, JIANG LQ. Analysis on the value of Antrodia camphorata's medical valueand market research[J]. Chin Foreign Entrepreneurs, 2013(5): 63. |
| [2] |
徐蔚, 王瑾, 王宫. 牛樟芝胶囊的毒性实验研究[J]. 海峡药学, 2011, 23(5): 41. XU W, WANG J, WANG G. Study on toxicity of Antrodia camphorata capsules[J]. Strait Pharm J, 2011, 23(5): 41. |
| [3] |
张鸿富, 李耀翔. 近红外光谱技术在木材无损检测中应用研究综述[J]. 森林工程, 2009, 25(5): 26. ZHANG HF, LI YX. Literature review on application of near-infrared spectroscopy in wood non-destructive testing[J]. Forest Eng, 2009, 25(5): 26. |
| [4] |
王亚敏, 张卓勇, 汤彦丰, 等. 近红外光谱技术在中药鉴别及分析中的应用[J]. 首都师范大学学报(自然科学版), 2004, 25(3): 41. WANG YM, ZHANG ZY, TANG YF, et al. The application of near infrared spectroscopy to identification and analysis of herbal medicine[J]. J Cap Norm Univ(Nat Sci Ed), 2004, 25(3): 41. |
| [5] |
赵杰文, 毕夏坤, 林颢, 等. 鸡蛋新鲜度的可见-近红外透射光谱快速识别[J]. 激光与光电子学进展, 2013, 5(5): 213. ZHAO JW, BI XK, LIN H, et al. Visible-near-infrared transmission spectra for rapid analysis of the freshness of eggs[J]. Laser Optoelectron Prog, 2013, 5: 213. |
| [6] |
吴春阳, 卢启鹏, 丁海泉, 等. 利用人体组织液进行近红外无创血糖测量[J]. 光学学报, 2013, 33(11): 189. WU CY, LU QP, DING HQ, et al. Noninvasive blood glucose sensing with near-infrared spectroscopy based on interstitial fluid[J]. Acta Opt Sin, 2013, 33(11): 189. |
| [7] |
张益波, 何欢, 孟庆繁, 等. 近红外光谱结合径向基神经网络在云芝菌丝体无损分析中的应用[J]. 光学学报, 2010, 30(12): 3552. ZHANG YB, HE H, MENG QF, et al. Application of near infrared reflectance spectroscopy-radial basis function neural network for non-destructive determination of coriolus versicolor[J]. Acta Opt Sin, 2010, 30(12): 3552. |
| [8] |
刘沭华, 张学工, 孙素琴. 中药材产地的近红外光谱自动鉴别和特征谱段选择[J]. 科学通报, 2005, 50(4): 393. LIU MH, ZHANG XG, SUN SQ. Identification of the origin of Chinese medicinal materials by near infrared spectroscopy and selection of characteristic spectral bands[J]. Chin Sci Bull, 2005, 50(4): 393. |
| [9] |
周旻, 王天志, 叶利明, 等. 近红外漫反射光谱法测定川产黄柏中小檗碱含量[J]. 光谱学与光谱分析, 2007, 27(8): 1527. ZHOU M, WANG TZ, YE LM, et al. Determination of berberine in Phellodendron chinense Schneid.from Sichuan using near infrared diffuse reflectance spectroscopy[J]. Spectrosc Spect Anal, 2007, 27(8): 1527. |
| [10] |
ILDIKO E, FRANK JH, KALIVAS BR, et al. Partial least squares solutions formulticomponent analysis[J]. Anal Chem, 1983, 55(11): 1800. DOI:10.1021/ac00261a035 |
| [11] |
RICHARD GB. Chemometrics:Data Analysis for the Laboratory and Chemical Plant[M]. Chichester: John Wiley & Sons Ltd, 2003.
|
| [12] |
刘燕德, 应义斌. 傅里叶近红外光谱的雪青梨酸度偏最小二乘法定量分析[J]. 光谱学与光谱分析, 2006, 26(8): 1454. LIU YD, YING YB. The pear acidity quantified analysis using PLS methods and fourier transform near infrared spectroscopy[J]. Spectrosc Spect Anal, 2006, 26(8): 1454. |
| [13] |
郭伟良, 张卓勇, 逯家辉, 等. 近红外光谱法在蛹虫草诱变筛选及其发酵条件优化中应用[J]. 光谱学与光谱分析, 2010, 30(8): 2077. GUO WL, ZHANG ZY, LU JH, et al. Application of near infrared spectroscopy in screening Cordyceps militaris mutatioh strains and optimizing their fermentation process[J]. Spectrosc Spect Anal, 2010, 30(8): 2077. |
| [14] |
王黎明, 夏文水. 蒽酮-硫酸法测定茶多糖含量的研究[J]. 食品科学, 2005, 26(7): 185. WANG LM, XIA WS. Determination of TPS by improvement of anthrone-sulfuric acid method[J]. Food Sci, 2005, 26(7): 185. |
| [15] |
刘海霞, 赵雁武, 王峰, 等. 植物幽醇中三萜类化合物的含量测定[J]. 食品工业科技, 2008, 29(6): 280. LIU HX, ZHAO YW, WAMG F, et al. Determination of triterperniod in phytocholesterol by spectrophotometric[J]. Sci Technol Food Ind, 2008, 29(6): 280. |
 2017, Vol. 37
2017, Vol. 37 
