黄曲霉毒素是一组化学结构类似的真菌次级代谢产物,其基本结构为二呋喃环和香豆素,主要包括黄曲霉毒素B1(aflatoxin B1,AFB1)、黄曲霉毒素B2(aflatoxin B2,AFB2)、黄曲霉毒素G1(aflatoxin G1,AFG1)、黄曲霉毒素G2(aflatoxin G2,AFG2),具有严重的致癌、致突变等作用,危害巨大。其中,AFB1毒性最强也最为常见,在1993年被世界卫生组织癌症研究机构划定为Ⅰ类致癌物[1]。中药材种类繁多,种植地区广泛,药材在生产、加工、贮藏、运输的过程中,很容易发生霉变而被黄曲霉毒素污染。有学者在对中药黄曲霉毒素的污染情况进行调研时发现,中药材、饮片及中成药被黄曲霉毒素污染的情况十分严峻[2-3]。如检测不同批号的25批含豆豉、曲类等中药制剂中AFB1的含量,检测结果显示100%污染AFB1,沉香化滞丸、银翘解毒丸、柏子养心丸的AFB1质量分数均在600 ng·g-1以上[3]。
因其剧毒和强致癌性,且对于其污染预防研究的薄弱,黄曲霉毒素成为国内外政府和消费者监管与关注重点。针对农产品及食品,我国及世界各国就其污染问题采取控制措施[4-9],即设置严格的限量标准来保障农产品质量安全。而相较之下,对于中药中的污染控制甚为薄弱。中国药典2010年版首次收载了桃仁、僵蚕、酸枣仁、胖大海、陈皮等少数中药材中黄曲霉毒素限量检测,2015年版增收了14种中药材的黄曲霉毒素残留限量检测标准。中成药作为中药的主要临床使用形式,尚未有标准对其黄曲霉毒素的限量进行规定,所以对于中药安全性的监管和黄曲霉毒素污染的控制势在必行。现行的方法大多为免疫亲和柱法[3],该方法虽然灵敏度高,但具有价格昂贵的缺点,所以针对中药,尤其是中成药,建立高灵敏度但低成本的黄曲霉毒素测定方法有着迫切的需求。
磁性固相萃取技术以磁性或可磁化的材料作为吸附剂基质的一种分散固相萃取技术[10-12]。磁性纳米材料,作为磁性固相萃取的吸附剂,与常规的固相萃取(SPE)柱填料相比,具有比表面积大、扩散距离短等特点,因而只需使用少量的吸附剂和较短的平衡时间就能实现萃取分离,具有较高的萃取能力和萃取效率。同时,磁性纳米颗粒经功能化修饰可对分析物选择性萃取[13-15],且磁性吸附剂具有可重复使用的优点。因此在细胞分离、药物转运、酶的固定化、目标有机物的吸附-分离、环境科学、食品科学等诸多领域中都展示了极高的应用前景[16-17]。目前使用的功能化磁性纳米颗粒在中药中样品前处理的应用研究较少,主要集中在对生物样品中代谢产物或金属离子的富集中[18]。尚未有该技术用于中药中的黄曲霉毒素测定的报道。
本研究选取生脉饮(党参方)为研究对象,以新型的功能化磁性纳米颗粒2-氨基-5-巯基-1,3,4-噻二唑-(3-巯基丙基)三甲氧基硅烷-Fe3O4磁性纳米颗粒(AMT-TMSPT-MNPs)作为磁性固相萃取的吸附剂,通过对磁性固相萃取条件的优化,建立低成本、高灵敏度的磁性固相萃取-高效液相色谱-荧光检测的方法,用于生脉饮(党参方)中AFB1的含量测定,为中成药黄曲霉毒素的控制及限量标准的制定提供方法,为更好地保障中药安全性提供技术支持,为开发一种低成本、高选择性的黄曲霉毒素样品预处理材料提供依据。
1 材料 1.1 仪器安捷伦公司Agilent Technologies 1290 infinity超高效液相色谱仪,包括四元梯度泵(G4204A,1290 Quat Pump)、在线脱气机(G1316C,1290 TCC)、自动进样器(G4226A,Sample)、柱温箱(G1330B,1290 Thermostat)、荧光检测器(G1321B,1260FLD)、色谱数据工作站;安捷伦公司Agilent Eclipse SB-C18色谱柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶);Vicam公司Afla-P黄曲霉毒素免疫亲和柱;梅特勒-托利多公司METTLER XS205十万分之一电子天平;尼高力公司Nicolet 6700傅里叶变换显微红外光谱仪;日立公司Hitachi S-4160扫描电镜。
1.2 试药甲酸、乙腈为色谱纯;二氯甲烷、丙酮、氨水均为分析纯;水为杭州娃哈哈纯净水;六水三氯化铁(FeCl3·6H2O),国药集团化学试剂有限公司,纯度≥99.0%;四水氯化亚铁(FeCl2·4H2O),上海展云化工有限公司,纯度≥99.0%;(3-巯基丙基)三甲氧基硅烷[3-(trimethoxysilyl)-1-propanthiol,TMSPT],阿拉丁生化科技股份有限公司,纯度≥95%;2-氨基-5-巯基-1,3,4-噻二唑(2-amino-5-mercapto-1,3,4-thiadiazole,AMT),阿拉丁生化科技股份有限公司,色谱级,纯度≥98.0%;AFB1(Sigma Chemical公司),经高效液相色谱检测,纯度均在98%以上;生脉饮(党参方)购买自浙江A、浙江B、北京C、四川D、江西E 5家生产厂家,批号分别为A131203、B1304004、B1110001、B1109004、B1107003、B1103006、C140301、D130702、E20140108。
2 方法与结果 2.1 磁性纳米颗粒的制备、修饰及表征 2.1.1 磁性纳米颗粒的制备称取六水三氯化铁11.68 g和四水氯化亚铁4.30 g,置于三口烧瓶中,加入去离子水200 mL,充入氮气后密封,在氮气保护的条件下85 ℃水浴加热搅拌30 min,缓慢注入25%~28%氨水23 mL,溶液颜色由黄色变为黑色,加入氨水结束后,继续加热反应30 min,得到磁性沉淀物,用纯水洗涤2次,每次约200 mL,再用约200 mL 0.02 mol·L-1氯化钠溶液洗涤1次,得到的颗粒沉淀于真空干燥箱中(45 ℃)干燥36 h,即得到四氧化三铁磁性纳米颗粒(MNPs)。称取MNPs适量,加入纯水,配成质量浓度为40 g·L-1的混悬液,备用。
2.1.2 磁性纳米颗粒的修饰取MNPs混悬液20 mL倒入圆底烧瓶中,放置磁铁于圆底烧瓶下部,以外加磁场将其快速分层,倾出上清液,悬浮液先用10% TMSPT的水溶液80 mL包合,搅拌均匀,再用甘油60 mL包覆,在氮气保护下于90 ℃水浴中加热并剧烈搅拌2 h,冷却至室温,悬浮液依次用纯水洗涤3次,甲醇洗涤3次,纯水洗涤5次,得到的颗粒沉淀于真空干燥箱中(45 ℃)干燥2 h,即得到TMSPT修饰的磁性纳米颗粒(TMSPT-MNPs);称取TMSPT-MNPs适量,加入纯水配成质量浓度为40 g·L-1的TMSPT-MNPs混悬液,备用。取上述TMSPT-MNPs混悬液25 mL用乙醇洗涤2次,每次约200 mL,均匀加入1% AMT水溶液150 mL,超声处理(频率40 kHz,功率100 W)2 h,得到颗粒沉淀依次用纯水洗涤3次,每次约200 mL,甲醇洗涤2次,每次约200 mL,45 ℃真空干燥2 h,即得到AMT-TMSPT-MNPs(MMNPs),供磁性固相萃取使用。
2.1.3 功能化磁性纳米颗粒的表征 2.1.3.1 红外光谱测定将上述制备的MMNPs进行红外光谱测定,得到红外光谱图如图 1。从图中可以看出制备的MMNPs在577.4 cm-1处有吸收,而Fe3O4的特征吸收峰在577~535 cm-1,说明用共沉淀法合成的铁氧体是Fe3O4;吸收范围在3 441~3 220 cm-1是-OH的伸缩振动,说明图中3 390.3 cm-1处的吸收峰,是由于氢键连接在铁氧化物表面和水分子化学吸附在磁性颗粒表面的羟基;图中1 036.3 cm-1处的吸收峰对应吸收范围在1 107~1 036 cm-1的-Si-O-键伸缩振动的特征吸收峰;2 922.5 cm-1处的吸收峰是-C-H键的伸缩振动峰;从880~586 cm-1对应的是金属-氧键的透光波段,对应图中880.6 cm-1处的吸收峰;对磁性纳米颗粒表面修饰AMT,出现了与-NH2相关的2个新的振动带1 402 cm-1和1 619 cm-1,特征吸收峰在1 402 cm-1是因于-C-N的伸缩振动,吸收峰在1 619 cm-1则是杂环的特征吸收峰。这些吸收峰的出现表明,TMSPT和AMT在Fe3O4磁性纳米颗粒表面修饰成功。
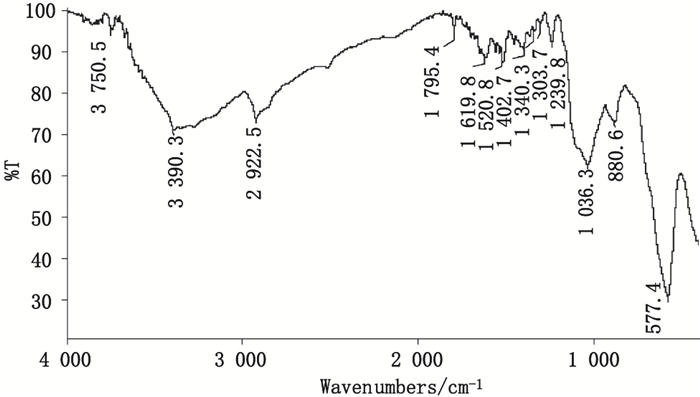
|
图 1 AMT-TMSPT-MNPs红外光谱图 Figure 1 FI-IR spectrum of AMT-TMSPT-MNPs |
将所制备的MMNPS颗粒取样进行扫描电镜测定,得到扫描电镜图如图 2,由图可得,颗粒近似球形,并集聚在比表面积大、磁性强的大颗粒上,平均粒径为20 nm,表明制备的AMT-TMSPT-MNPs颗粒符合实验要求。

|
图 2 AMT-TMSPT-MNPs扫描电镜图 Figure 2 SEM image of AMT-TMSPT-MNPs |
色谱柱:Agilent Eclipse SB-C18(4.6 mm×250 mm,5 μm);流动相:乙腈-甲醇-0.1%甲酸水(20:20:60);流速:1.0 mL·min-1;柱温:25 ℃;检测器:荧光检测器;检测波长:激发波长360 nm,发射波长440 nm。
2.3 供试品溶液的制备精密移取生脉饮(党参方)样品10 mL,均匀加入MMNPs 150 mg,搅拌10 min,用磁铁施以外加磁场将MMNPs与上清液分离,倾出上清液,残留的MMNPs加入CH2Cl2-Me2CO(2:1)9 mL,搅拌8 min,用磁铁施以外加磁场将MMNPs与上清液分离,倾出上清液,挥干,残渣用甲醇300 L复溶,过滤,即得供试品溶液,进样20 μL,代表性色谱图如图 3。
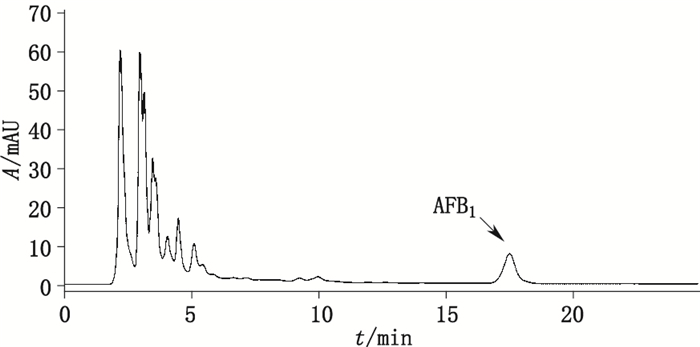
|
图 3 生脉饮(党参方)样品色谱图 Figure 3 HPLC chromatogram of Shengmai decoction(Dangshen prescription) |
取黄曲霉毒素B1对照品1 mg,精密称定,用甲醇溶解,配制成浓度为10 ng·mL-1对照品溶液,进样20 μL,色谱图如图 4。
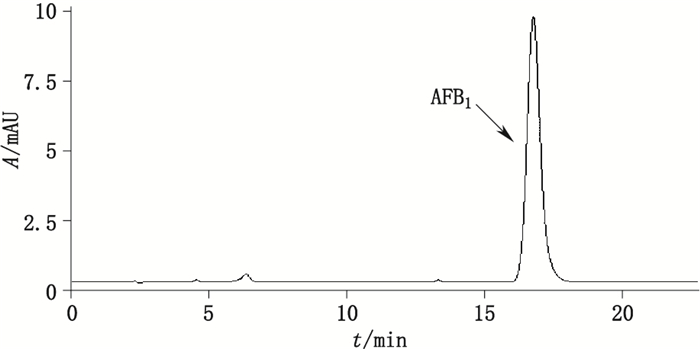
|
图 4 AFB1对照品色谱图 Figure 4 HPLC chromatogram of aflatoxin B1 reference substance |
分别精密吸取对照品溶液1、2、5、10、20 μL注入液相色谱仪,测得峰面积。以进样量X(ng)为横坐标,峰面积Y(mAU)为纵坐标,绘制标准曲线,回归方程:
| $ Y = 245.73X + 136.07\;\;r = 0.999\;5 $ |
表明在0.3~10 ng范围内,线性关系良好。
2.5.2 检测限和定量限将对照品溶液稀释后,精密吸取20 μL按上述色谱条件进样分析,色谱峰信噪比为10:1时对应浓度为定量限(LOQ),色谱峰信噪比为3:1时对应浓度为检测限(LOD),结果LOD为0.07 ng·mL-1,LOQ为0.21 ng·mL-1。
2.5.2 精密度试验日内精密度:在上述色谱条件下,精密吸取对照品溶液20 μL连续进样6次,记录色谱图,测得AFB1峰面积的RSD为1.2%。日间精密度:在上述色谱条件下,取对照品溶液连续3 d,每天进样3次,进样量20 μL,记录色谱图,测得AFB1峰面积的RSD为1.2%。以上结果表明仪器精密度良好。
2.5.3 稳定性试验精密移取生脉饮(党参方)样品(批号B1304004)10 mL,按“2.3”项下方法制备供试品溶液,分别于0、2、4、8、16、24 h进样20 μL进行测定,记录色谱图,测得AFB1峰面积的RSD为1.1%。表明供试品溶液在24 h内稳定性良好。
2.5.4 重复性试验精密移取同一批生脉饮(党参方)样品(批号B1304004)6份,分别按“2.3”项下方法制备供试品溶液,进样20 μL,记录色谱图,测得平均含量为1.93 ng·mL-1,RSD为1.2%,表明方法的重复性良好。
2.5.5 回收率试验精密移取同一批生脉饮(党参方)样品(批号B1304004)5 mL共6份,分别加入AFB1(浓度10 ng·mL-1)对照品溶液0.1 mL,以纯水定容至10 mL,按“2.3”项下方法制备供试溶液,进样测定,计算回收率,平均加样回收率为97.7%,RSD为2.1%,表明该方法准确性良好。
2.6 样品含量测定对来源于5个企业的生脉饮(党参方)样品(共9批)进行检测,检测的色谱图如图 5。同时,将以本文方法制得的供试品溶液按“2.2”项下条件测得5个企业的样品(A131203、1304004、C140301、D130702、E20140108)的结果与以传统的免疫亲和柱法[1]制得的供试品溶液按“2.2”项下条件测得的结果进行对比,结果见表 1。免疫亲和柱法供试品溶液的制备方法:精密取生脉饮(党参方)10 mL,将溶液匀速通过已活化的免疫亲和柱,随后用纯水20 mL淋洗,再用甲醇1 mL洗脱;进样、淋洗及洗脱时流速2 mL·min-1,洗脱液过滤,即得。
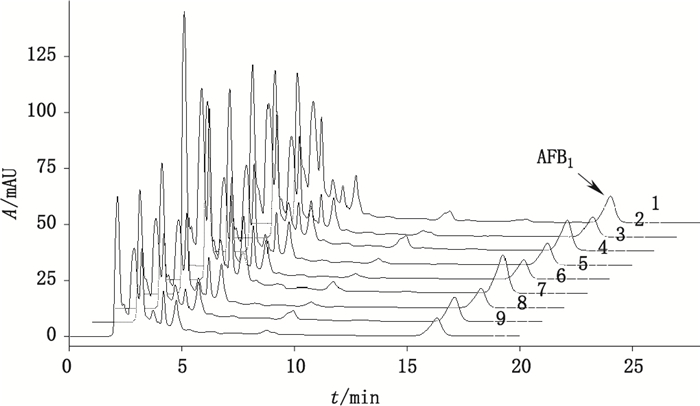
|
1.批号(lot No.)A131203 2.批号(lot No.)B1304004 3.批号(lot No.)B1110001 4.批号(lot No.)B1109004 5.批号(lot No.)B1107003 6.批号(lot No.)B1103006 7.批号(lot No.)C140301 8.批号(lot No.)D1307029.批号(lot No.)E20140108(9). 图 5 9批生脉饮(党参方)色谱图 Figure 5 HPLC chromatograms of nine batches of Shengmai decoction(Dangshen prescription) |
|
|
表 1 磁性固相萃取法和免疫亲和柱法对生脉饮(党参方)中AFB1含量测定结果(ng·mL-1) Table 1 Comparison of determination results obtained from the magnetic solid phase extraction and official IAC-HPLC-FL methods |
取生脉饮(党参方)样品(批号B 1304004)各10 mL,将其pH分别调成2.0、3.0、3.5、4.0、5.0,向上述溶液中均匀加入MMNPs 100 mg,解吸附搅拌时间10 min,用外加磁铁将MMNPs与上清液分离,倾出上清液,MMNPs用CH2Cl2-Me2CO(2:1)9 mL洗脱,解吸附搅拌时间10 min,收集洗脱液,挥干,残渣用甲醇300 μL复溶,过滤,即得供试溶液。通过高效液相色谱检测,对不同pH条件下所测峰面积进行比较(见图 6-a),结果表明pH 3.5条件下样品中AFB1的吸附效果较优。
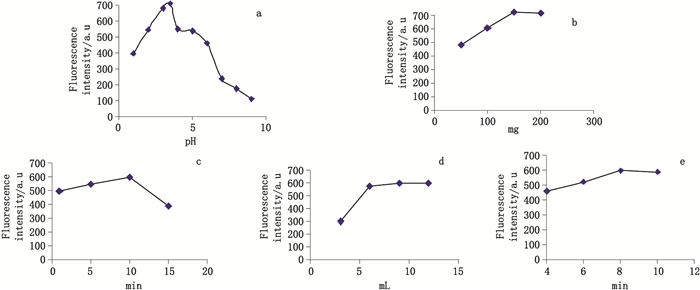
|
图 6 样品pH(a)、磁性纳米颗粒加入量(b)、富集时间(c)、洗脱液体积(d)、解吸附时间(e)对AFB1回收率的影响 Figure 6 Effect of pH of sample solution(a), adsorbent amount(b), adsorbent time(c), desorption volume(d)and desorption time(e)on the recovery of AFB1 |
取样品(批号B1304004)各10 mL,调节pH 3.5,向样品中分别加入MMNPs 100、120、150、170、200 mg,搅拌10 min,用外加磁铁将MMNPs与上清液分离,倾出上清液,MMNPs用CH2Cl2-Me2CO(2:1)9 mL洗脱,解吸附搅拌时间10 min,收集洗脱液,挥干,残渣用甲醇300 μL复溶,过滤,即得供试溶液。通过高效液相色谱检测,对不同磁性纳米颗粒用量条件下所测峰面积进行比较(见图 6-b),结果表明当样品用量10 mL,磁性纳米颗粒用量150 mg时,已可使黄曲霉毒素B1吸附完全。
3.1.3 磁性纳米颗粒吸附时间取样品(批号B 1304004)各10 mL,调节pH 3.5,加入MMNPs 150 mg,分别搅拌5、8、10、12、15 min,用外加磁铁将MMNPs与上清液分离,倾出上清液,MMNPs用CH2Cl2-Me2CO(2:1)9 mL洗脱,解吸附搅拌时间10 min,收集洗脱液,挥干,残渣用甲醇300 μL复溶,过滤,即得供试溶液。通过高效液相色谱检测,对不同吸附时间峰面积进行比较(见图 6-c),结果表明吸附时间10 min较优。
3.1.4 洗脱液体积取样品(批号B 1304004)各10 mL,调节pH 3.5,分别加入MMNPs 150 mg,搅拌10 min,用外加磁铁将MMNPs与上清液分离,倾出上清液,MMNPs分别用CH2Cl2-Me2CO(2:1)3、6、9、12 mL洗脱,解吸附搅拌时间10 min,收集洗脱液,挥干,残渣用甲醇300 μL复溶,过滤,即得供试溶液。通过高效液相色谱检测,对不同洗脱液体积峰面积进行比较(见图 6-d),结果表明洗脱液体积9 mL较优。
3.1.5 解吸附时间取样品(批号B 1304004)各10 mL,调节pH 3.5,分别加入MMNPs 150 mg,搅拌10 min,用外加磁铁将MMNPs与上清液分离,倾出上清液,MMNPs用CH2Cl2-Me2CO(2:1)9 mL洗脱,分别解吸附搅拌2、4、6、8、10 min,收集洗脱液,挥干,残渣用甲醇300 μL复溶,过滤,即得供试溶液。通过高效液相色谱检测,对不同解吸附时间峰面积进行比较(见图 6-e),结果表明解吸附搅拌时间为8 min较优。
综上,供试品溶液制备方法:取生脉饮(党参方)10 mL,加入MMNPs 150 mg,搅拌10 min,用外加磁铁将MMNPs与上清液分离,倾出上清液,MMNPs用CH2Cl2-Me2CO(2:1)9 mL洗脱,搅拌8 min,收集洗脱液,挥干,残渣用甲醇300 μL复溶,过滤,即得。
3.2 含量测定结果分析由含量测定结果分析,来源于5个生产企业的生脉饮(党参方)样品中,4个生产企业的样品能检测到AFB1,来源于B企业的5批次生脉饮(党参方)样品中均能检测AFB1,9批样品中所测得的AFB1含量在1.04~1.93 ng·mL-1之间。从结果可看出,虽含量各有差异,但从一定程度上反映生脉饮(党参方)样品受黄曲霉毒素污染的普遍性。与以免疫亲和柱制备供试品溶液测得的结果相比,结果基本一致(见表 1),表明该方法测定结果准确可靠;同时,从表 2的对比可看出,2种方法灵敏度相似,而本研究方法的成本大大降低(仅为免疫亲和柱制备法的4%)。
|
|
表 2 磁性固相萃取法和免疫亲和柱法测定生脉饮(党参方)中AFB1含量的成本及方法灵敏度对比 Table 2 Comparison of cost and sensitivity of the magnetic solid phase extraction and official IAC-HPLC-FL methods |
本研究通过探索优化磁性固相萃取条件,建立了磁性固相萃取-高效液相色谱-荧光法测定生脉饮(党参方)中AFB1的含量测定,创新地将功能化的磁性纳米颗粒应用于中成药复杂体系的黄曲霉毒素测定中,为开发一种低成本、高灵敏度的中成药黄曲霉毒素含量测定方法奠定了基础,也为中药安全性的监管和黄曲霉毒素污染的控制提供了技术支撑。
| [1] |
陈思颖, 朱迪, 王永林, 等. 免疫亲和柱净化UPLC-MS-MS测定天麻药材中黄曲霉毒素的含量[J]. 中国实验方剂学杂志, 2014, 20(1): 51. CHEN SY, ZHU D, WANG YL, et al. UPLC-MS-MS analysis of aflatoxins in Gastrodia elata by immunoaffinity column cleanup[J]. Chin J Exp Tradit Med Form, 2014, 20(1): 51. |
| [2] |
张振凌. 关于建立中药饮片黄曲霉毒素限度标准的探讨[J]. 中医药学刊, 2006, 24(11): 2025. ZHANG ZL. The investigation of the establishment of aflatoxin limit standard on traditional Chinese medicine decoction pieces[J]. Chin Arch Tradit Chin Med, 2006, 24(11): 2025. DOI:10.3969/j.issn.1673-7717.2006.11.026 |
| [3] |
蔡飞, 高微微, 李红玲, 等. 中药上黄曲霉毒素的污染现状与防除技术[J]. 中国中药杂志, 2010, 35(19): 2503. CAI F, GAO WW, LI HL, et al. Aflatoxin contamination of Chinese herbal medicine in China and its potential management strategies[J]. China J Chin Mater Med, 2010, 35(19): 2503. |
| [4] |
范风华, 左银菊, 刘应祎, 等. 花生油中黄曲霉素检测的新方法[J]. 中外食品工业, 2014(3): 47. FAN FH, ZUO YJ, LIU YY, et al. The new detection method of aflatoxin in peanut oil[J]. Sino-foreign Food Ind, 2014(3): 47. |
| [5] |
黄天培, 何佩茹, 潘洁茹, 等. 食品常见真菌毒素的危害及其防止措施[J]. 生物安全学报, 2011, 20(2): 108. HUANG TP, HE PR, FAN JR, et al. Health hazard to humans and prevention strategies of food-borne mycotoxins[J]. J Biol Saf, 2011, 20(2): 108. |
| [6] |
郑飞, 林巧, 巩发永, 等. 苦荞中黄曲霉毒素的控制及去除方法[J]. 南方农业, 2015, 9(30): 171. ZHENG F, LIN Q, GONG FY, et al. The method of control and remove the aflatoxin in Fagopyrum tataricum[J]. South Chin Agric, 2015, 9(30): 171. |
| [7] |
帕提古丽·托乎提. 奶牛养殖业中黄曲霉素污染和预防控制[J]. 中国牛业科学, 2014, 40(2): 42. PATIGULI·THT. The prevention and control of aflatoxin contamination in the dairy cattle farming industry[J]. Chin Cattle Sci, 2014, 40(2): 42. |
| [8] |
叶露, 韦艳霞, 刘畅. 上海地区大米样品黄曲霉素B1含量检测[J]. 上海交通大学学报, 2011, 31(10): 1492. YE L, WEI YX, LIU C. Detection of amount of aflatoxin B1 in rice samples in Shanghai[J]. J Shanghai Jiaotong Univ, 2011, 31(10): 1492. DOI:10.3969/j.issn.1674-8115.2011.10.030 |
| [9] |
马永生. 粮油食品中黄曲霉素检测方法及比较[J]. 科学之友, 2012(11): 18. MA YS. The detection methods and comparison of aflatoxin in grain and oil foodstuffs[J]. Friend Sci Amateurs, 2012(11): 18. |
| [10] |
ASGHARINEZHAD AA, MOLLAZADEH N, EBRAHIMZADEH H, et al. Magnetic nanoparticles based dispersivemicro-solid-phase extraction as a novel technique for coextraction of acidic and basic drugs from biological fluids and waste water[J]. J Chromatogr A, 2014, 1338: 1. DOI:10.1016/j.chroma.2014.02.027 |
| [11] |
TANG D, SAUCEDA JC, LIN Z, et al. Magnetic nanogold microspheres-based lateral-flow immunodipstick for rapid detection of aflatoxin B2 in food[J]. Biosens Bioelectron, 2009, 25(2): 514. DOI:10.1016/j.bios.2009.07.030 |
| [12] |
TAN L, HE R, CHEN KC, et al. Ultra-high performance liquid chromatography combined with mass spectrometry for determination of aflatoxins using dummy molecularly imprinted polymers deposited on silica-coated magnetic nanoparticles[J]. Microchim Acta, 2016, 183(4): 1469. DOI:10.1007/s00604-016-1790-y |
| [13] |
ZAHOOR M, KHAN FA. Adsorption of aflatoxin B1 on magnetic carbon nanocomposites prepared from bagasse[J]. Arab J Chem, 2014, 20(1): 1. |
| [14] |
AMOLI-DIVA M, TAHERIMASLAK Z, ALLAHYARI M, et al. Application of dispersive liquid-liquid microextraction coupled with vortex-assisted hydrophobic magnetic nanoparticles based solid-phase extraction for determination of aflatoxin M1 in milk samples by sensitive micelle enhanced spectrofluorimetry[J]. Talanta, 2015, 134: 98. DOI:10.1016/j.talanta.2014.11.007 |
| [15] |
MANAFI MH, ALLAHYARI M, POURGHAZI K, et al. Surfactant-enhanced spectrofluorimetric determination of total aflatoxins from wheat samples after magnetic solid-phase extraction using modified Fe3O4 nanoparticles[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2015, 146: 43. DOI:10.1016/j.saa.2015.03.050 |
| [16] |
ZHAI YH, DUAN S, HE Q, et al. Solid phase extraction and preconcentration of trace mercury(Ⅱ)from aqueous solution using magnetic nanoparticles doped with 1, 5-diphenylcarbazide[J]. Microchim Acta, 2010, 169(3-4): 353. DOI:10.1007/s00604-010-0363-8 |
| [17] |
CHENG GH, HE M, PENG HY, et al. Dithizone modified magnetic nanoparticles for fast and selective solid phase extraction of trace elements in environmental and biological samples prior to their determination by ICP-OES[J]. Talanta, 2012, 88: 507. DOI:10.1016/j.talanta.2011.11.025 |
| [18] |
GIAKISIKLI G, ANTHEMIDIS AN. Magnetic materials as sorbents for metal/metalloid preconcentration and/or separation.A review[J]. Anal Chim Acta, 2013, 789-1. |
| [19] |
HASHEMI M, TAHERIMASLAK Z, RASHIDI S. Application of magnetic solid phase extraction for separation and determination of aflatoxins B1 and B2 in cereal products by high performance liquid chromatography-fluorescence detection[J]. J Chromatogr B, 2014, 960: 200. DOI:10.1016/j.jchromb.2014.03.035 |
 2017, Vol. 37
2017, Vol. 37 
