顺铂为首个具有抗癌作用的重金属络合物,是铂类第1代抗肿瘤药物,目前为国家基本药物。1969年被发现其抗癌活性[1],1974年我国开始进行顺铂的研发[2],1983年在国内上市,临床上主要用于治疗膀胱癌、卵巢癌、睾丸癌等癌症[3]。其作用机制主要为顺铂进入细胞后,解离为顺铂水合物阳离子,以共价键的形式与细胞核中染色体的DNA相结合,生成的加合物能抑制DNA的复制,达到抗癌的目的[4]。动力学研究表明,顺铂的反式异构体—反铂在体内6 h后在DNA上的累积下降,无法有效地阻碍DNA的复制,无药效活性[5]。顺铂仅能通过静脉、动脉或腔内给药,因此制剂均为注射剂,包括注射用顺铂和顺铂注射液,其中注射用顺铂包含无菌原料分装型和冻干型2种。由于顺铂为细胞周期非特异性药物,因此不良反应发生率较高[6]。
本文在对顺铂注射剂有关物质进行研究分析的基础上,对顺铂注射剂不同剂型的合理性进行了分析,探讨了现行标准存在的问题,为提高现行标准和产品质量提供参考。
1 仪器与试药 1.1 仪器LC-20A高效液相色谱仪(岛津公司),1100系列高效液相色谱仪(安捷伦公司),2695/2998高效液相色谱系统(沃特世公司),Merck Superspher RP-select B C8色谱柱(4 mm×250 mm,4 μm;填料:辛烷基硅烷键合硅胶;默克公司),XA205电子天平(梅特勒-托利多公司)、TU-1901紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 对照品顺铂(批号100401-201302)购自于中国食品药品检定研究院,三氯氨铂(批号K0M465)和反铂(批号J0I217)均购自美国药典委员会,四氯铂酸钾(批号5-YFD-1221)购自欧洲药典委员会。
1.3 试剂硫酸、庚烷磺酸钠、辛烷磺酸钠、四丁基硫酸氢铵、氯化钠、磷酸二氢钾、氢氧化钠、醋酸铵均为分析纯,甲醇、N,N-二甲基甲酰胺为色谱纯。
1.4 样品均为国家抽样性评价样品。包括30批次无菌分装型注射用顺铂(规格:10 mg和20 mg)均来自齐鲁制药有限公司(企业A),89批次冻干型注射用顺铂(规格:10 mg和20 mg)分别来自企业A、齐鲁制药(海南)有限公司(企业B)、德州德药制药有限公司(企业C)和山东罗欣药业股份有限公司(企业D)以及30批次顺铂注射液(规格:6 mL:30 mg和20 mL:20 mg)分别来自江苏豪森药业股份有限公司(企业E)和南京制药厂有限公司(企业F)。
2 实验方法 2.1 法定检验方法按中国药典2015年版(ChP 2015)、国家药品标准、国家药品(试行)标准[7-10]进行法定检验。
2.2 探索性研究方法 2.2.1 色谱条件参照欧洲药典8.0版(EP 8.0)[11]和2016年版英国药典(BP 2016)[12]而拟定的顺铂原料有关物质检查方法(以下简称拟定方法)进行研究:采用Merck Superspher RP-select B C8色谱柱(4 mm×250 mm,4 μm);柱温30 ℃;流动相为含辛烷磺酸钠1.08 g·L-1、四丁基硫酸氰铵1.70 g·L-1、磷酸二氢钾2.72 g·L-1的水溶液,并用1 mol·L-1氢氧化钠溶液调pH至5.9;流速为1.0 mL·min-1;检测波长为210 nm;样品以0.9%氯化钠溶液溶解,并稀释至质量浓度为1 mg·mL-1,即得供试品溶液;进样量20 μL。
2.2.2 方法学验证方法取批号为412017CE的样品约20 mg,置20 mL量瓶中,用0.9%氯化钠溶液溶解并稀释至刻度,摇匀;精密量各1 mL,分别置10 mL量瓶中,进行如下处理:(1)酸破坏:加1 mol·L-1盐酸溶液1 mL,放置2 h,用1 mol·L-1氢氧化钠溶液1 mL中和,用0.9%氯化钠溶液溶解并稀释至刻度,摇匀即得酸破坏溶液;(2)碱破坏:加1 mol·L-1氢氧化钠溶液1 mL,放置2 h,用1 mol·L-1盐酸溶液1 mL中和,用0.9%氯化钠溶液溶解并稀释至刻度,摇匀,即得碱破坏溶液;(3)光照破坏:在4 000 lx照度下放置24 h,用0.9%氯化钠溶液溶解并稀释至刻度,摇匀,即得光照破坏溶液;(4)热破坏:80 ℃水浴加热3 h,用0.9%氯化钠溶液溶解并稀释至刻度,摇匀,即得加热破坏溶液;(5)氧化破坏:加1%过氧化氢溶液1 mL,放置2 h,用0.9%氯化钠溶液溶解并稀释至刻度,摇匀,即得氧化破坏溶液。将上述5种破坏的溶液按“2.2.1”项下色谱条件进行专属性分析。
精密称取顺铂对照品10.72 mg,置100 mL量瓶中,加0.9%氯化钠溶液溶解并稀释至刻度,摇匀,即得顺铂对照品储备液。精密量取顺铂对照品储备液适量,用0.9%氯化钠溶液稀释制成顺铂质量浓度分别为0.534 9、1.070、2.140、5.349、10.70、21.40 μg·mL-1的系列顺铂对照品溶液,按“2.1.1”项下色谱条件进行有关物质线性范围分析。
称取三氯氨铂对照品和顺铂对照品各约10 mg,加0.9%氯化钠溶液溶解并稀释制成含量均为0.01 mg·mL-1的混合溶液,重复配制3份,按“2.2.1”项下色谱条件进行杂质校正因子分析。
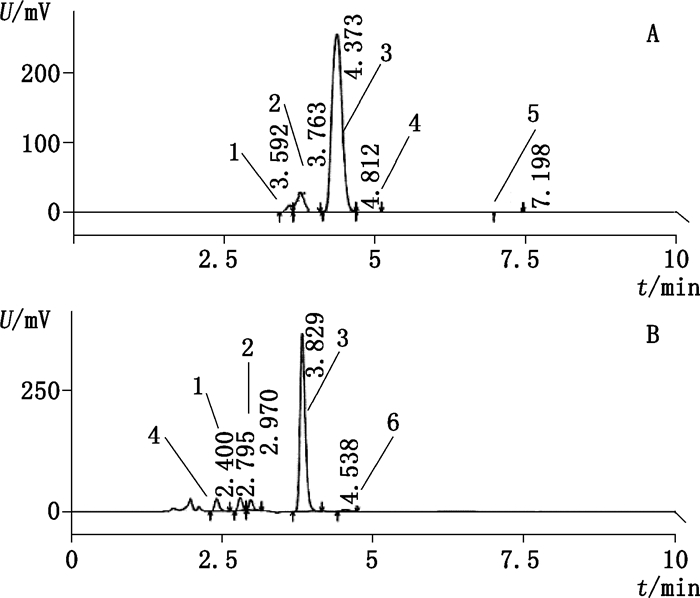
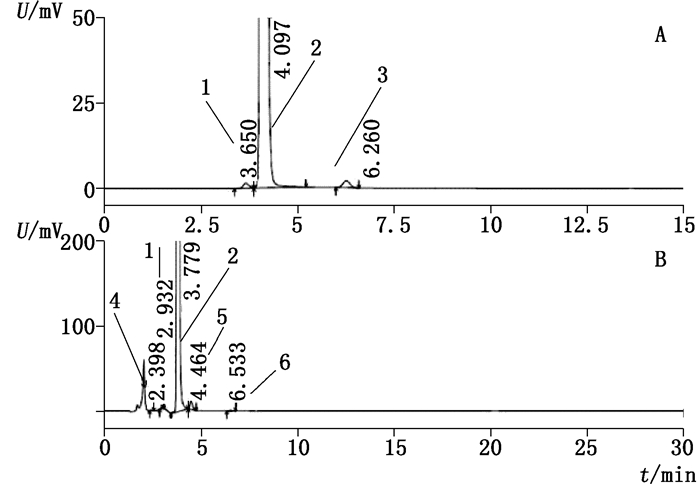
3 结果与讨论 3.1 测定方法比较各国药典顺铂有关物质方法均不一致。美国药典(USP)38版[13]采用2个不同方法分别检测三氯氨铂和反铂,日本药典(JP)ⅩⅥ[14]仅进行反铂的检测,上述两国药典方法均不对其他杂质进行检测,方法通用性差;而ChP 2015版方法[7]对各国药典收载的顺铂已知杂质(结构及收录药典情况见表 1)分离,与拟定方法相比,效果较差(见图 1)。按照拟定的方法,进行有关物质检测,较ChP 2015方法检出了更多杂质(见图 2)。
|
|
表 1 各国药典收载的顺铂及已知杂质 Table 1 Cisplatin and identified impurities contained in various national pharmacopoeia |
|
1.四氯铂酸(tetrachloroplatinic acid)2.三氯氨铂(trichloroammineplatinate)3.顺铂(cisplatin)4.反铂(transplatin)5.未知成分(unknown substances)6.顺铂一水合物(cisplatin monohydrate) A. ChP 2015方法(method of ChP 2015)B.拟定方法(the proposed method) 图 1 分离度试验色谱图 Figure 1 Chromatogram of separation test |
|
1.三氯氨铂(trichloroammineplatinate)2.顺铂(cisplatin)3.未知成分(unknown substances)4.反铂(transplatin)5.顺铂一水合物(cisplatin monohydrate)6.其他杂质(other impurity) A. ChP 2015方法(method of ChP 2015)B.拟定方法(the proposed method) 图 2 样品典型有关物质色谱图(210 nm) Figure 2 Chromatograms of samples(at 210 nm) |
此外,顺铂注射液现行的国家标准有关物质方法检测能力不足,无法检出已知杂质三氯氨铂,方法不能真实反映有关物质情况。现行注射液标准限度设定不完善,并未对已知杂质三氯氨铂及反铂单独设定限度,而杂质总量不得过6.0%限度也明显高于原料及粉针制剂。采用ChP 2015[7]中顺铂原料有关物质方法分析顺铂注射液,均检出明显三氯氨铂峰,但注射液中辅料与三氯氨铂峰未能实现基线分离,无法对杂质进行定量分析。采用拟定的方法分离效果较好,分析顺铂注射液可有效避免辅料干扰。
综上所述,拟定分析方法较现行药典方法(ChP 2015法)分离度更高,检出杂质更多,既可用于原料药的有关物质测定,还可用于顺铂注射剂的有关物质测定。
3.2 方法学验证对拟定方法进行了专属性、精密度、检出限和定量限、线性范围等方法学验证,其中专属性及线性范围的具体实验方法见“2.2.2”项。
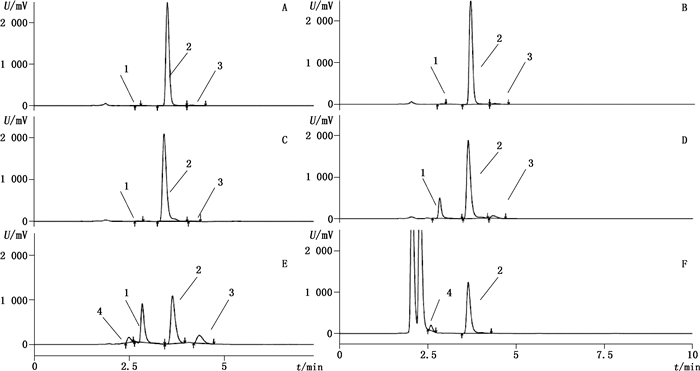
3.2.1 专属性试验各企业原料和制剂分别在酸、碱、光照、氧化、加热等条件破坏下得到的各种杂质均能实现基线分离,代表图谱见图 3。结果表明,在高温和光照条件下三氯氨铂含量明显增加,而反铂在光照和氧化条件下会增加。各杂质峰均能与主成分峰充分分离,表明方法专属性良好。
|
1.三氯氨铂(trichloroammineplatinate)2.顺铂(cisplatin)3.顺铂一水合物(cisplatin monohydrate)4.反铂(transplatin) A.未破坏(undestroyed)B.酸破坏(destroyed by acid)C.碱破坏(destroyed by alkali)D.高温破坏(destroyed by heat)E.光照破坏(destroyed by light)F.氧化破坏(destroyed by oxidation) 图 3 供试品溶液原液及5种方式破坏溶液的色谱图 Figure 3 Chromatograms of original samples solution and sample solution destroyed by five ways |
将线性范围试验下系列顺铂对照品溶液进行测定,由于拟定方法中可检出顺铂一水合物,根据EP 8.0要求,将该成分归入主成分合并峰面积进行定量。以质量浓度X(mg·mL-1)为横坐标,以顺铂与顺铂一水合物峰面积之和Y为纵坐标,进行线性回归,回归方程:
| $ Y = 2.000 \times {10^7}X-7\;422\;\;r = 0.999\;5 $ |
结果表明,顺铂质量浓度在0.5~20 μg·mL-1的范围内,线性关系良好。
3.2.3 杂质校正因子分析由于反铂与顺铂为光学异构体,紫外响应一致,因此未进行反铂的校正因子测定。经测定三氯氨铂校正因子为1.06,与1接近,可按1.0计算。
3.2.4 检测线和定量限测定取“线性范围分析”项下对照品溶液逐级稀释,按“2.2.1”项下色谱条件进行测定,检出限(S/N=3)为1 ng,定量限(S/N=10)为5 ng。
3.2.5 精密度试验取“线性范围分析”项下质量浓度约为5 µg·mL-1的溶液,连续6次进样测定,顺铂与顺铂一水合物峰面积之和的RSD为0.04%。
3.3 杂质谱分析采用拟定方法对杂质谱进行分析,顺铂主要检出的杂质为三氯氨铂和反铂。其中,顺铂原料中三氯氨铂含量约为0.1%~0.2%,反铂含量均小于0.1%。对原料和制剂进行条件强制破坏,结果发现光照破坏可产生三氯氨铂及反铂,高温破坏可产生三氯氨铂杂质。反铂是主成分同分异构体,也可由合成工艺产生。
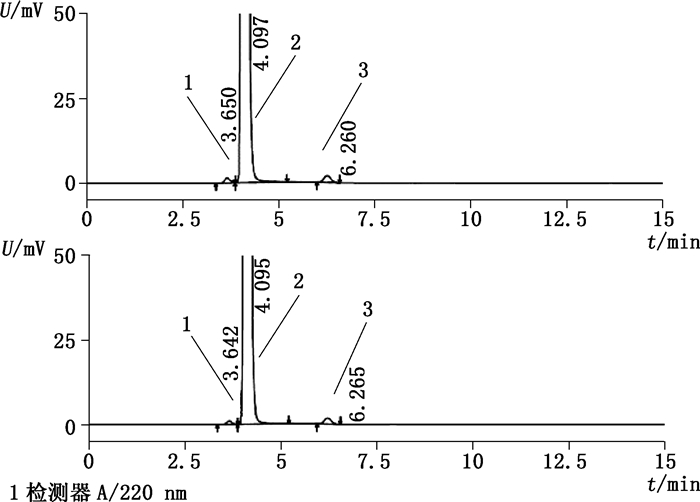
采用ChP 2015方法[7]对样品进行分析时,发现有关物质存在含量约为0.3%的未知成分,超过BP[12]与EP[11]中对单个未知杂质不得过0.1%的限度。改变流动相条件或采用拟定方法则无法检出该杂质。按现行标准检验顺铂对照品及供试品有关物质,均能检出该未知成分,见图 4。其保留时间与各国药典收载已知杂质对照品保留时间均不一致,同时与原料合成起始反应物六氯铂酸钾和中间体顺二碘二氨铂也均不一致,可排除已知杂质、原料起始反应物和中间体。放置后,该未知成分随样品放置时间增加而明显上升,含量约可达到2.0%。
|
1.三氯氨铂(trichloroammineplatinate)2.顺铂(cisplatin)3.未知成分(unknown substances) A.顺铂对照品(reference substance)B.供试品(sample) 图 4 按标准检验有关物质典型图谱 Figure 4 Chromatograms of related substances determined by the current statutory standards |
由于ChP 2015方法[7]中流动相质谱不耐受,而改变流动相成分则无法检出该杂质,因此该未知杂质无法采用质谱进行定性。通过紫外光谱对比,该杂质紫外光谱与主成分和反铂基本一致,与三氯氨铂不同,如图 5所示。
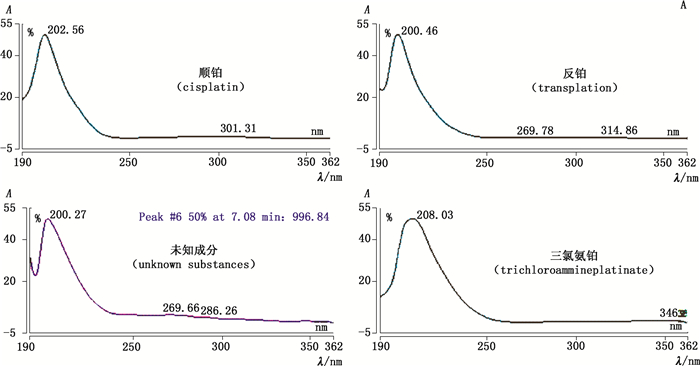
|
图 5 顺铂及3个杂质的紫外光谱图 Figure 5 UV spectra of cisplatin and three major impurities. |
通过增大进样量至100 μL对未知成分进行了收集,并采用本文拟定方法进行分析,结果得到顺铂、三氯氨铂及顺铂一水合物的色谱峰。故认为未知成分与顺铂存在相互转化关系,初步推断未知成分为顺铂水合物[11, 15]。顺铂在水溶液中不稳定,会经过二级反应变为顺铂一水合物[16]及顺铂二水合物[17],机理如图 6所示[18]。从结构分析,顺铂二水合物较为稳定,故我们合成了顺铂二水合物。
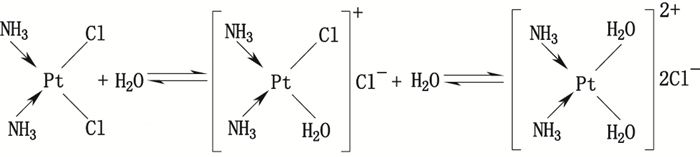
|
图 6 顺铂水合物二级反应示意图 Figure 6 Secondary reaction diagram of cisplatin monohydrate |
将顺铂二水合物配制成水溶液,并放置一段时间后,采用ChP 2015方法分析得到顺铂二水合物以及未知成分2个色谱峰,而拟定方法得到顺铂二水合物和顺铂一水合物2个色谱峰,见图 7,因此推断未知成分为顺铂一水合物。
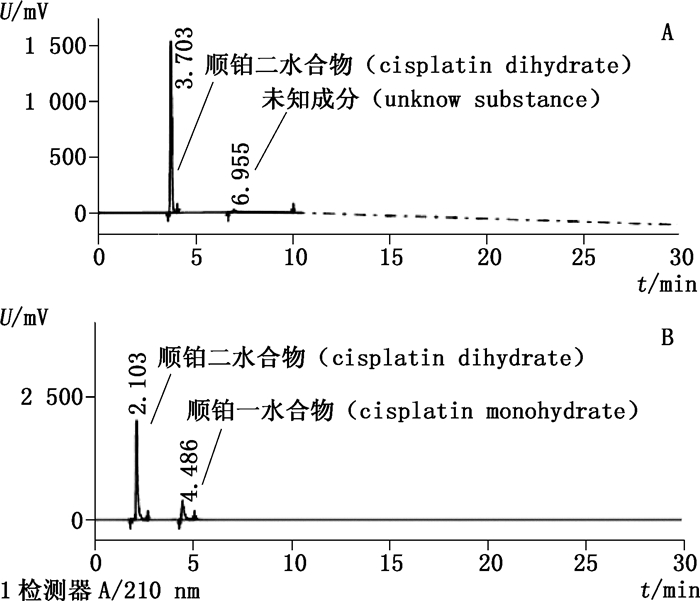
|
A. ChP 2015方法(method of ChP2015)B.拟定方法(the proposed method) 图 7 顺铂二水合物水溶液图谱 Figure 7 Chromatograms of cisplatin dihydrate aqueous solution |
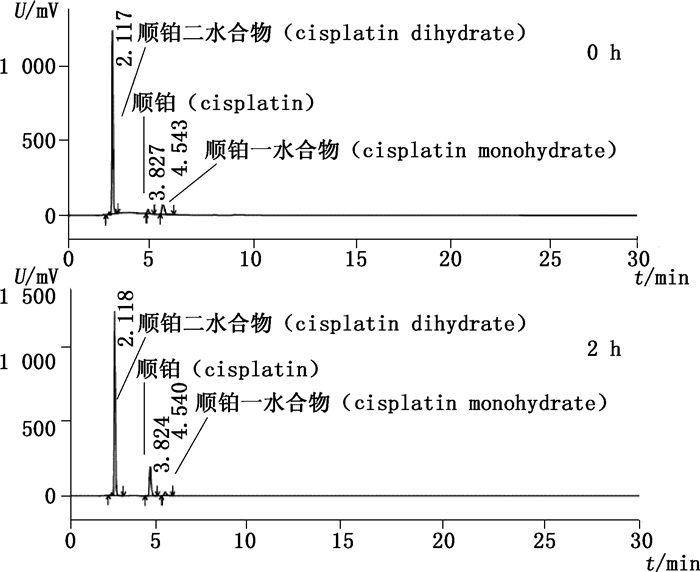
以0.9%氯化钠为溶剂溶解顺铂二水合物,分别采用ChP 2015方法和拟定方法进行分析,结果见图 8和图 9。可以看出,配制溶液后立即进样,ChP 2015方法检出顺铂二水合物、顺铂以及未知成分,放置2 h后,未知成分峰变小而顺铂峰变大。而采用拟定方法,配制后立即进样,检出顺铂二水合物、顺铂以及顺铂一水合物,放置2 h后,顺铂一水合物峰变小而顺铂峰变大。顺铂一水合物与未知成分在水和0.9%氯化钠溶液中变化趋势一致。因此,未知成分可被确认为顺铂一水合物。
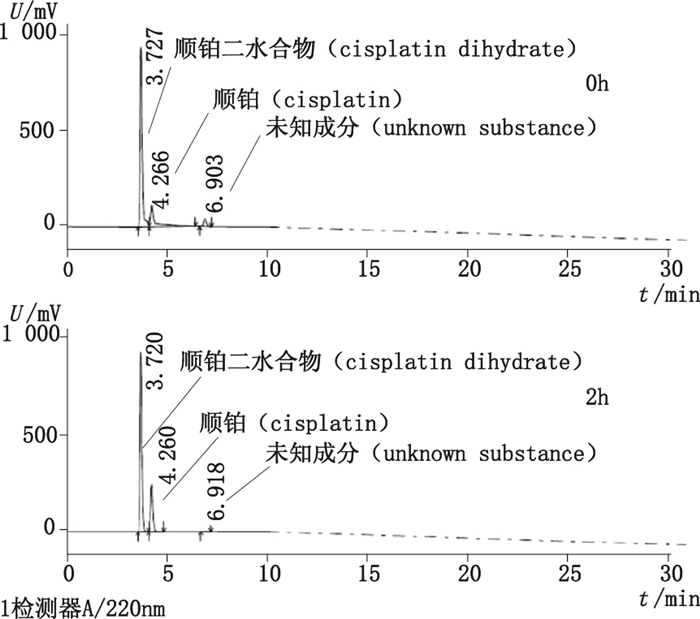
|
图 8 顺铂二水合物氯化钠溶液ChP 2015方法分析色谱图 Figure 8 Chromatograms of cisplatin dihydrate solution in NaCl solution determined by method of ChP 2015 |
|
图 9 顺铂二水合物氯化钠溶液拟定方法分析色谱图(210 nm) Figure 9 Chromatograms of cisplatin dihydrate solution in NaCl solution determined by the proposed method at 210 nm |
由于顺铂的药物作用机理为其进入细胞后,解离为顺铂水合物阳离子,以共价键的形式与细胞核中染色体的DNA相结合[4]。因此,顺铂一水合物是体内活性成分,不应按杂质计算,应将该成分归入主成分合并计算含量。
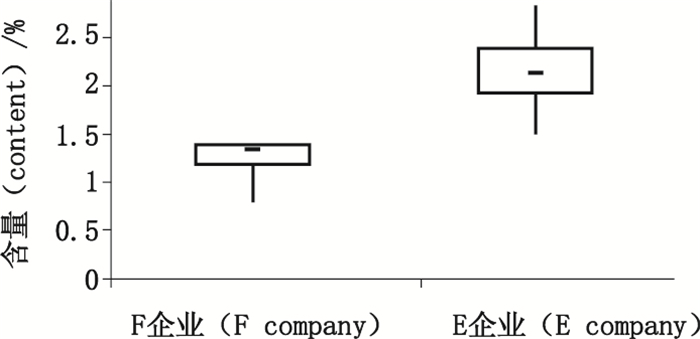
3.4 样品测定采用拟定方法对各企业的粉针和注射液进行分析,主要杂质均为三氯氨铂和反铂。三氯氨铂在注射用顺铂中含量均为0.1%~0.6%,在F企业的棕色玻璃瓶包装的顺铂注射液中含量为0.8%~1.4%,而在E企业的无色玻璃瓶包装的顺铂注射液中含量为1.5%~2.8%,见图 10;反铂在注射用顺铂及F企业的顺铂注射液中含量均低于0.15%,而在E企业的顺铂注射液中含量为0.3%~0.5%,可见,不同的企业产品质量存在差异,且顺铂注射液杂质显著高于粉针。注射用顺铂除D企业的1批次外产品外,其余均符合EP8.0版[11]顺铂原料限度要求(三氯氨铂不得过1.0%,反铂不得过2.0%,其他单个杂质不得过0.1%,其他杂质总量不得过0.5%);而顺铂注射液则全部不符合该限度要求,因此,通过上述杂质谱分析,应优选粉针剂型。
|
图 10 两家企业顺铂注射液三氯氨铂含量比较图 Figure 10 Comparison of the content of trichloroammineplatinate in cisplatin injections from two companies |
对不同药典有关物质方法进行了比较,并参照EP 8.0[11]拟定了顺铂有关物质检查方法。该方法分离度高,能检出现行标准中未能检测出的杂质,能同时用于原料药和顺铂注射剂有关物质检查及含量测定,优于现行标准方法。对顺铂注射剂样品杂质谱进行了分析,主要杂质为三氯氨铂和反铂。其中三氯氨铂为光照和高温降解杂质,反铂光照降解和工艺合成均可产生。对现行ChP 2015方法中检出的未知成分进行确认,为顺铂一水合物。顺铂一水合物是体内活性成分,不应按杂质计算,应将该成分归入主成分合并计算含量。顺铂注射液有关物质量均显著高于注射用粉针,应优选粉针剂型。建议企业重视原料合成工艺,优选避光包装材料并低温保存,从而进一步提高产品质量。
| [1] |
ROSENBERG B, VANCAMP L, TROSKO JE, et al. Platinum compounds:a new class of potent antitumour agents[J]. Nature, 1969, 222(5191): 385. DOI:10.1038/222385a0 |
| [2] |
高广猷. 抗癌新药—顺铂简介[J]. 新药与临床, 1983, 2(1): 23. GAO GY. New anti-cancer drug—cisplatin[J]. New Drugs Clin Rem, 1983, 2(1): 23. |
| [3] |
汪明明, 崔速南. 抗癌新药顺铂的研究进展[J]. 癌症, 1986, 5(1): 105. WANG MM, CUI SN. Research progress of cisplatin the anti-cancer new drug[J]. Cancer, 1986, 5(1): 105. |
| [4] |
EVANS DJ, GREEN M, VANELDIK R, et al. The kinetics and mechanism of the reaction of 2'-deoxy-5'-guanosinemonophosphoric acid and the diaqua form of cisplatin[J]. Inorg Chim Acta, 1987, 128(1): 27. DOI:10.1016/S0020-1693(00)84690-3 |
| [5] |
张宝发, 吴林友, 于保强, 等. 抗癌药物铂系络合物及其衍生物的研究[J]. 辽宁大学学报(自然科学版), 1986, 23(2): 46. ZHANG BF, WU LY, YU BQ, et al. Study on platinum complexes and their derivatives of anticancer drugs[J]. J Liaoning Univ (Nat Sci Ed), 1986, 23(2): 46. |
| [6] |
王强, 徐辉碧, 詹志兰. 顺铂的抗癌活性及毒性[J]. 微量元素与健康研究, 1997, 14(4): 59. WANG Q, XU HB, ZHAN ZL. Antitumor activity and toxicity of cisplatin[J]. Stud Trace Elem Health, 1997, 14(4): 59. |
| [7] |
中国药典2015年版. 二部[S]. 2015: 832 ChP 2015.Vol Ⅱ[S].2015: 832 |
| [8] |
YBH02632007国家药品标准[S]. 2007 YBH02632007 National Drug Standard [S].2007 |
| [9] |
YBH08082004国家药品标准[S]. 2004 YBH08082004 National Drug Standard[S].2004 |
| [10] |
WS-119(X-099)-2002国家药品标准[S]. 2002 WS-119(X-099)-2002 National Drug Standard[S].2002 |
| [11] |
EP 8.0.Vol Ⅱ[S].2014: 1897
|
| [12] |
BP 2016.Vol Ⅰ[S].2016: 569
|
| [13] |
USP 39-NF 34.Vol Ⅱ[S].2016: 3177
|
| [14] |
JP ⅩⅥ [S].2011: 644
|
| [15] |
刘祝东, 刘洋, 杨一昆, 等. 顺铂注射液的高效液相色谱分析[J]. 贵金属, 2001, 22(2): 32. LIU ZD, LIU Y, YANG YK, et al. Analysis of cisplatin injection by high performance liquid chromatography[J]. Prec Metal, 2001, 22(2): 32. |
| [16] |
KROUTIL O, PREDOTA M, CHVAL Z. Pt···H nonclassical interaction in water-dissolved Pt(Ⅱ) complexes: coaction of electronic effects with solvent-assisted stabilization[J]. Inorg Chem, 2016, 55(7): 3252. DOI:10.1021/acs.inorgchem.5b02261 |
| [17] |
DEUBEL DV. The chemistry of dinuclear analogues of the anticancer drug cisplatin.A DFT/CDM study[J]. Am Chem Soc, 2006, 128(5): 1654. DOI:10.1021/ja055741k |
| [18] |
MELCHIOR A, TOLAZZI M, MARTINEZ JM, et al. Hydration of two cisplatin aqua-derivatives studied by quantum mechanics and molecular dynamics simulations[J]. J Chem Theory Comput, 2015, 11(4): 1735. DOI:10.1021/ct500975a |
 2017, Vol. 37
2017, Vol. 37