2. 药物化学与分子诊断教育部重点实验室, 河北大学, 保定 071002
2. Key Laboratory of Medicinal Chemistry and Molecular Diagnosis, Ministry of Education, Hebei University, Baoding 071002, China
复方南板蓝根颗粒[1]由南板蓝根、蒲公英和紫花地丁组成,辅料主要为蔗糖和食用香精,常用于腮腺炎、咽炎、乳腺炎和疮疖肿痛的治疗。目前复方南板蓝根颗粒的质量标准中仅有针对酚类和萜类化合物的显色反应,以及针对南板蓝根药材[2]的薄层色谱鉴别项目,亟需完善。另外,有关文献对复方南板蓝根颗粒中的靛蓝和靛玉红[3],以及秦皮乙素[4-5]、咖啡酸[6]进行了含量测定。根据复方南板蓝根颗粒的制备工艺[1],水提后直接进行浓缩,没有醇沉过程。推测该制剂中含有一定的多糖类成分。研究表明,中药多糖具有多种功效[7-9],而该制剂中的南板蓝根多糖[10]、蒲公英多糖[11]、紫花地丁多糖[12]都具有抑菌等作用,与复方南板蓝根颗粒的功效吻合,但目前尚未见测定该制剂中多糖类成分的报道。本文采用硫酸-苯酚法[13]测定了复方南板蓝根颗粒中多糖的含量,并采用毛细管区带电泳法(CZE)[14],结合正交试验设计,对多糖的单糖组成进行分析,为复方南板蓝根颗粒药效物质的研究及其质量标准的完善提供参考。
1 仪器与试药CL1020型高效毛细管电泳仪及HW-2000色谱工作站(北京彩陆科学仪器有限公司);未涂层弹性石英毛细管柱(52 cm×50 μm,有效长度43 cm,河北永年锐沣色谱器件有限公司);PHS-3C型酸度计(上海理达仪器厂);BT25S型电子分析天平(d=0.01 mg,赛多利斯科学仪器有限公司);TG16-W型台式高速离心机(湖南湘仪实验室仪器开发有限公司);L500型低速自动平衡离心机(长沙湘仪离心机仪器有限公司);QL-901型旋涡混合器(江苏海门市麒麟医用仪器厂);XMTB型恒温水浴锅(余姚金电仪表有限公司);HH-601型超级恒温水浴锅(山东鄄城华鲁电热仪器有限公司);202型电热恒温干燥箱(上海锦屏仪器仪表有限公司);722型可见分光光度计(上海菁华科技仪器有限公司)。
复方南板蓝根颗粒(市售,广州白云山奇星药业有限公司,批号分别为14326、15137、15209);D-半乳糖(Gal,纯度≥99.0%)、D-甘露糖(Man,纯度≥99.5%)、D-阿拉伯糖(Ara,纯度≥99.0%)均购自北京索莱宝科技有限公司;D-葡萄糖醛酸(GluA,纯度≥99.0%)、D-半乳糖醛酸(GalA,纯度≥99.0%)为美国Sigma公司产品;L-鼠李糖(Rha,纯度≥99.0%)购自合肥博美生物科技有限责任公司;D-木糖(Xyl,纯度≥99.0%)由保定市化工二厂提供;D-葡萄糖(Glu,分析纯)由天津市福晨化学试剂厂提供;无水葡萄糖(Glu anhydrous,分析纯)购自天津市科密欧化学试剂有限公司;1-苯基-3-甲基-5-吡唑啉酮(PMP)(批号20130512)为日照力德士化工有限公司产品。四硼酸钠(批号xk13-001-02080046Ⅱ,分析纯)为河北省保定化学试剂厂产品;硫脲(批号20060407,分析纯)为天津市福晨化学试剂厂产品;氢氧化钠(批号20141021,分析纯)为天津市风船化学科技有限公司产品;硫酸(批号201303,分析纯)为北京化工厂产品;乙醇(批号20160401,医用级)为石家庄新宇三阳实业有限公司产品;水为纯化水,由DZG-303A型纯水机制备;其他试剂为分析纯。
2 方法与结果 2.1 电泳条件色谱柱:未涂层弹性石英毛细管柱(52 cm×50 μm,有效长度43 cm);运行缓冲液:40 mmol·L-1硼砂缓冲液(以4 mol·L-1氢氧化钠溶液调节pH至10.1);检测波长:245 nm;运行电压:12 kV;进样方式:虹吸进样;进样量:8 cm×10 s;柱温:室温。
2.2 溶液的配制衍生试剂:精密称取PMP 0.87 g,置10 mL量瓶中,甲醇溶解并定容,摇匀,制得0.5 mol·L-1的PMP甲醇溶液。
内标溶液:精密称取硫脲0.25 g,置50 mL量瓶中,水溶解并定容,摇匀,制得5 mg·mL-1的硫脲溶液。
单糖混合对照品溶液:精密称取木糖、阿拉伯糖、葡萄糖、鼠李糖、甘露糖、半乳糖、葡萄糖醛酸和半乳糖醛酸的对照品各0.05 g,置50 mL量瓶中,水溶解并定容,摇匀,制得1 mg·mL-1的8个单糖对照品的混合溶液。
无水葡萄糖标准溶液:精密称取无水葡萄糖0.005 g,置10 mL量瓶中,水溶解并定容,摇匀,制得0.5 mg·mL-1的无水葡萄糖标准溶液。
硼砂缓冲液:精密称取四硼酸钠0.76 g,置50 mL量瓶中,水溶解并定容,摇匀,制得40 mmol·L-1的硼砂缓冲液,以4 mol·L-1氢氧化钠溶液调节pH至10.1。
2.3 多糖的提取称取复方南板蓝根颗粒0.5 g,加9 mL水使全部溶解,然后加入48 mL 95%乙醇调节乙醇浓度至80%,静置过夜,4 000 r·min-1离心5 min,弃去上清液,得粗多糖沉淀。将沉淀每次用2 mL 80%乙醇洗涤3次,在40 ℃下干燥,即得干燥的粗多糖。
2.4 多糖的全降解、衍生、测定将上述提取所得粗多糖,加入0.75 mol·L-1硫酸溶液2 mL,密封,100 ℃恒温水浴5 h,放冷,加入4 mol·L-1氢氧化钠溶液调节溶液pH至中性,然后转移至5 mL量瓶中,加入5 mg·mL-1硫脲溶液800 μL,水定容,摇匀,即得多糖全降解液。
量取上述多糖全降解液200 μL,依次加入0.3 mol·L-1氢氧化钠溶液100 μL和衍生试剂100 μL,涡旋混匀,70 ℃恒温水浴30 min,取出后放冷,加入0.3 mol·L-1盐酸溶液100 μL中和,再加入氯仿1 mL,涡旋混匀,12 000 r·min-1离心3 min,取上清液得供试品溶液。
将上述供试品溶液在“2.1”的电泳条件下进行CZE分析。
2.5 多糖的提取、全降解优化 2.5.1 多糖提取的单因素分析本文考察了不同料液比对蔗糖去除情况及多糖含量的影响,考察的料液比(g:mL)为1:6、1:9、1:12、1:15、1:18、1:21、1:24。采用毛细管区带电泳法进行测定,以除葡萄糖之外的其他7个单糖的峰面积之和与内标峰面积之比为指标,并参考葡萄糖的峰面积与内标峰面积之比进行分析。实验结果如图 1所示,在考察的料液比范围内,从1:6至1:18葡萄糖的峰面积之比显著降低,其他7个单糖的峰面积和之比基本不变;当料液比达1:18后,葡萄糖的峰面积之比基本不变,但其他7个单糖的峰面积和之比减小幅度增大。并且单糖峰的数目均为8,不受不同料液比的影响,故选取料液比1:18进行提取。
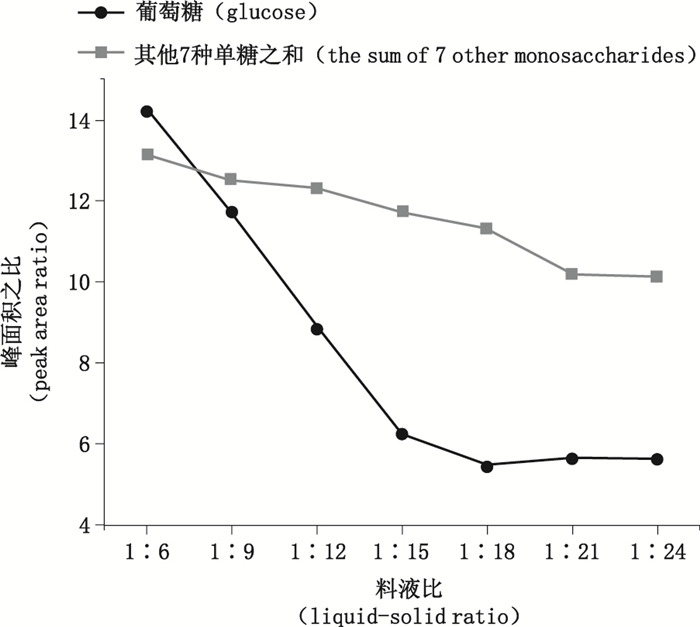
|
图 1 料液比对单糖组成的影响 Figure 1 The influence of liquid-solid ratio on the monosaccharide composition |
通过对水浴温度(A)、硫酸浓度(B)、水浴时间(C)进行初步考察,确定它们的适当水平范围,利用正交试验设计,采用毛细管区带电泳法测定全降解产物,以8个单糖峰面积之和与内标峰面积之比为指标对各因素和水平进行评价和优化。设计的正交试验因素水平见表 1,正交试验结果见表 2,正交试验结果的方差分析见表 3。3个因素对复方南板蓝根颗粒多糖全降解的影响顺序为水浴温度(A)>水浴时间(C)>硫酸浓度(B)。并得出最优降解条件的组合为A3B1C3,即温度100 ℃,硫酸浓度0.75 mol·L-1,时间5 h。方差分析结果显示,在所选水平条件下,温度、时间对复方南板蓝根颗粒多糖的全降解结果影响显著,硫酸浓度对其多糖全降解结果的影响不显著。
|
|
表 1 正交试验因素水平表 Table 1 The factors and levels of orthogonal table |
|
|
表 2 L9(34)正交试验结果 Table 2 Results of L9(34)orthogonal experiment |
|
|
表 3 正交试验方差分析结果 Table 3 Results of orthogonal test variance analysis |
精密量取1 mg·mL-1单糖混合对照品溶液0.04、0.2、0.6、1.0、1.4 mL,分置5 mL量瓶中,精密加入内标溶液400 μL,以水定容,摇匀后,各取加有内标的单糖混合对照品溶液200 μL,分别加入0.3 mol·L-1氢氧化钠溶液100 μL,衍生试剂100 μL,涡旋混匀,70 ℃恒温水浴30 min进行衍生,衍生后测定。以单糖对照品的质量浓度为X,单糖峰面积与内标峰面积之比为Y进行线性回归,得线性回归方程。当信噪比为3时单糖对应的浓度为检测限,当信噪比为10时单糖对应的浓度为定量限,结果见表 4。由于复方南板蓝根颗粒多糖降解后得到的葡萄糖醛酸能检测到,但未达到定量限,故以下方法学验证不再对其进行考察。
|
|
表 4 线性回归方程、检测限、定量限 Table 4 The linear regression equation、LOD and LOQ |
取“2.6.1”项下的中间浓度单糖混合对照品溶液连续进样5次,计算木糖、阿拉伯糖、葡萄糖、鼠李糖、甘露糖、半乳糖和半乳糖醛酸的峰面积与内标峰面积之比的RSD分别为3.8%、3.6%、3.2%、1.4%、1.8%、2.9%、2.5%,结果表明该方法的精密度良好。
取5份同一批号的复方南板蓝根颗粒多糖,经降解、衍生后,分别进行CZE分析。计算木糖、阿拉伯糖、葡萄糖、鼠李糖、甘露糖、半乳糖和半乳糖醛酸的峰面积与内标峰面积之比的RSD分别为4.1%、5.3%、2.5%、4.0%、5.5%、3.3%、4.9%。结果表明该方法的重复性良好。
取同批号复方南板蓝根颗粒多糖,经降解、衍生,制备供试品溶液,分别于0、2、4、6、8、10和24 h进样测定,计算出各单糖峰面积与内标峰面积的比值基本不变。表明供试品溶液在24 h内基本稳定。
2.6.3 加样回收率称取已知含量的复方南板蓝根颗粒9份,每份0.5 g,按上述优化条件进行提取、降解、衍生,以含量较高的半乳糖和半乳糖醛酸为代表进行加样回收率测定。按供试品溶液含量的50%、100%、150%,向多糖全降解液中分别加入1 mg·mL-1的半乳糖溶液0.25、0.5、0.75 mL和1 mg·mL-1的半乳糖醛酸溶液0.50、1.00、1.50 mL,得到低、中、高3个浓度水平的加标溶液,每个浓度水平各3份,衍生后进样测定。计算半乳糖和半乳糖醛酸的平均回收率分别为99.7%~106.9%和94.8%~102.5%,RSD分别为2.4%~4.9%和1.7%~4.6%。
2.7 样品测定 2.7.1 CZE法分析单糖组成称取3批不同批号的复方南板蓝根颗粒各0.5 g,加入9 mL水使其全部溶解,按上述“2.3”项、“2.4”项步骤进行提取、降解、衍生,得供试品溶液。同时对单糖对照品混合溶液进行稀释衍生,得对照品衍生化溶液。测得对照品衍生化溶液(0.08 mg·mL-1)及供试品溶液CZE谱图结果见图 2,单糖组成结果见表 5。
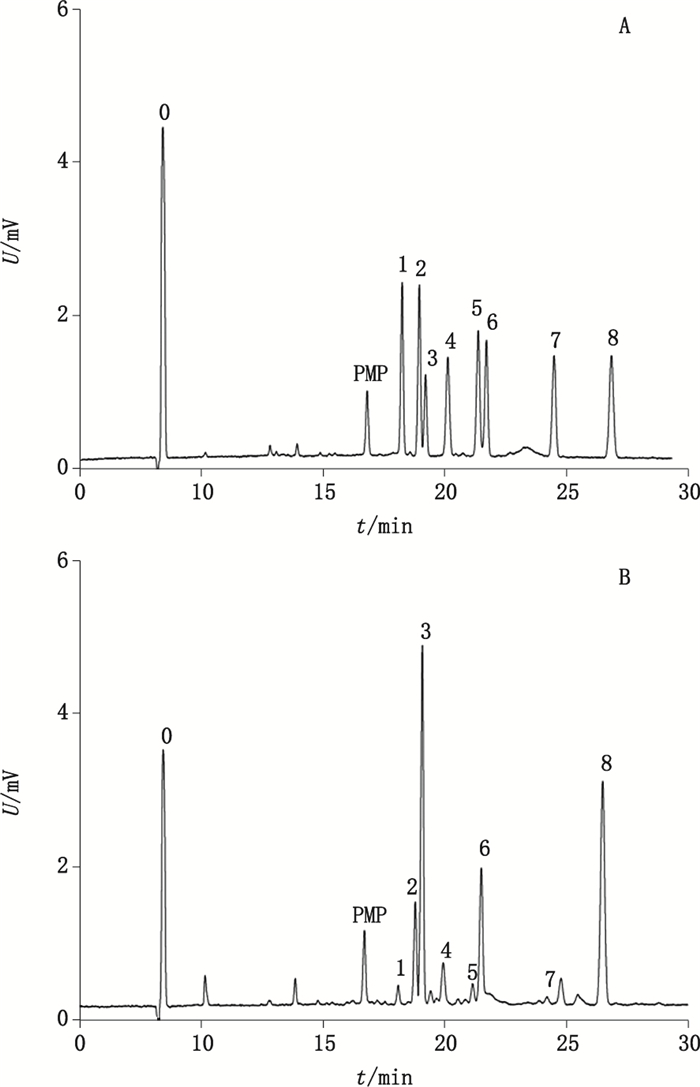
|
0.内标(internal standard)1.木糖(Xyl)2.阿拉伯糖(Ara)3.葡萄糖(Glu)4.鼠李糖(Rha)5.甘露糖(Man)6.半乳糖(Gal)7.葡萄糖醛酸(GluA)8.半乳糖醛酸(GalA) 图 2 对照品衍生化溶液(A)与供试品溶液(B)的CZE谱图 Figure 2 CZE spectra of the standards derivatization solution(A)and the test sample solution(B) |
|
|
表 5 不同批号复方南板蓝根颗粒中多糖的单糖组成及含量测定结果 Table 5 Different batch number Compound South Baphicacanthus granules monosaccharide composition of polysaccharides and content determination results |
分别精密量取0.05 mg·mL-1无水葡萄糖对照品溶液0.0、0.2、0.4、0.6、0.8、1.0、1.2 mL,依次分别加入2.0、1.8、1.6、1.4、1.2、1.0、0.8 mL水使成2 mL,各加入5%的苯酚溶液1 mL,硫酸5 mL,快速充分摇匀,40 ℃水浴30 min后,冰浴5 min,490 nm条件下测其吸光度,得回归方程:Y=15.862 9X-0.013 9 r=0.999 2
结果表明葡萄糖质量浓度在5~30 μg·mL-1的范围内呈良好线性关系。精密称取3批不同批号复方南板蓝根颗粒中所提取的多糖0.5 g,置5 mL量瓶中,加水定容,稀释10倍后,分别精密量取0.2 mL,分别加入1.8 mL水使成2 mL,各加入5%的苯酚溶液1 mL,硫酸5 mL,快速充分摇匀,40 ℃水浴30 min后,冰浴5 min,490 nm条件下测定吸收度,并计算其含量,结果见表 5。
3 讨论复方南板蓝根颗粒中含有辅料蔗糖,蔗糖降解会产生果糖和葡萄糖,影响中药多糖中单糖组成的测定。为了尽可能地除去蔗糖,同时尽量保持中药多糖的完整性,根据中药多糖[15]可在80%乙醇中沉淀,而蔗糖可溶的性质,选取料液比为对象对多糖的提取进行优化,得到最佳料液比为1:18;本实验还考察了不同pH的缓冲液对分离度的影响,结果显示,在一定范围内,pH越大,阿拉伯糖与葡萄糖的分离度越大,但甘露糖与半乳糖的分离度越小,反之亦然,综合考虑各单糖的分离度,选择缓冲液的pH为10.1。
4 小结本文优化得到复方南板蓝根颗粒中多糖全降解的最优条件为降解温度100 ℃、硫酸浓度0.75 mol·L-1、降解时间5 h。采用硫酸-苯酚法测定了多糖含量,测得3批制剂中多糖的含量基本一致,范围为1.708%~1.828%。采用毛细管电泳法测得的3批复方南板蓝根颗粒的单糖组成基本一致,均包括木糖、阿拉伯糖、葡萄糖、鼠李糖、甘露糖、半乳糖、葡萄糖醛酸和半乳糖醛酸,且该3批制剂中8种单糖含量之和基本一致,分别为0.907%、0.913%、0.937%。综合分析采用硫酸-苯酚法测定的多糖含量与采用毛细管电泳法测定的各单糖含量之和的结果,推测复方南板蓝根颗粒中可能还含有除上述8种单糖之外的其他单糖,有关问题尚待进一步探讨。研究复方南板蓝根颗粒中中药多糖的含量及单糖组成不仅对于其质量标准的完善具有一定意义,还为该制剂的药效物质基础研究提供参考。
| [1] |
卫生部药品标准. 中药成方制剂. 第五册[S]. 1991: Z5 Drug Specifications Promulgated by the Ministry of Public Health, P R China.Chinese Medicine Prescription Preparations.Vol 5[S].1991:Z5 |
| [2] |
中国药典2015年版. 一部[S]. 2015: 245 ChP 2015.Vol Ⅰ[S].2015:245 |
| [3] |
王金鹏, 孙翠萍, 林海霞, 等. HPLC测定复方南板蓝根颗粒中靛蓝和靛玉红的含量[J]. 中国实验方剂学杂志, 2012, 18(21): 128. WANG JP, SUN CP, LIN HX, et al. Content determination of indigo and indirubin in compound south Banlangen granules by HPLC method[J]. Chin J Exp Tradit Med Form, 2012, 18(21): 128. |
| [4] |
王发义, 陈关祥. 高效液相色谱法测定复方南板蓝根片及颗粒中秦皮乙素的含量[J]. 中国民族民间医药杂志, 2008, 17(5): 23. WANG FY, CHEN GX. Content determination of aesculetin in compound south Banlangen tablets and granules by HPLC method[J]. Chin J Ethnomed Ethnopharm, 2008, 17(5): 23. |
| [5] |
温琰. HPLC法测定复方南板蓝根冲剂中秦皮乙素的含量[J]. 中国药品标准, 2006, 7(3): 64. WEN Y. Content determination of esculetin in compound south Isatis root granules by HPLC[J]. Drug Stand China, 2006, 7(3): 64. |
| [6] |
李钦, 程铁峰, 许启太, 等. 复方南板蓝根冲剂质量标准研究[J]. 中国药学杂志, 2004, 39(12): 938. LI Q, CHENG TF, XU QT, et al. Study on the quality control for Fufang Nanbanlangen Chongji[J]. Chin Pharm J, 2004, 39(12): 938. DOI:10.3321/j.issn:1001-2494.2004.12.020 |
| [7] |
隋玉荣. 多糖类药物的研究进展[J]. 天津药学, 2013, 25(2): 41. SUI YR. Research advances of polysaccharide drugs[J]. Tianjin Pharm, 2013, 25(2): 41. |
| [8] |
廉宜君, 谷新利, 李炳奇. 中药方剂中复合多糖的免疫活性观察[J]. 中国兽医杂志, 2008, 44(12): 68. LIAN YJ, GU XL, LI BQ. Observation of compound polysaccharide immune activity of traditional Chinese medicine prescription[J]. Chin J Vet Med, 2008, 44(12): 68. DOI:10.3969/j.issn.0529-6005.2008.12.036 |
| [9] |
孙凌, 李维, 邱霞. 中药多糖在肿瘤治疗中的应用[J]. 中国疗养医学, 2016, 25(1): 19. SUN L, LI W, QIU X. Application of traditional Chinese medicine polysaccharide in tumor therapy[J]. Chin J Convalescent Med, 2016, 25(1): 19. |
| [10] |
张明, 朱道玉. 3个产地板蓝根多糖作用的比较研究[J]. 动物医学研究, 2008, 29(3): 32. ZHANG M, ZHU DY. A comparative study of Radix Isatidis polysaccharides function from 3 different producing areas[J]. Prog Vet Med, 2008, 29(3): 32. |
| [11] |
杨晓杰, 郑云姬, 李娜, 等. 亚洲蒲公英多糖的抑菌性和抗氧化性研究[J]. 时珍国医国药, 2012, 23(1): 109. YANG XJ, ZHENG YJ, LI N, et al. Study on the antibacterial activity and antioxidant activity of the polysaccharides from Asian Taraxaci Herba[J]. Lishizhen Med Mater Med Res, 2012, 23(1): 109. |
| [12] |
何芳, 王钦, 张春. 酶标仪测定不同产地、不同组织部位紫花地丁总糖和还原糖[J]. 中成药, 2013, 35(11): 2480. HE F, WANG Q, ZHANG C. Determination of total and reducing sugar in Viola yedoensis from different parts and habitats by microplate spectrophotometer[J]. Chin Tradit Pat Med, 2013, 35(11): 2480. DOI:10.3969/j.issn.1001-1528.2013.11.038 |
| [13] |
张小倩. 南沙参多糖的提取、降解优化及其单糖组成分析[D]. 保定: 河北大学, 2014 ZHANG XQ.Extraction and Degradation Optimization and the Analysis of Monosaccharide Composition of the Polysaccharide from Adenophorae Radix[D].Baoding:Hebei University, 2014 http://d.wanfangdata.com.cn/Thesis/D531009 |
| [14] |
GUO HZ, LIU FL, JIA GY, et al. Extraction optimization and analysis of monosaccharide composition of fucoidan from Saccharina japonica by capillary zone electrophoresis[J]. J Appl Phycol, 2013, 25(6): 1903. DOI:10.1007/s10811-013-0024-5 |
| [15] |
佟茵, 吴红娟. 植物多糖的提取方法研究进展[J]. 中医药信息, 2012, 29(5): 108. TONG Y, WU HJ. Research progress on extraction methods of plant polysaccharides[J]. Inf Tradit Chin Med, 2012, 29(5): 108. |
 2017, Vol. 37
2017, Vol. 37 
