2. 新疆维吾尔药业有限责任公司, 乌鲁木齐 830000
2. Xinjiang Uygur Pharmaceutical Co. Ltd., Urumqi 830000, China
复方木尼孜其出自具有一千多年历史的维吾尔族古籍《卡日巴丁卡德尔》,由甘草、洋甘菊、茴香根皮、骆驼蓬子、黑种草子、香青兰子、香茅、蜀葵子、茴芹果、菊苣根、芹菜根、菊苣子、罗勒子13味药材组成。本品具有调节免疫力,消除炎症和排毒的功效[1-2],临床应用广泛,皮肤科、妇科、肿瘤科及内科等各个科室都有所应用,效果显著的集中在皮肤科和妇科[3-5]。成品制剂复方木尼孜其颗粒(CMG)1999年收载于《中华人民共和国卫生部药品标准(维吾尔药分册)》[6];但其质量标准中,除了制法、性状和常规制剂检查项目外,仅采用骆驼蓬子对照药材对制剂进行定性鉴别,存在指标成分不明,专属性差等问题。有关CMG质量控制方面的研究较少,仅有方中部分单味药材的质控方法[7-8]。
本课题组前期采用热板法、醋酸扭体镇痛模型及二甲苯致耳廓肿胀、角叉菜胶致脚趾肿胀、棉球肉芽肿炎症模型,证明CMG具有抑制中枢神经和旁路神经系统活动的镇痛及抗急慢性炎症作用[2]。采用脂多糖(LPS)刺激RAW264.7细胞模型筛选出CMG组方13味药材中具有抗炎活性的药物为骆驼蓬子、甘草和黑种草子(数据未发表)。骆驼蓬子(Pegani Semen)的主要活性成分生物碱,具有抗菌、消炎、止痒及保护中枢神经系统等多方面作用[9-12],其中骆驼蓬碱和去氢骆驼蓬碱含量可达4%~7%。黑种草子(Nigellae Semen)[13]的皂苷类成分具有抗血小板聚集、抗炎镇痛、抗肿瘤及抗氧化等作用[14-16],其中异株五加甲苷含量较高,具有抗肝癌活性[17]。甘草(Glycyrrhizae Radix et Rhizoma)中三萜皂苷和黄酮苷类是其主要活性成分,具有抗炎抗菌、抗病毒、抗氧化、抗肿瘤和保护中枢神经系统等功效[18-19]。
本研究结合CMG制备工艺,在前期药效试验结果的指导下,以骆驼蓬子、黑种草子和甘草3味药材中含量高且进入制剂的成分为指标,建立了定性和定量方法,为其临床使用的安全性和有效性提供保障。各指标成分结构式见图 1。
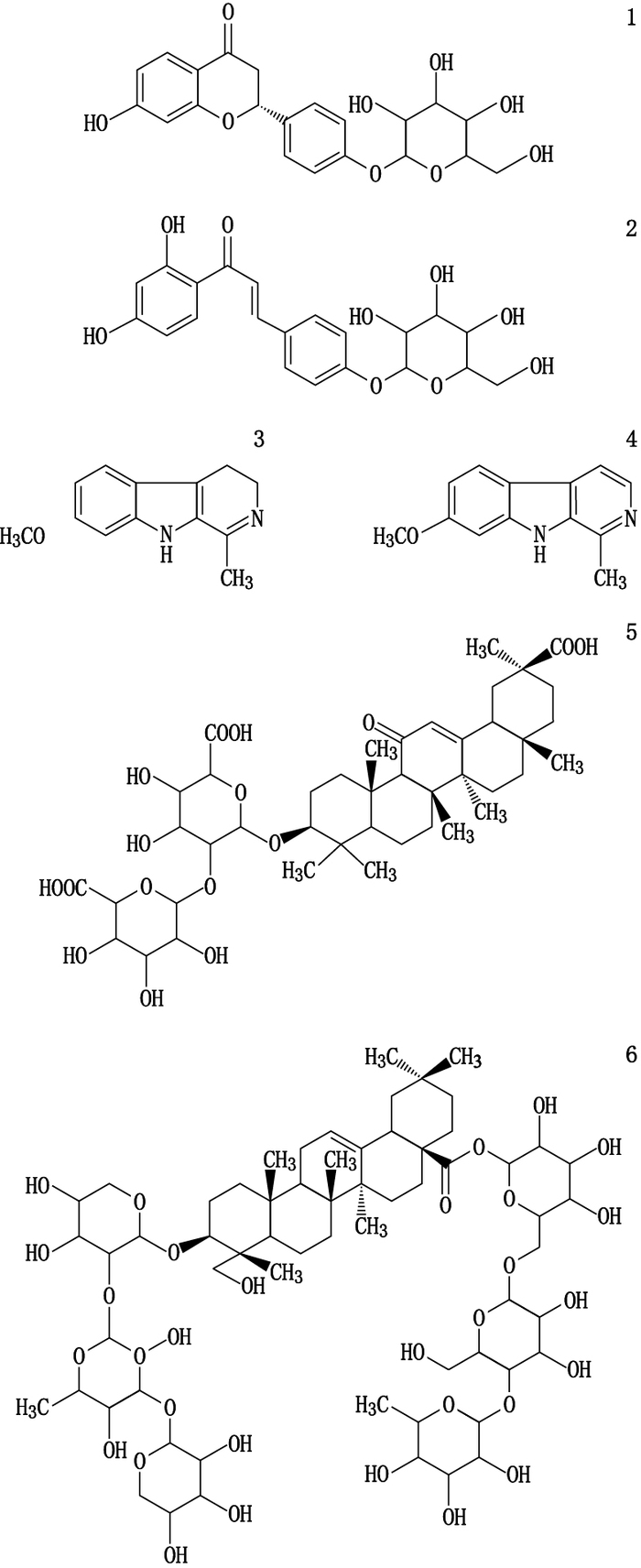
|
1.甘草苷(liquiritin)2.异甘草苷(isoliquiritin)3.骆驼蓬碱(harmaline)4.去氢骆驼蓬碱(harmine)5.甘草酸(glycyrrhizic acid)6.异株五加甲苷(sieboldianoside A) 图 1 CMG中各指标成分结构式 Figure 1 Chemical structures of reference substances for CMG |
Agilent 1200高效液相色谱仪(包括1322A型在线真空脱气机、1311A型四元泵、1367B型自动进样器、1316A柱恒温箱、1315D型DAD检测器),Agilent公司;Agilent 1260 Infinity蒸发光散射检测器,Agilent公司;Boston Luna Clone C18色谱柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶),Boston Analytics公司;Linomat-Ⅵ薄层色谱自动点样仪,CAMAG公司;Reprostar 3薄层色谱摄影仪,CAMAG公司;Satorius BSA 124S-CW万分之一电子分析天平和Sartorius BT 25S电子分析天平,北京赛多利斯仪器系统有限公司;KQ-250DB数控超声波清洗器,昆山市超声仪器有限公司。
D101型大孔吸附树脂(批号20140606),国药集团化学试剂有限公司。硅胶预制板(HSGF254,200 mm×100 mm),烟台江友硅胶开发有限公司“银龙牌”(批号20151116)。
对照品:骆驼蓬碱、去氢骆驼蓬碱、异株五加甲苷由上海中药标准化研究中心提供(HPLC面积归一化法测定,纯度大于98%),甘草苷(批号07003-201602)、异甘草苷(批号200026-201511)和甘草酸(批号070019-201602)均购自上海奈启生物科技有限公司(纯度均大于98%)。样品:25批CMG(批号分别为150622、150623、150711、150712、150715、150716、151125、151131、151144、151148、1212071、1210481、1301532、1212522、1211152、1210382、1211191、1301341、1302071、1210571、1301371、1301572、1212061、1210482和1208562,规格为12 g·袋-1)由新疆维吾尔药业有限责任公司提供。对照药材:甘草(批号120904-2015)购自中国食品药品检定研究院;骆驼蓬子和黑种草子采自新疆,由上海中药标准化研究中心吴立宏研究员鉴定为骆驼蓬(Peganum harmala L.)和腺毛黑种草(Nigella glandulifera Freyn et Sint.)的干燥成熟种子。
乙腈和醋酸为色谱纯,水为超纯水,其他试剂均为分析纯。
2 方法与结果 2.1 薄层色谱定性鉴别 2.1.1 混合对照品溶液制备取甘草苷、骆驼蓬碱、去氢骆驼蓬碱、异株五加甲苷的对照品适量,精密称定,加甲醇溶解,制成质量浓度均为1 mg·mL-1的混合溶液,即得混合对照品溶液。
2.1.2 供试品溶液制备取样品5 g,精密称定,加水10 mL,溶解,滤过,取上清液,过D101型大孔吸附树脂(柱高:15 cm;柱内直径:1.1 cm)纯化,以水40 mL洗脱,弃去水液;再用20%乙醇水40 mL洗脱,弃去20%乙醇水洗脱液;最后用乙醇40 mL洗脱,收集洗脱液,浓缩,加甲醇2 mL使残渣溶解,滤过,即得供试品溶液。
2.1.3 阴性样品溶液与对照药材溶液制备分别取除甘草、除骆驼蓬子、除黑种草子外的其余12味药材,按制备工艺分别制成缺甘草,缺骆驼蓬子,缺黑种草子的3个阴性样品;取除甘草、骆驼蓬子和黑种草子外的10味药材,按制备工艺制成同时缺3味药的阴性样品;取以上4种阴性样品,按“2.1.2”项下方法制备得到4个不同的阴性样品溶液。另外取甘草、骆驼蓬子和黑种草子对照药材各1 g,分别加甲醇10 mL,超声(功率250 W,频率40 kHz)处理30 min,放冷,滤过,滤液蒸干,残渣加2 mL甲醇使溶解,即得各自的对照药材溶液。
2.1.4 薄层色谱鉴别分别吸取上述混合对照品溶液和对照药材溶液各5 μL,供试品溶液和各阴性样品溶液各10 μL,分别点于同一硅胶HSGF254薄层色谱板上,以正丁醇-水-甲醇-三乙胺(3:1:0.5:0.5)为展开剂,展开、取出、晾干,再喷以10%硫酸乙醇试液,置105 ℃加热至斑点显色清晰。在10%硫酸乙醇试液显色后在紫外灯366 nm条件下检视去氢骆驼蓬碱和骆驼蓬碱,日光下检视甘草苷和异株五加甲苷;结果样品色谱在与对照品和对照药材色谱相应位置上显相同颜色的斑点,各阴性样品在相应位置上没有相应斑点,表明阴性样品对鉴别结果无干扰,见图 2。本鉴别方法的优点是能在同一薄层色谱板上,采用相同的展开和显色条件,同时鉴别来源于多个不同药材的专属性成分,且各个成分的Rf值合适,各斑点间分离度良好,条带清晰,可节约检测时间和成本,具有方便快捷的特点,可以用于复方木尼孜其颗粒的定性鉴别。
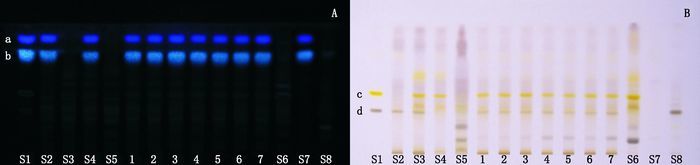
|
1~7.样品(samples)S1.混合对照品(mixed reference substances):a.去氢骆驼蓬碱(harmine)b.骆驼蓬碱(harmaline)c.甘草苷(liquiritin)d.异株五加甲苷(sieboldianoside A)S2.缺甘草的阴性样品(negative sample of Glycyrrhizae Radix et Rhizoma)S3.缺骆驼蓬子的阴性样品(negative sample lack of Pegani Semen)S4.缺黑种草子的阴性样品(negative sample lack of Nigellae Semen)S5.缺甘草、骆驼蓬子和黑种草子的阴性样品(negative sample lack of Glycyrrhizae Radix et Rhizoma,Pegani Semen or Nigellae Semen)S6.甘草对照药材(Glycyrrhizae Radix et Rhizoma reference drug)S7.骆驼蓬子对照药材(Pegani Semen reference drug)S8.黑种草子对照药材(Nigellae Semen reference drug) A.紫外366 nm(UV 366 nm)B.日光(sunlight) 图 2 CMG的TLC图 Figure 2 TLC chromatograms of CMG |
分别取甘草苷、异甘草苷、甘草酸、骆驼蓬碱、去氢骆驼蓬碱和异株五加甲苷的对照品适量,精密称定,加甲醇分别制成每1 mL含甘草苷1.564 mg、异甘草苷0.994 mg、甘草酸2.002 mg、骆驼蓬碱3.540 mg、去氢骆驼蓬碱3.028 mg、异株五加甲苷4.024 mg的对照品储备液;分别精密吸取甘草苷、异甘草苷、甘草酸、骆驼蓬碱、去氢骆驼蓬碱和异株五加甲苷的对照品储备液适量,加甲醇稀释成质量浓度分别为469.20、99.40、400.40、708.00、605.60和402.4 μg·mL-1的混合溶液,作为混合对照品储备液。
2.2.2 供试品溶液与阴性样品溶液制备取装量差异项下的样品适量,研细,称取约12 g,精密称定,加水20 mL使溶解,溶液转移至分液漏斗中,用水饱和的正丁醇萃取3次,每次30 mL,合并正丁醇层,回收溶剂至干,用80%甲醇水溶解并转移至5 mL量瓶,溶解并稀释至刻度,摇匀,滤过,即得供试品溶液;同法制备分别缺甘草、骆驼蓬子、黑种草子3个单味药材的阴性样品和同时缺上述3味药材的阴性样品,并制备成4个阴性样品溶液。
2.2.3 色谱条件采用Boston Luna Clone C18(4.6 mm×250 mm,5 μm)色谱柱,柱温30 ℃,以流动相乙腈(A)-乙酸铵缓冲盐溶液[11](B)为流动相,梯度洗脱(0~10 min,19%A;10~20 min,19%A→33%A;20~35 min,33%A),流速1 mL·min-1,ELSD漂移管温度45 ℃,载气压力3.3×105 Pa,gain值6。
2.2.4 专属性试验在上述色谱条件下对样品、对照品及阴性样品的溶液进行HPLC分析;结果(图 3)阴性样品色谱中,在与对照品色谱的甘草苷、异甘草苷、甘草酸、骆驼蓬碱、去氢骆驼蓬碱和异株五加甲苷相应的出峰处无干扰峰出现,表明处方中其他成分对测定无影响。
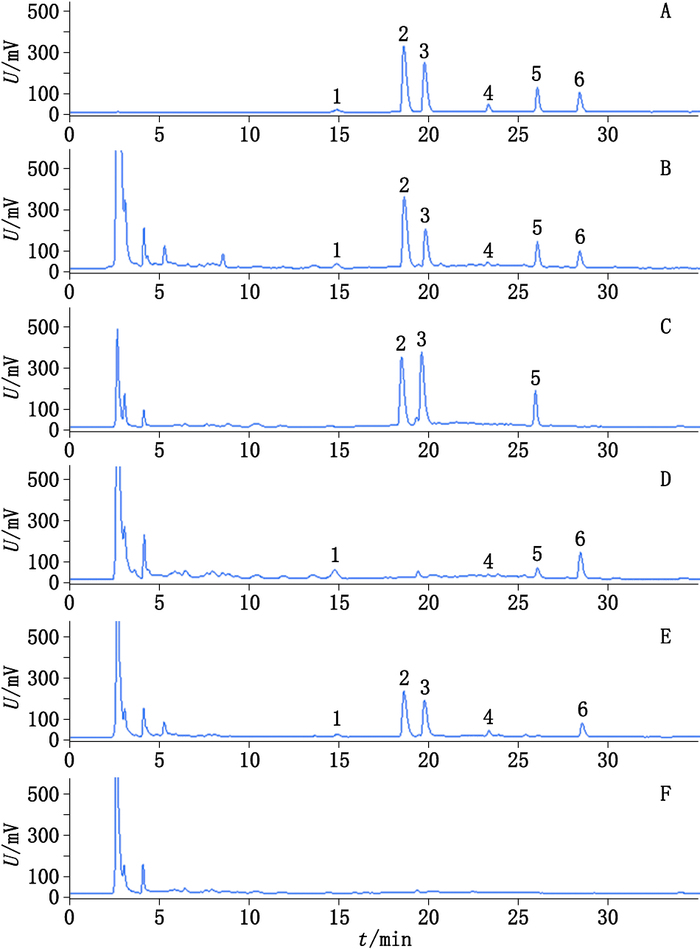
|
1.甘草苷(liquiritin)2.骆驼蓬碱(harmaline)3.去氢骆驼蓬碱(har-mine)4.异甘草苷(isoliquiritin)5.异株五加甲苷(sieboldianoside A)6.甘草酸(glycyrrhizic acid) A.混合对照品(mixed reference substances)B.样品(sample)C.缺甘草阴性样品(negative sample lack of Glycyrrhizae Radix et Rhizoma)D.缺骆驼蓬子阴性样品(negative sample lack of Pegani Semen)E.缺黑种草子阴性样品(negative sample lack of Nigellae Semen)F.缺甘草、骆驼蓬子和黑种草子3味药阴性样品(reference drug Glycyrrhizae Radix et Rhizoma,Pegani Semen or Nigellae Semen) 图 3 对照品、样品及阴性样品HPLC对比图 Figure 3 HPLC chromatograms of mixed reference substances, sample and negative samples |
精密吸取混合对照品储备液适量,依次用甲醇稀释成一系列不同浓度的混合对照品溶液,甘草苷质量浓度分别为14.66、29.33、58.65、117.30、234.60、469.20 μg·mL-1,异甘草苷质量浓度分别为3.11、6.21、12.43、24.85、49.70、99.40 μg·mL-1,甘草酸质量浓度分别为12.51、25.03、50.05、100.10、200.20、400.40 μg·mL-1,骆驼蓬碱质量浓度分别为22.13、44.25、88.50、177.00、354.00、708.00 μg·mL-1,去氢骆驼蓬碱质量浓度分别为18.93、37.85、75.70、151.40、302.80、605.60 μg·mL-1,异株五加甲苷质量浓度分别为12.58、25.15、50.30、100.60、201.20、402.40 μg·mL-1;精密吸取上述混合对照品溶液各20 μL,分别注入色谱仪进行测定。以质量浓度的自然对数值(X)为横坐标,峰面积的自然对数值(Y)为纵坐标,进行线性回归,得线性方程及相关系数,见表 1。结果表明甘草苷、异甘草苷、甘草酸、骆驼蓬碱、去氢骆驼蓬碱和异株五加甲苷质量浓度分别在14.66~469.20、3.11~99.40、12.51~400.40、22.13~708.00、18.93~605.60和12.58~402.40 μg·mL-1范围内呈良好线性关系。
|
|
表 1 各指标成分的回归方程、相关系数(r)、LOD和LOQ Table 1 Regression equation, correlation coefficient (r) , LOD and LOQ of each reference substance |
取混合对照品溶液适量,逐步稀释,按“2.2.3”项下条件进样20 μL进行测定。测得信噪比为3:1时,甘草苷、异甘草苷、甘草酸、骆驼蓬碱、去氢骆驼蓬碱和异株五加甲苷检测限(LOD)分别为7.33、1.55、6.27、11.06、9.46、6.29 μg·mL-1;测得信噪比为10:1时,上述6个成分定量限(LOQ)分别为14.66、3.11、12.51、22.13、18.93、12.58 μg·mL-1。
2.2.7 精密度试验分别取高、中、低(甘草苷469.20、234.60、117.30 μg·mL-1,异甘草苷99.40、49.70、24.85 μg·mL-1,甘草酸400.40、200.20、100.10 μg·mL-1,骆驼蓬碱708.00、354.00、177.00 μg·mL-1,去氢骆驼蓬碱605.60、302.80、151.40 μg·mL-1,异株五加甲苷402.40、201.20、100.60 μg·mL-1)3个浓度的混合对照品溶液,同一天内连续进样6次,每次进样10 μL,测得甘草苷、异甘草苷、甘草酸、去氢骆驼蓬碱和异株五加甲苷峰面积的RSD为0.4%~2.9%,说明日内精密度良好。分别连续3 d进行测试,每天进样一次,每次进样10 μL,测得上述6个成分峰面积的RSD为0.8%~2.9%,表明日间精密度良好。
2.2.8 稳定性试验取CMG(批号150716)供试品溶液,分别在0、2、4、8、12、16、24和48 h各进样10 μL。结果测得甘草苷、异甘草苷、甘草酸、去氢骆驼蓬碱和异株五加甲苷锋面积的RSD分别为2.2%、2.4%、2.8%、2.8%、2.5%和2.6%,表明供试品溶液在48 h内基本稳定。
2.2.9 重复性试验取CMG(批号:150716),研细,约12 g,精密称定,按“2.2.2供试品溶液制备”项下方法制备供试品溶液,平行6份,进样10 μL。结果测得甘草苷、异甘草苷、甘草酸、去氢骆驼蓬碱和异株五加甲苷含量分别为101.75、24.83、143.07、349.43、180.22和173.02 μg·g-1(即1.22、0.30、1.72、4.19、2.16和2.08 mg·袋-1),RSD分别为2.7%、2.4%、2.7%、1.3%、2.8%和2.4%,说明方法重复性良好。
2.2.10 加样回收率试验分别取甘草苷、异甘草苷、甘草酸、骆驼蓬碱、去氢骆驼蓬碱和异株五加甲苷对照品适量,精密称定,加甲醇溶解,制成质量浓度分别为275.20、68.08、444.00、815.20、399.60、476.00 μg·mL-1的混合对照品溶液;取已准确进行含量测定(批号150715,甘草苷、异甘草苷、甘草酸、骆驼蓬碱、去氢骆驼蓬碱和异株五加甲苷含量分别为91.61、22.74、150.60、271.71、132.42和158.25 μg·g-1)的CMG约6 g,精密称定,按50%、100%和150%分别加入上述混合对照品溶液,按“2.2.2”项下方法制备供试溶液,进样10 μL,测定各成分的量,计算加样回收率及平均加样回收率。结果见表 2。
|
|
表 2 加样回收试验 Table 2 Results of recovery tests |
取装量差异项下不同批次的CMG,研细,取约12 g,精密称定。每批平行2份,按“2.2.2”项下方法制备供试品溶液。分别精密吸取混合对照品溶液(各对照品的质量浓度:甘草苷234.60 μg·mL-1,异甘草苷99.40 μg·mL-1,甘草酸400.40 μg·mL-1,骆驼蓬碱708.00 μg·mL-1,去氢骆驼蓬碱605.60 μg·mL-1,异株五加甲苷402.40 μg·mL-1)20、10 μL和供试品溶液各10 μL,注入液相色谱仪,按外标两点法计算甘草苷、异甘草苷、甘草酸、骆驼蓬碱、去氢骆驼蓬碱和异株五加甲苷的含量。结果见表 3。
|
|
表 3 不同批次CMG中6个成分含量测定结果(±SD,mg·袋-1,n=3) Table 3 Contents of six ingredients in different batches of CMG(±SD, mg per bag, n=3) |
CMG通过口服给药。通过模拟人胃酸性环境,用酸水处理CMG样品,建立了指纹图谱,通过与单味药材对比,归属对制剂有贡献的药材,并指认部分共有峰,为制剂到体内后的整体特征提供信息,也为质控成分的选择提供了试验依据。
2.3.1 供试品溶液制备取CMG,研细,称取约15 g,精密称定。加入0.05 mol·L-1盐酸溶液20 mL溶解,溶液转移至分液漏斗中,用乙酸乙酯萃取3次,每次40 mL,合并乙酸乙酯层,回收溶剂至干,残渣加甲醇2 mL溶解,滤过,即得。
2.3.2 色谱条件采用Boston Luna Clone C18(4.6 mm×250 mm,5 μm)色谱柱,柱温30 ℃,以乙腈(A)-乙酸铵缓冲盐溶液[11](B)为流动相,梯度洗脱(0~5 min,5%A;5~25 min;5%A→18%A;25~30 min,18%A;30~45 min,18%A→32% A;45~60 min,32%A→70%A),流速为1 mL·min-1,进样量为10 μL。
2.3.3 方法学考察分别进行了精密度、重复性和稳定性试验。取CMG(批号1212071),按“2.3.1”项下方法制备供试品溶液,连续进样6次,分别考察共有峰的相对保留时间及峰面积比值进行精密度试验;取同一供试品溶液,在0、2、4、8、12、24、36、48 h进样分析,分别考察共有峰的相对保留时间及相对峰面积进行稳定性试验;另精密称取CMG(批号1212071)6份,按“2.3.1”项下方法制备供试品溶液,分别考察共有峰的相对保留时间及相对峰面积进行重复性试验。结果各共有峰相对保留时间的RSD均小于0.30%,相对峰面积的RSD均小于3.0%。说明仪器精密度良好,方法重复性好,样品稳定性良好。
2.3.4 指纹图谱建立将15批CMG的指纹图谱数据导入国家药典委员会颁布的“中药色谱指纹图谱相似度评价系统”(2012版)软件中进行分析,采用中位数法生成CMG指纹图谱,标定了18个共有峰。结果见图 4。
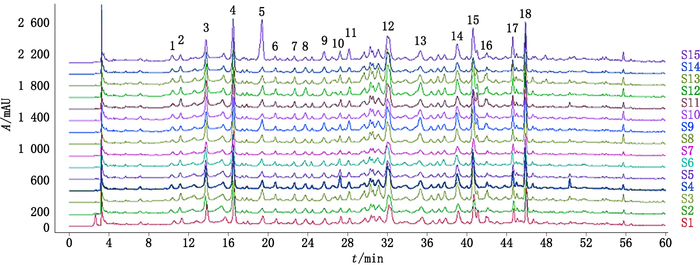
|
图 4 15批CMG样品指纹图谱 Figure 4 HPLC fingerprint chromatograms of 15 batches of CMG |
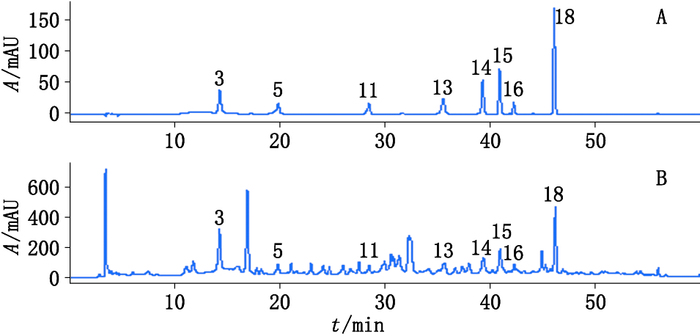
取CMG(批号1212071),按“2.3.1”项下方法处理。采用保留时间、UV图谱及结合相关参考文献[8, 18, 21-29]和对照品比对法,对样品图谱中共有峰进行归属,分别指认出了绿原酸、咖啡酸、阿魏酸、甘草苷、骆驼蓬碱、去氢骆驼蓬碱、芹菜素-7-O-葡萄糖苷和异甘草苷等8个成分。结果见图 5。
|
A.混合对照品(mixed reference substances)B. CMG样品(CMG sample)3.绿原酸(chlorogenic acid)5.咖啡酸(caffeic acid)11.阿魏酸(ferulic acid)13.甘草苷(liquiritin)14.骆驼蓬碱(harmaline)15.去氢骆驼蓬碱(harmine)16.芹菜素-7-O-葡萄糖苷(apigenin-7-O-glucuronide)18.异甘草苷(isoliquiritin) 图 5 对照品及CMG样品HPLC图 Figure 5 HPLC chromatograms of mixed reference substances and CMG sample |
通过与对照品及文献比较,CMG指纹图谱中的共有峰既有来源于单味药材的专属性成分,如甘草苷和异甘草苷来自甘草,骆驼蓬碱和去氢骆驼蓬碱来自骆驼蓬子,也有来源于多味药材的共有成分,如绿原酸分别来自洋甘菊[20]、菊苣根[21]、菊苣子[21]、香茅[22],咖啡酸来自洋甘菊[23]、茴香根皮[24],香青兰子[25]、阿魏酸来自茴香根皮[24]、香青兰子[25]、甘草[26]、蜀葵子[27],芹菜素-7-O-葡萄糖苷来自洋甘菊[28]、香青兰子[29]。建立的指纹图谱能为制剂进入人体后的成分变化提供部分信息,但具体是哪些成分能够入血并发挥药效还需进一步的探究。
3 讨论研究中药材或复方中的有效成分,能够快速找出其功效的物质基础,是一个时期以来研究中药功效最常用的方法。但多年的实践证明,这种方法忽略了中药成分的复杂性和整体性,检测任何一种活性成分均不能客观反应中药复方制剂多成分、多靶点的整体疗效。建立制剂多指标成分的质控方法,在一定程度上可以有效避免测定某单一成分而出现的偏颇现象。因此,结合复方木尼孜其颗粒药效、制备工艺、指纹图谱研究,本研究选择甘草中的甘草苷、异甘草苷、甘草酸,骆驼蓬子中的骆驼蓬碱和去氢骆驼蓬碱,黑种草子中的异株五加甲苷为质控指标建立CMG的质量标准。
TLC鉴别试验中,通过D101型大孔树脂处理可以有效避免杂质对各指标成分的干扰,样品展开后斑点清晰,分离度好,具有方便、快捷的特点。若采用含测项下制备的供试品溶液,展开效果会受制剂中大量糖分、淀粉等辅料的影响,导致斑点无法识别。试验初期还对乙酸乙酯-2-丁酮-甲酸-水、正丁醇-水-醋酸和正丁醇-水-甲醇-三乙胺等多个展开体系进行比较,由于所选指标成分中有皂苷、生物碱和黄酮苷,化合物的性质相差较大,展开效果不佳。经对展开条件进行优化,最终选择正丁醇-水-甲醇-三乙胺为展开系统,达到了在同一展开条件下一次展开同时鉴别多个药材的目的。
皂苷类指标成分异株五加甲苷是以常春藤皂苷元为母核的齐墩果烷型三萜皂苷,结构上不存在共轭体系,因此无法采用DAD检测器对6个指标成分进行同时测定。ELSD为通用型检测器,可用于检测任何挥发性低于流动相的有机物,特别是没有紫外吸收的化合物。采用ELSD作为检测器,对复方木尼孜其颗粒中在ELSD响应较好的6个指标成分(相对含量较高)进行测定,实现了在同一色谱条件下测定复方中多个指标成分的目的。
本研究建立了CMG多指标TLC鉴别及HPLC-ELSD含量测定方法,与原标准相比,明确了指标成分,实现了在同一色谱条件下鉴别和测定复方中多个指标成分的目的,节约了时间和检测成本,具有一定的实用性和可操作性。
| [1] |
UMAR A, YIMINA W, TOHTI I, et al. Effect of traditional Uyghur medicine abnormal Savda Munziq extract on rabbit platelet aggregation in vitro and rat arteriovenous shunt thrombosis in vivo[J]. J Ethnopharmacol, 2015, 159: 184. DOI:10.1016/j.jep.2014.11.006 |
| [2] |
CHENG JJ, WANG CH, CHENG XM, et al. In in vivo evaluation of the antiinflammatory and analgesic activities of compound Muniziqi granule in experimental animal models[J]. BMC Complementary Altern Med, 2016, 16: 20. |
| [3] |
凌丰, 沈纳峰, 叶岩. 复方木尼孜其颗粒联合维A酸乳膏治疗黄褐斑的临床疗效及其机制分析[J]. 中国生化药物杂志, 2015, 35(9): 118. LING F, SHEN NF, YE Y. Analysis on clinical effects and mechanism of compound Muniziqi granules combined with vitamin A acid cream in patients with chloasma[J]. Chin J Biochem Pharm, 2015, 35(9): 118. |
| [4] |
杨金武, 郭洪春, 彭文怡. 红蓝光动力联合复方木尼孜其颗粒及阿达帕林凝胶治疗重度痤疮疗效评价[J]. 中国麻风皮肤病杂志, 2014, 30(1): 40. YANG JW, GUO HC, PENG WY. Assessment of the efficacy of red and blue light power combined with compound muniziqi granules and adapalene gel in the treatment of severe acne[J]. Chin J Lepr Skin Dis, 2014, 30(1): 40. |
| [5] |
郑漪霖, 余黎. 复方木尼孜其颗粒对盆腔炎性疾病后遗症的作用[J]. 中国妇幼保健, 2010, 25(36): 5473. ZHENG YL, YU L. Effect of compound Muniziqi particles on sequel of pelvic in flammatory diseases[J]. Matern Child Health Care China, 2010, 25(36): 5473. |
| [6] |
中华人民共和国卫生部药品标准. 维吾尔药分册[S]. 1998: 164 Drug Specifications Promulgated by the Ministry of Public Health. P R China. Uigher Medicine[S]. 1998:164 |
| [7] |
董学平, 贾晶. 复方木尼孜其颗粒中甘草酸铵HPLC含量测定方法研究[J]. 齐鲁药事, 2011, 30(11): 644. DONG XP, JIA J. Study on determination of ammonium glycyrrhizinate in compound Muniziqi granules by HPLC[J]. Qilu Pharm Aff, 2011, 30(11): 644. |
| [8] |
程娟娟, 穆丹丹, 程雪梅, 等. 复方木尼孜其颗粒中骆驼蓬子质量控制方法研究[J]. 上海中医药杂志, 2014, 48(11): 91. CHEN JJ, MU DD, TIAN F, et al. Study on quality control of Peganum harmala in compound Muniziqi granules[J]. Shanghai J Tradit Chin Med, 2014, 48(11): 91. |
| [9] |
温方方, 张磊, 程雪梅, 等. 维药骆驼蓬草质量标准研究[J]. 中国中药杂志, 2012, 37(19): 2971. WENG FF, ZHANG L, WANG CH, et al. Research on quality standards of herbs of Peganum harmala[J]. China J Chin Mater Med, 2012, 37(19): 2971. |
| [10] |
赵婷, 王长虹, 王峥涛. 骆驼蓬属植物中生物碱类化学成分及其药理活性研究进展[J]. 国际药学研究杂志, 2010, 37(5): 333. ZHAO T, WANG CH, WANG ZT. Chemical constituents and pharmacologic actions of genus Peganum:research advances[J]. J Int Pharm Res, 2010, 37(5): 333. |
| [11] |
杨雅迪, 程雪梅, 王长虹, 等. 维药骆驼蓬子药材质量标准研究[J]. 中国药学杂志, 2014, 49(2): 106. YANG YD, CHENG XM, WANG CH, et al. Research on quality specification of the seeds of Peganum harmala L. of a Uygur traditional medicine[J]. Chin Pharm J, 2014, 49(2): 106. |
| [12] |
王长虹, 刘军, 郑立明, 等. 不同产地骆驼蓬不同药用部位中生物碱的含量分析[J]. 中国药学杂志, 2002, 37(3): 211. WANG CH, LIU J, ZHENG LM, et al. Analysis of harmine and harmaline of Peganum harmala in different parts and different localities[J]. Chin Pharm J, 2002, 37(3): 211. |
| [13] |
中国药典2015年版. 一部[S]. 2015: 345 ChP 2015. Vol Ⅰ [S]. 2015:345 |
| [14] |
章丹丹, 凌霜, 张洪平, 等. 黑种草子不同组分抑制亚硝酸盐积累、血小板聚集和血管收缩的体外实验研究[J]. 中成药, 2013, 35(7): 1376. ZHANG DD, LING S, ZHANG HP, et al. The inhibitory effect of different fractions from Nigellae Semen in vitro on nitrite accumulation, platelet aggregation and vasoconstriction[J]. Chin Tradit Pat Med, 2013, 35(7): 1376. |
| [15] |
章丹丹, 聂绪强, 潘会君, 等. 黑种草子总皂苷对炎症介质及E信号转导通路的影响[J]. 中国中药杂志, 2010, 35(19): 2594. ZHANG DD, NIE XQ, PAN HJ, et al. Study on the effect of total saponins from Semen Nigellae on inflammatory mediators and ERK/MAPK pathway in stimulated macrophage[J]. China J Chin Mater Med, 2010, 35(19): 2594. |
| [16] |
王林林, 史玉柱, 徐芳, 等. 瘤果黑种草子总皂苷治疗类风湿性关节炎的作用研究[J]. 中药药理与临床, 2014, 30(3): 78. WANG LL, SHI YZ, XU F, et al. Evaluation on arthritis of total sapionins from Nigella glandulifera seeds[J]. Pharmacol Clin Chin Mater Med, 2014, 30(3): 78. |
| [17] |
孙璐. 维药斯亚旦抗肝癌有效成分研究[D]. 天津: 天津理工大学, 2014 SUN L. Studies on the anti-hepatoma constituents of Nigella glandulifera[D]. Tianjin:Tianjin University of Technology, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10060-1015510590.htm |
| [18] |
ASL MN, HOSSEINZADEH H. Review of pharmacological of Glycyrrhiza sp. and its bioactive compounds[J]. Phytother Res, 2008, 22(6): 709. DOI:10.1002/(ISSN)1099-1573 |
| [19] |
MA CH, MA ZQ, LIAO XL, et al. Immunoregulatory effects of glycyrrhic acid exerts anti-asthmatic effects via modulation of Th1/Th2 cytolines and enhancement of CD4+ CD25+ Foxp3+ regulatory T cells in ovalbumin-sensitized mice[J]. J Ethnopharmacol, 2013, 148(3): 755. DOI:10.1016/j.jep.2013.04.021 |
| [20] |
苏钟慧. HPLC法测定洋甘菊药材野生和栽培品种中绿原酸的含量[J]. 新疆中医药, 2015, 33(4): 59. SU ZH. Determination of chlorogenic acid in wild and artificial cultivated Matricaria recutita by HPLC[J]. Xinjiang J Tradit Chin Med, 2015, 33(4): 59. |
| [21] |
再娜布·吐合达洪, 仲婕, 信学雷, 等. 毛菊苣药材不同部位主要活性成分含量[J]. 中国中药杂志, 2010, 35(8): 1010. ZAYNAP·TOHTAHONL, ZHONG J, XIN XL, et al. Comparative studies on the content of major active compositions in different parts of Cichorium glandulosum[J]. China J Chin Mater Med, 2010, 35(8): 1010. |
| [22] |
王勇, 魏娜, 董静静. 高效液相色谱法测定海南香茅中绿原酸的含量[J]. 海南医学院学报, 2012, 18(4): 445. WANG Y, WEI N, DONG JJ. Determination of chlorogenic acid in the herb of Cymbopogon citrus from Hainan by HPLC[J]. J Hainan Med Univ, 2012, 18(4): 445. |
| [23] |
朱栋梁. 罗马洋甘菊和箬竹叶中精油和黄酮的萃取、鉴定及应用[D]. 无锡: 江南大学, 2015 ZHU DL. Extraction, Identification and Application of Essential Oils and Flavonoids from Anthemis nobilis; and Indocalamus latifolius Leaves[D]. Wuxi:Jiangnan University, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10295-1016029891.htm |
| [24] |
宋太发. 红筒香枝叶的化学成分研究[D]. 长沙: 湖南中医药大学, 2009 SONG TF. Study on the Chemical Constituents of Twigs and Leaves of Illicium henryi[D]. Changsha:Hunan University of Chinese Medicine, 2009 http://cdmd.cnki.com.cn/Article/CDMD-10541-2009243262.htm |
| [25] |
吴小军, 宋建晓, 赵爱华, 等. 香青兰酚酸性化学成分的研究[J]. 天然产物研究与开发, 2011, 23(3): 446. WU XJ, SONG JX, ZHAO AH, et al. Phenolic acid constituents from Dracocephalum moldavica[J]. Nat Prod Res Dev, 2011, 23(3): 446. |
| [26] |
李利军, 吴峰敏, 程昊, 等. 电堆集-非水毛细管电泳分离测定甘草次酸和阿魏酸的研究[J]. 分析测试学报, 2008, 27(6): 611. LI LJ, WU FM, CHENG H, et al. Simultaneous separation and determination of glycyrrhetinic acid and ferulic acid by sample electrostacking-non aqueous capillary electrophoresis[J]. J Instrum Anal, 2008, 27(6): 611. |
| [27] |
冯育林, 徐丽珍, 杨世林, 等. 蜀葵花的化学成分研究(Ⅰ)[J]. 中草药, 2005, 36(11): 1610. FENG YL, XU LZ, YANG SL, et al. Chemical constituents isolated from flowers of Althaea rosea[J]. Chin Tradit Herb Drugs, 2005, 36(11): 1610. DOI:10.3321/j.issn:0253-2670.2005.11.004 |
| [28] |
李建光, 韩松林, 赵东升, 等. 一测多评法测定新疆两种洋甘菊中5种化学成分含量[J]. 医药导报, 2014, 33(11): 1491. LI JG, HAN SL, ZHAO DS, et al. Determination of five compounds from two species of Chamomiles from Xinjiang by QAMS[J]. Her Med, 2014, 33(11): 1491. DOI:10.3870/yydb.2014.11.025 |
| [29] |
于宁, 姜雯, 何承辉. 高效液相色谱法同时测定香青兰不同部位中5种化学成分的含量[J]. 中国药学杂志, 2016, 51(7): 583. YU N, JIANG W, HE CH, et al. Simultaneous determination of five effective components in different parts of Dracocephalum moldevica L. by RP-HPLC[J]. Chin Pharm J, 2016, 51(7): 583. |
 2017, Vol. 37
2017, Vol. 37 
