2. SCIEX APAC 应用中心, 北京 100015
2. SCIEX APAC Application Center, Beijing 100015, China
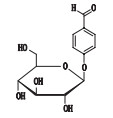
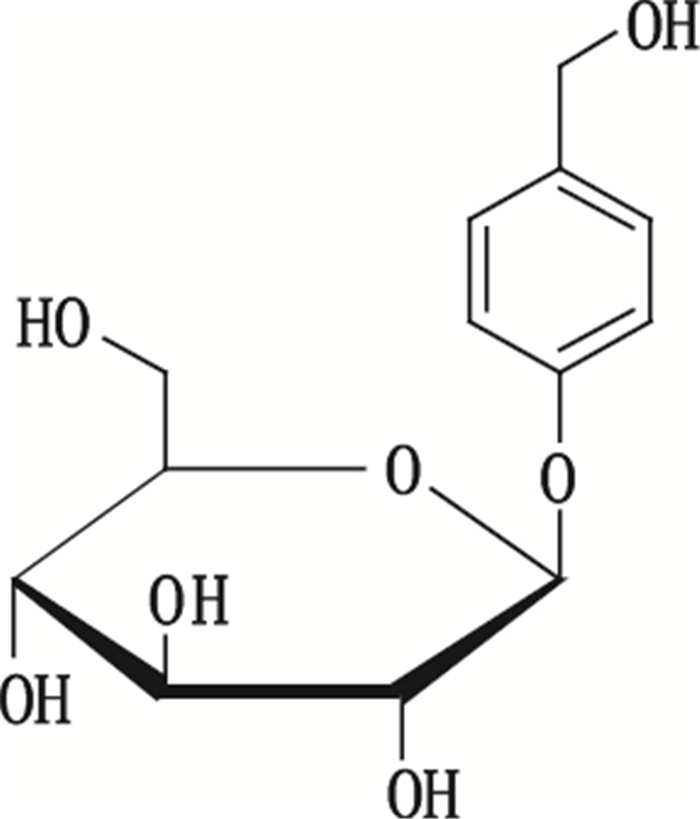
天麻素(gastrodin),又名天麻苷,化学名为4-羟甲基苯基-β-D-吡喃葡萄糖苷(图 1),具有镇痛、安眠、抗惊厥等中枢抑制作用[1],临床上广泛用于眩晕、头痛、神衰等,是急性头痛发作的首选药。天麻素是兰科多年生寄生植物天麻Gastrodia elate Blume中的主要活性成分[2],于1979年从天麻中分离并合成[3-4]。天麻素注射液的质量标准在2001年上升至国家药品标准[5],2014年再次标准提高[6],国外药典无收载。该药每日用药量大[7],国内外文献却未见对其杂质的系统研究报道。
|
图 1 天麻素的化学结构 Figure 1 The chemical structure of gastrodin |
本研究基于质量源于设计(quality by design,QbD)理念,即高品质的产品源于优质的工艺设计[8],对天麻素注射液的杂质谱进行研究[9-12],采用Q-TRAP LC/MS/MS技术鉴定杂质结构[13-14],并结合合成工艺及强力降解试验研究杂质来源,旨在为天麻素的工艺优化及质量控制提供参考依据。
1 仪器与试药 1.1 仪器Waters e2695/2998高效液相色谱仪;岛津LC30A液相色谱-AB SCIEX 4500 Q-TRAPTM复合型三重四极杆/线性离子肼串联质谱仪;资生堂CAPCELL PAK C18色谱柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶),Waters Acquity UPLCTM BEH C18色谱柱(2.1 mm×50 mm,1.7 μm;填料:十八烷基硅烷键合硅胶)。Mettler AE-160电子天平;北京永光明DZKW-D-4水浴锅。
1.2 药品与试剂天麻素注射液(2015年国家评价性抽验品种,200批,18家生产企业,典型样品的信息见表 1);天麻素原料药(昆明制药,批号JT20151013;浙江诚意药业,批号0601-2014-12602);天麻素对照品(中国食品药品检定研究院,批号110807-201306,含量96.8%);杂质1(4-醛基苯基-β-D-吡喃葡萄糖苷,委托昆明制药合成,纯度>98.0%);乙腈为HPLC级,对羟基苯甲醇、磷酸、盐酸、氢氧化钠和高锰酸钾为分析纯,水为自制纯化水。
|
|
表 1 典型样品的样品信息表 Table 1 Information of typical samples |
采用资生堂CAPCELL PAK C18色谱柱(4.6 mm×250 mm,5 μm),柱温30 ℃,以乙腈-0.1%磷酸水溶液(3:97)为流动相,流速1.0 mL·min-1,检测波长220 nm,进样量10 μL。
2.2 Q-TRAP LC/MS/MS条件色谱条件:采用Acquity UPLCTM BEH C18色谱柱(2.1 mm×50 mm,1.7 μm),柱温30℃,以乙腈-0.005 mol·L-1醋酸铵溶液(2:98)为流动相,流速0.25 mL·min-1,检测波长220 nm,进样量3 μL。
Q-TRAP质谱条件:采用负离子采集模式,多反应监测扫描模式,碰撞电压45 V;采用正离子采集模式,单离子监测扫描模式,碰撞电压45 V;电喷雾离子源(ESI);线性离子肼扫描范围m/z 50~600;温度550 ℃,GAS1/2 379 kPa,喷雾电压5.5~4.5 kV。
2.3 供试品溶液的制备取天麻素注射液样品适量,加水稀释制成每1 mL中含0.5 mg的溶液,即得。
2.4 对照溶液的制备精密量取供试品溶液1 mL,置100 mL量瓶中,用水稀释至刻度,摇匀,即得。
2.5 强制降解试验本试验考察了酸、碱、高温、氧化4种条件的降解产物。取样品1 mL,置50 mL量瓶中,分别经0.1 mol·L-1盐酸10 mL室温放置24 h,0.1 mol·L-1氢氧化钠10 mL室温放置24 h,直接水浴回流4 h,0.2 mol·L-1高锰酸钾溶液1 mL室温放置20 h破坏,酸碱破坏样品用适量0.1 mol·L-1盐酸或0.1 mol·L-1氢氧化钠中和,各破坏后的溶液用水稀释至刻度,摇匀,按“2.1”项下色谱条件分析,同时进行空白试验。酸、碱及氧化降解色谱图见图 2,由图看出,在该色谱条件下,各降解产物及天麻素主峰之间均能有效分离。
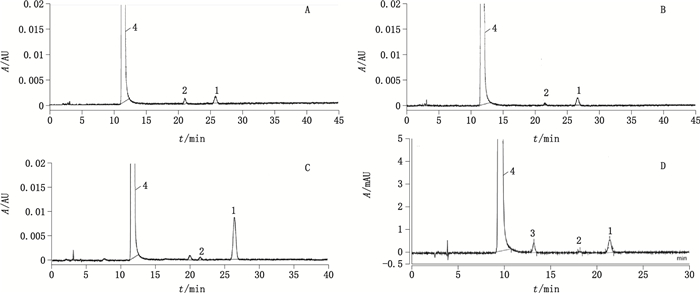
|
1.杂质1(impurity 1)2.杂质2(impurity 2)3.杂质3(impurity 3)4.天麻素(gastrodin) A.酸破坏(destroyed by acid)B.碱破坏(destroyed by alkali)C.氧化破坏(destroyed by oxidation)D.天麻素注射液样品(sample of gastrodin injection) 图 2 降解试验HPLC色谱图 Figure 2 HPLC chromatograms of degradation tests |
采用“2.1”项下HPLC色谱条件对18家企业的200件样品及2家企业的原料药进行测定,测得供试品溶液的高效液相色谱图。共检出3种杂质(杂质1、杂质2、杂质3),结果见表 2,典型色谱图见图 2。分析各杂质的检出结果,杂质1在所有企业的样品及2家企业的原料药中均检出,且为最大单杂,有25批次的检出量为0.2%及以上,杂质2和杂质3在部分企业的样品中检出,杂质3在浙江诚意药业的原料药中检出。
|
|
表 2 天麻素注射液有关物质测定结果 Table 2 Detection results of the related substances in gastrodin injection |
采用“2.2”项下Q-TRAP LC/MS/MS条件分析,典型色谱图见图 3,杂质1的质谱图见图 4,杂质3的质谱图见图 5。
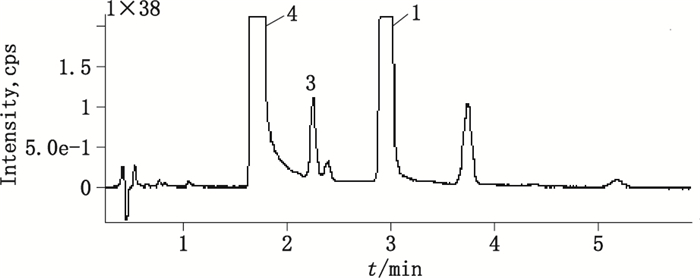
|
1.杂质1(impurity 1)3.杂质3(impurity 3) 4.天麻素(gastrodin) 图 3 天麻素注射液LC/MS/MS总离子流图 Figure 3 TIC profile of gastrodin injection |
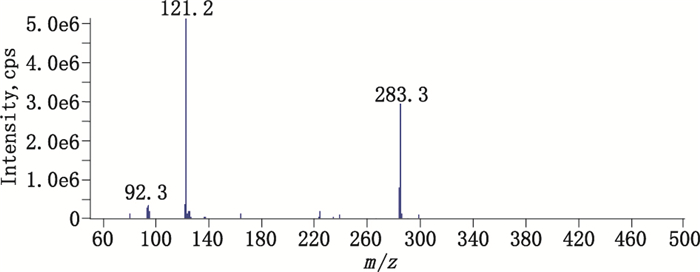
|
图 4 杂质1的二级质谱图 Figure 4 MS/MS spectrum of the impurity 1 |
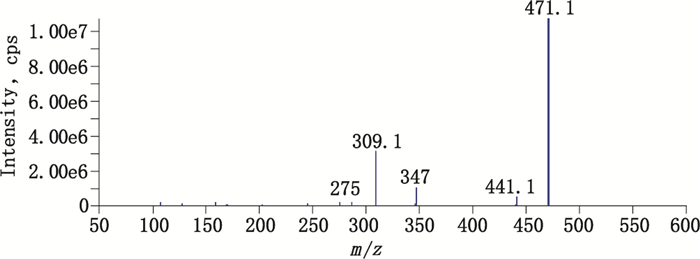
|
图 5 杂质3的二级质谱图 Figure 5 MS/MS spectrum of the impurity 3 |
采用Q-TRAP LC/MS/MS技术得到相对分子质量和二级质谱碎片信息,结合杂质的产生途径,根据化合物的一般裂解规律,推测化学结构。各杂质的分析结果见表 3。
|
|
表 3 天麻素注射液杂质的质谱特征和推测结构 Table 3 Mass characteristics and proposed chemical structures of impurities in gastrodin injection |
4-醛基苯基-β-D-吡喃葡萄糖苷(杂质1):在相对保留时间2.25处测得。杂质1在氧化条件下随氧化时间延长而不断增大,说明其为氧化降解杂质,杂质1在2家企业的原料药及所有样品中均有检出,判断其也为合成工艺杂质。应用Q-TRAP LC/MS/MS技术进行分析,负离子模式下,一级全扫描测得准分子离子[M-H]-m/z为283.3,比天麻素对照品分子离子峰[M-H]-m/z 285.3少2。二级质谱测得的主要碎片离子m/z 121.2为[M-H-162]-,162为1个六碳糖分子,碎片离子m/z 121.2与对羟基苯甲醛的特征碎片离子吻合,因此确证杂质1即为4-醛基苯基-β-D-吡喃葡萄糖苷,其分子式C13H16O7,相对分子质量284.3。质谱图见图 4。
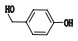
对羟基苯甲醇(杂质2):在相对保留时间1.91处测得。杂质2在酸碱条件下产生,并随水解时间延长而不断增多,说明其为酸碱水解杂质。查阅中国药典,检索到天麻素相关的杂质有对羟基苯甲醇、对羟基苯甲醛等[15-18],采用HPLC对照比对法,比对出杂质2对应为对羟基苯甲醇,且在3D图上其紫外谱图完全一致;分析天麻素结构是对羟基苯甲醇苷元在酚羟基上连有1个葡萄糖苷的结构,在酸碱水解条件下,天麻素最易水解断裂的一定是酚糖苷键,糖苷键水解断裂生成对羟基苯甲醇苷元,与杂质2为酸碱水解杂质相一致,因此确认杂质2为对羟基苯甲醇,HPLC对照比对试验图谱见图 6。
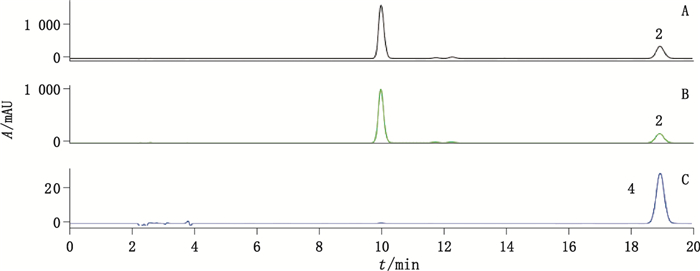
|
2.杂质2(impurity 2)4.对羟基苯甲醇(hydroxybenzyl alcohol) A.酸破坏(destroyed by HCl) B.碱破坏(destroyed by NaOH)C.对羟基苯甲醇对照品(4-hydroxybenzyl alcohol reference standard) 图 6 HPLC对照比对试验谱图 Figure 6 HPLC chromatograms of comparison test |
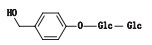
4-羟甲基苯基-二元糖苷(杂质3):在相对保留时间1.38处测得。杂质3在破坏降解溶液中未见增加,在浙江诚意药业的原料药及部分制剂中检出,说明其为合成工艺杂质。应用Q-TRAP LC/MS/MS技术进行分析,负离子模式下,一级全扫描测得准分子离子[M-H]- m/z为447.2,正离子模式下,准分子离子[M+Na]+ m/z为471.1。二级质谱的主要碎片离子m/z 309.1为[M+Na-162]+,162是1个六碳糖分子,碎片离子m/z 309.1恰与天麻素加钠离子(286+23)一致,因此初步判断结构为天麻素结构上再加1个六碳糖;碎片离子m/z 347.0为[M+Na-124]+峰,124与天麻素苷元对羟基苯甲醇(C7H8O2)苷元特征离子一致;碎片离子m/z 441.1为[M+Na-30]+峰,30是1个水分子(H2O),丢失1个水分子说明苷元上有1个羟基。综上,判断结构是对羟基苯甲醇苷元在酚羟基上连有1个二糖的糖苷。质谱图见图 5。
2.7 杂质1的校正因子测定采用斜率比法对杂质1的校正因子进行测定。取天麻素对照品适量,精密称定,加水溶解并稀释制成每1 mL中含43.79、87.58、131.37、175.16、218.95、262.74、306.53 μg的溶液;取杂质1适量,精密称定,加水溶解并稀释制成每1 mL中含2.87、4.78、23.91、38.26、119.55、239.10、478.20 μg的溶液。分别取上述溶液,按“2.1”项下色谱条件分析,以峰面积Y为纵坐标,对浓度X进行线性回归,天麻素、杂质1的线性方程:
| $ \begin{gathered} Y = 2.03 \times {10^7}X - 5.68 \times {10^4}\;\;\;\;r = 1.000 \hfill \\ Y = 2.11 \times {10^7}X - 5.03 \times {10^3}\;\;\;\;r = 1.000 \hfill \\ \end{gathered} $ |
天麻素及杂质1的线性关系均良好。根据线性方程斜率计算得杂质1的校正因子为1.04,因此可以采用不加校正因子的主成分自身对照法计算杂质1的含量。
2.8 讨论本研究依据现行中国药典标准检验有关物质,对天麻素注射液及其原料的杂质进行检测分析,并结合Q-TRAP LC/MS/MS技术及强制降解试验对检出的3种杂质进行结构鉴定及来源归属。其中杂质1和杂质3都为合成工艺杂质,杂质1在所有样品中检出,其校正因子为1.04,杂质3在浙江诚意药业的原料药及部分制剂中检出,说明杂质3是浙江诚意药业原料药合成工艺的特有杂质。杂质2为酸碱降解杂质,在原料药中未检出,仅在少量样品中微量检出,因此该制剂在生产使用过程中应控制pH。本研究为天麻素合成工艺优化及其制剂质量控制提供了参考依据。
| [1] |
JU XH, SHI Y, LIU N, et al. Determination and pharmacokinetics of gastrodin in human plasma by HPLC coupled with photodiode array detector[J]. J. Chromatogr B, 2010, 878(22): 1982. DOI:10.1016/j.jchromb.2010.05.034 |
| [2] |
徐顶巧, 周建军, 刘益红. 天麻中天麻素提取检测方法研究[J]. 中药材, 2012, 35(11): 1799. XU DQ, ZHOU JJ, LIU YH. Research the extraction and detection method of gastrodin content in Gastrodin elata[J]. J Chin Med Mater, 2012, 35(11): 1799. |
| [3] |
李海燕, 郑萍, 谢笑天. 合成天麻中微量二组分的分离和鉴定[J]. 中国新药杂志, 2006, 15(15): 1478. LI HY, ZHENG P, XIE XT. Isolation and identification of two components in the synthetic agent gastrodin[J]. Chin J New Drugs, 2006, 15(15): 1478. |
| [4] |
袁胜浩, 王东, 张香兰. 天麻中天麻素含量的影响因子研究[J]. 云南植物研究, 2008, 30(1): 110. YUAN SH, WANG D, ZHANG XL, et al. The influencing factors on content in the herbal materials of Gastrodia elata[J]. Acta Bot Yunnan, 2008, 30(1): 110. |
| [5] |
国家药品标准: 化学药品地方标准上升国家标准. 第16册[S]. 2001: 214 National Drug Standard:National Standards for Chemicals Promoted from Local Standards. Vol 16[S]. 2001:214 |
| [6] |
WS1-XG-023-2001-2014国家药品标准[S]. 2014 WS1-XG-023-2001-2014 National Drug Standard[S]. 2014 |
| [7] |
刘辉, 张婧, 樊光辉, 等. HPLC法测定天麻素缓释片中天麻素的含量[J]. 中国药师, 2013, 16(6): 825. LIU H, ZHANG J, FAN GH, et al. Determination of gastrodin in Tianmasu sustained release tablets by HPLC[J]. China Pharm, 2013, 16(6): 825. |
| [8] |
金少鸿, 粟晓黎. 基于QbD理念的药品质量分析研究新概念[J]. 药物分析杂志, 2011, 31(10): 1845. JIN SH, SU XL. A new concept of drug quality surveillance based on quality by design[J]. Chin J Pharm Anal, 2011, 31(10): 1845. |
| [9] |
蔡鹏俊, 李悦. 几种沙坦类药物的杂质谱研究现状[J]. 药物分析杂志, 2016, 36(3): 377. CAI PJ, LI Y. Research progress of sartans' impurity profile[J]. Chin J Pharm Anal, 2016, 36(3): 377. |
| [10] |
黄婧, 吴宏伟, 李玲玲. 依诺沙星制剂有关物质的研究[J]. 药物分析杂志, 2016, 36(2): 330. HUANG J, WU HW, LI LL. Study on related substances in enoxacin preparations[J]. Chin J Pharm Anal, 2016, 36(2): 330. |
| [11] |
康铁纯, 顾宵, 何佳佳, 等. RP-HPLC测定卡维地洛片中的杂质D和E[J]. 药物分析杂志, 2015, 35(10): 1838. KNG TC, GU X, HE JJ, et al. Determination of impurities D and E of carvedilol tablets by RP-HPLC[J]. Chin J Pharm Anal, 2015, 35(10): 1838. |
| [12] |
闻洪亮, 裘亚, 张含智, 等. 注射用氯唑西林钠的杂质谱研究[J]. 中国药学杂志, 2016, 51(6): 488. WEN HL, QIU Y, ZHANG HZ, et al. Impurity profile study of cloxacillin sodium for injection[J]. Chin Pharm J, 2016, 51(6): 488. |
| [13] |
SHAW LH, LIN LC, TSAI TH. HPLC-MS/MS analysis of a traditional Chinese medical formulation of Bu-Yang-Huan-WuTang and its pharmacokinetics after oral administration to rats[J]. PLoS One, 2012, 7(8): 1. |
| [14] |
董晓燕, 陶玮彦, 刘孟, 等. 基于LC-MS/MS法的盐酸肼屈嗪片有关物质研究[J]. 药物分析杂志, 2016, 36(1): 155. DONG XY, TAO WY, LIU M, et al. Study on the related substances in hydralazine hydrochloride tablets by LC-MS/MS[J]. Chin J Pharm Anal, 2016, 36(1): 155. |
| [15] |
中国药典2015年版. 一部[S]. 2015: 58 ChP 2015. Vol Ⅰ[S]. 2015:58 |
| [16] |
ZHANG W, SHENG YX, ZHANG JL. Determination and pharmacokinetics of gastrodin and p-hydroxybenzylalcohol after oral administration of Gastrodia elata Bl. extract in rats by highperformance liquid chromatography-electrospray ionization mass spectrometric method[J]. Phytomedicine, 2008, 15(10): 844. DOI:10.1016/j.phymed.2008.02.012 |
| [17] |
LIN LC, CHEN YF, LEE WC, et al. Pharmacokinetics of gastrodin and its metabolite p-hydroxybenzyl alcohol in rat blood, brain and bile by microdialysis coupled to LC-MS/MS[J]. J Pharm Biomed Anal, 2008, 48(3): 909. DOI:10.1016/j.jpba.2008.07.013 |
| [18] |
ZHANG HF, HE GQ, LIU J, et al. Production of gastrodin through biotransformation of p-2-hydroxybenzyl alcohol by cultured cells of Armillaria luteo-virens Sacc[J]. Enzyme Microb Technol, 2008, 43(1): 25. DOI:10.1016/j.enzmictec.2008.03.007 |
 2017, Vol. 37
2017, Vol. 37