2. 包头市第四医院药剂科, 包头 014100
2. Department of Pharmacy, Baotou Fourth Hospital in Inner Mongolia, Baotou 014100, China
衰老是生命进程中正常而又复杂的生理过程。一般情况下机体中枢神经递质的分泌维持在一定的水平,相互间比例协调,但随着机体的老化,会出现学习记忆能力的下降,同时脑内神经递质的代谢亦发生紊乱,出现多巴胺、去甲肾上腺素以及谷氨酸的含量下降,故改善中枢神经递质的代谢可显著弥补或扭转学习记忆的障碍[1]。研究表明,学习记忆过程与多巴胺能神经元通路对海马的神经调控有着密切的关系。海马的突触可塑性在诱导形成LTP过程中起着重要作用已得到公认[2],这一点已通过破坏多巴胺能神经递质释放而影响到记忆测试动物的LTP证实。在老年动物中,多巴胺激动剂能够增强海马依赖的学习能力,另外,破坏多巴胺通路能够削弱处理空间信息的能力。去甲肾上腺素神经系统介导情感相关研究[3],如大鼠在条件性缺失去甲肾上腺素受体和肾上腺素受体的行为学测试中表现出学习记忆下降的现象,以及对比使用肾上腺素受体拮抗剂和激动剂的大鼠对于学习记忆影响的实验中,均验证了去甲肾上腺素对于记忆功能的影响[4]。发现肾上腺素信号对修复中期前后关系和空间记忆至关重要。谷氨酸是哺乳动物脑内含量最高的一种氨基酸,并作为主要的中枢兴奋性氨基酸递质介导一系列高级神经活动[5],研究表明,脑内注射其受体激动剂具有促进记忆作用。谷氨酰胺作为脑内谷氨酸代谢的前体物质,可能通过谷氨酸递质系统对脑功能发挥调节作用[6]。去甲肾上腺素在记忆保持方面起重要作用,而改善记忆与促进多巴胺释放作用有关,谷氨酸则有关参与蛋白质、多肽及脂肪酸的合成[7]。
有些神经递质如多巴胺、去甲肾上腺素属儿茶酚胺类神经递质,对光、温度相对敏感,化学稳定性一般,在水溶液、胃肠道和血液中均有水解;谷氨酸在紫外无吸收,多数情况在运用高效液相等手段测定时需进行柱前和柱后衍生,往往因衍生结果不理想导致测定结果存在很大误差。因此,检测方法具有一定的选择性和灵敏度,同时具备快速、简便的样品处理方法,是进行快速、准确地定量的重要条件。Q Exactive是近几年推出的新型四极杆和轨道阱杂交高分辨质谱仪,能进行高通量的目标物或非目标物筛选,实现高可靠性的确证和定量分析,Q Exactive性能高、稳定性好和可操作性为前沿研究和常规检测提供更加可靠的分析结果[8]。大量研究证明,肉苁蓉多糖具有增强记忆力及延缓衰老的功效,可明显改善东莨菪碱所致学习记忆功能下降小鼠的行为学表现[9],而学习记忆功能本身与脑内多种神经递质的释放量明显相关[10]。本研究建立超高效液相色谱-高分辨质谱(UPLC/Q Exactive MS)法,给予PC12细胞肉苁蓉多糖(CDPS)促神经递质释放,可同时检测多巴胺、去甲肾上腺素以及谷氨酸的含量,为临床的诊断和预防奠定基础。
1 材料 1.1 主要仪器及试剂Q Exactive四极杆-静电场轨道阱高分辨质谱系统及Dionex UltiMate 3000快速超高效液相色谱系统(Thermo-Fisher公司);WH-1微型旋涡混合器(上海沪西分析仪器厂);台式高速冷冻离心机(SIGMA,3-18K,德国CHRIST公司);AG-245分析天平(美国Mettler Toledo公司);恒温水浴锅(HH-6国华电器有限公司);细胞培养箱(HERA cell 150i CO2 incubator Thermo公司);Eppendorf艾本德5-100UL 12道电动移液枪。色谱柱为Hypersil Gold(球形高纯碱灭活硅胶填料;100 mm×2.1 mm,1.9 μm,美国Thermo-Fisher公司,货号25002-102130)。预柱为Hypersil Gold Drop-in(球形高纯碱灭活硅胶填料;10mm×3 μm,美国Thermo-Fisher公司)。
多巴胺(批号:110797-201108)、去甲肾上腺素(批号:110798-201307)、谷氨酸(批号:110798-120515)对照品购自中国食品药品检定研究院。乙腈为质谱纯(北京众诚达科技有限公司,LC230-1);醋酸铵(Sigma-Aldrich,86835-25G)、甲酸(Fisher,每瓶500 mL)为色谱纯;DMEM培养基(Gbico,货号:11995065);磷酸盐缓冲液(PBS):称取NaCl 8 g、KCl 0.2 g、Na2HPO4 1.44 g和KH2PO4 0.24 g, 溶于800 mL蒸馏水中, 用HCl调节溶液pH至7.4, 最后加蒸馏水定容至1 000 mL;其他试剂均为分析纯;实验用水为去离子水。
1.2 细胞所用PC12细胞株(中国医学科学药物研究所陈乃宏教授提供)是大鼠肾上腺髓质嗜铬瘤分化细胞株,具有神经内分泌细胞的一般特征。接种在体积分数为10%胎牛血清,5%马血清DMEM培养基,100 U·mL-1青霉素和100 U·mL-1链霉素(双抗)。培养条件为PC12细胞株培养于DMEM培养基,于37 ℃、体积分数为5%的CO2培养箱中培养2~4 d,用吹打管吹打细胞,进行1:3传代,取对数生长期细胞接种到六孔板中,当细胞密度达到3×105个·mL-1时进行实验。
实验中需要在显微镜下观察PC12细胞的一些形态特征,只有分化的PC12细胞才有神经细胞的形态,才能表达突触蛋白。绝大多数哺乳类胚胎神经元对生长因子有严格的营养要求,若不提供适宜的生长因子,大多数神经元细胞在体外培养的数天中死亡。因此,在培养过程中需要在培养基内加入神经生长因子NGF(0.6 ng/单位)诱导PC12细胞,以满足神经元营养需求以及高分化要求。
2 方法 2.1 色谱条件色谱柱为Hypersil Gold(球形高纯碱灭活硅胶;100 mm×2.1 mm,1.9 μm),预柱为Hypersil Gold Drop-in(球形高纯碱灭活硅胶;10 mm×3 μm);流动相为乙腈-水(0.1%甲酸,10 mmol·L-1醋酸铵)(4:96);流速为0.2 mL·min-1;柱温为30 ℃;进样量为5 μL。
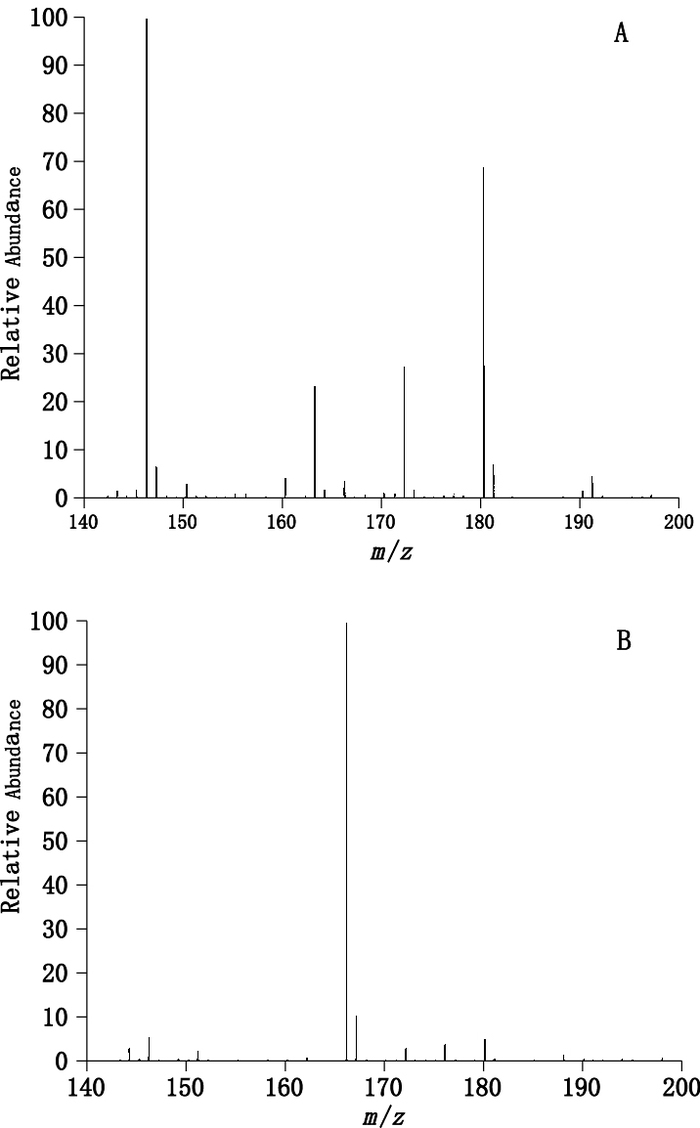
2.2 质谱条件考察发现3种神经递质在正离子模式下具有较强的信号,并且检测条件下基线噪音较小,因此最终选择ESI电离源下的正离子扫描模式。电喷雾离子化源(ESI)温度为350 ℃;毛细管电压为3.5 kV;离子传输管温度为200 ℃;鞘气压为4 000 kPa;辅助气压为333 kPa。扫描模式为Full MS/SIM;采集质量范围为140~200 Da,采用正离子检测模式;一级质谱分辨率(R)70 000 FWHM。选择离子检测(SIM):m/z 154.08(多巴胺),m/z 170.08(去甲肾上腺素),m/z 148.05(谷氨酸)。将质荷比与待测物离子峰相对丰度作图(图 1)。可见,图 1-A为3种神经递质正离子模式的响应图,形成[M+H]+分子离子峰;图 1-B为负离子模式,可见3种神经递质无响应。
|
A.正离子模式响应图(positive ion mode response diagram)B.负离子模式响应图(negative ion mode response diagram) 图 1 多巴胺、去甲肾上腺素及谷氨酸的质谱图 Figure 1 Mass spectra of dopamine, norepinephrine and glutamate |
分别精密称取多巴胺、谷氨酸的对照品各1 mg,去甲肾上腺素1 mL,置于3个50 mL量瓶内,以超纯水定容,配制20 μg·mL-1对照品储备液,锡纸包好4 ℃避光保存备用,使用时逐级稀释至所需浓度。称取肉苁蓉多糖(本实验室制备和提取,纯度>90%)提取纯化物0.001 g,加入去离子水1 mL,配成1 mg·mL-1原液,微孔滤膜过滤后4 ℃保存,使用时用培养基稀释到所需浓度。
2.4 待测样品提取 2.4.1 给药CDPS组取对数生长期细胞,以3×105个·mL-1密度接种于6孔板中,细胞生长48 h,弃去培养基,用PBS清洗3遍,弃去PBS。将6孔板置于37 ℃水浴锅内,在孔内加入用无谷氨酸培养基配制的药物CDPS 200 μg·mL-1,分别刺激细胞,在10、30 s及1、3、4、5、6、7、9、15、20、30、50、60 min时间点用移液枪吸入2 mL离心管内(各时间点设置2个复孔),得到CDPS待测样品。
2.4.2 细胞样组同样将3×105个·mL-1密度的PC12细胞接种于6孔板中,生长48 h,PBS清洗后于37 ℃水浴锅内加入无谷氨酸培养基,同上述过程一样,于各时间点吸出,得到细胞培养基待测样品。
2.5 待测样品的处理将待测样品用封口膜封好后,放入离心机10 000 r·min-1(4 ℃),离心10 min取出,沉淀蛋白,避免进入LC/MS堵住喷雾针及污染仪器,将上清液用2 mL针管轻轻吸出,0.22 μm微孔滤膜过滤置自动进样器样品瓶中,设定5 μL进样检测3种神经递质的释放量。
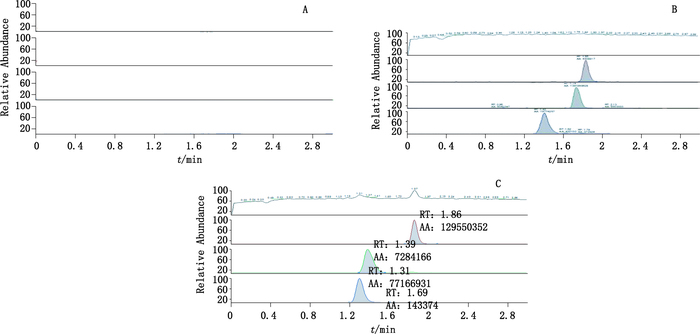
3 结果 3.1 方法的专属性考察通过对空白培养基、向空白培养基中加入3种神经递质标准品和样品处理样本,以干扰物的分离程度对本检测方法进行了专属性考察。在本实验的样品处理和检测条件下,空白培养基、向空白培养基中加入3种神经递质对照品和PC12细胞中加入空白培养基(细胞样)的图谱中,多巴胺、去甲肾上腺素和谷氨酸无明显杂峰干扰。保留时间分别为1.86 min(多巴胺)、1.39 min(去甲肾上腺素)、1.31 min(谷氨酸)(内标),如图 2所示。
|
A.空白培养基(blank medium)B.空白培养基中加入多巴胺、去甲肾上腺素、谷氨酸对照品溶液(blank medium containing reference solution of dopamine,norepinephrine,glutamate)C.作用于PC12细胞后的培养基(medium after incubation of PC12 cells) 图 2 3种神经递质选择性质子流色谱图 Figure 2 Selective proton flow chromatograms of three neurotransmitters |
照“2.3”项下方法配制对照品溶液,使多巴胺、去甲肾上腺素、谷氨酸终质量浓度均为3、10、25、50、100、300、500、1 000、2 000 ng·mL-1,进行UPLC/Q-Exactive MS检测,进行线性回归,求得的线性方程即为多巴胺、去甲肾上腺素、谷氨酸标准曲线。见表 1。结果表明多巴胺、谷氨酸在3~2 000 ng·mL-1范围内线性关系良好,最低定量浓度为3 ng·mL-1。去甲肾上腺素在100~2 000 ng·mL-1范围内线性关系良好,最低定量浓度为100 ng·mL-1。
|
|
表 1 多巴胺、去甲肾上腺素以及谷氨酸标准曲线回归方程 Table 1 Regression equation of standard curve of dopamine, norepinephrine and glutamate |
取装有1 mL空白培养基的2 mL EP管若干,准确向其中加入一定量的多巴胺、去甲肾上腺素、谷氨酸对照品溶液,使多巴胺、去甲肾上腺素、谷氨酸终质量浓度为100 μg·L-1,样品平行6份。结果见表 2。如表 2所示,精密度结果RSD均小于5%,测定方法精密度符合生物样本含量测定要求。
|
|
表 2 多巴胺、去甲肾上腺素以及谷氨酸精密度实验结果(n=6) Table 2 Precision results of dopamine, norepinephrine and glutamate |
分别取同一时间点3份已知各神经递质浓度的细胞样品各200 μL,分别加入高、中、低3种浓度[11]的3种神经递质的混合对照品溶液,按样品处理方法处理后进样测定,得到3种神经递质的峰面积,代入标准曲线方程求其浓度,计算所得浓度和细胞样的差值与加入混标浓度的比值即为加标回收率。结果见 表 3。多巴胺、去甲肾上腺素和谷氨酸加标回收率大于90%,RSD均小于5%,符合生物样本定量分析的要求。
|
|
表 3 多巴胺、去甲肾上腺素以及谷氨酸加标回收率结果 Table 3 Recovery of standard addition results of dopamine, norepinephrine and glutamate |
取空白培养基1 mL加入2 mL EP管中,准确加入一定量的多巴胺、去甲肾上腺素和谷氨酸对照品溶液,使多巴胺、去甲肾上腺素和谷氨酸最终质量浓度分别为100 ng·mL-1。分成9份。考察室温放置8 h、4 ℃保存1周及-20 ℃保存1个月的稳定性,分别按“2.5”项下方法处理后进样检测,结果见表 6。结果表明,3种神经递质生物样本室温放置8 h,4 ℃保存一周及-20 ℃保存一个月的样品均稳定,在3种环境下保存均不会影响含量测定。
|
|
表 4 多巴胺、去甲肾上腺素以及谷氨酸稳定性结果(ng·mL-1,x±s,n=5) Table 4 Stability test results of dopamine, norepinephrine and glutamate |
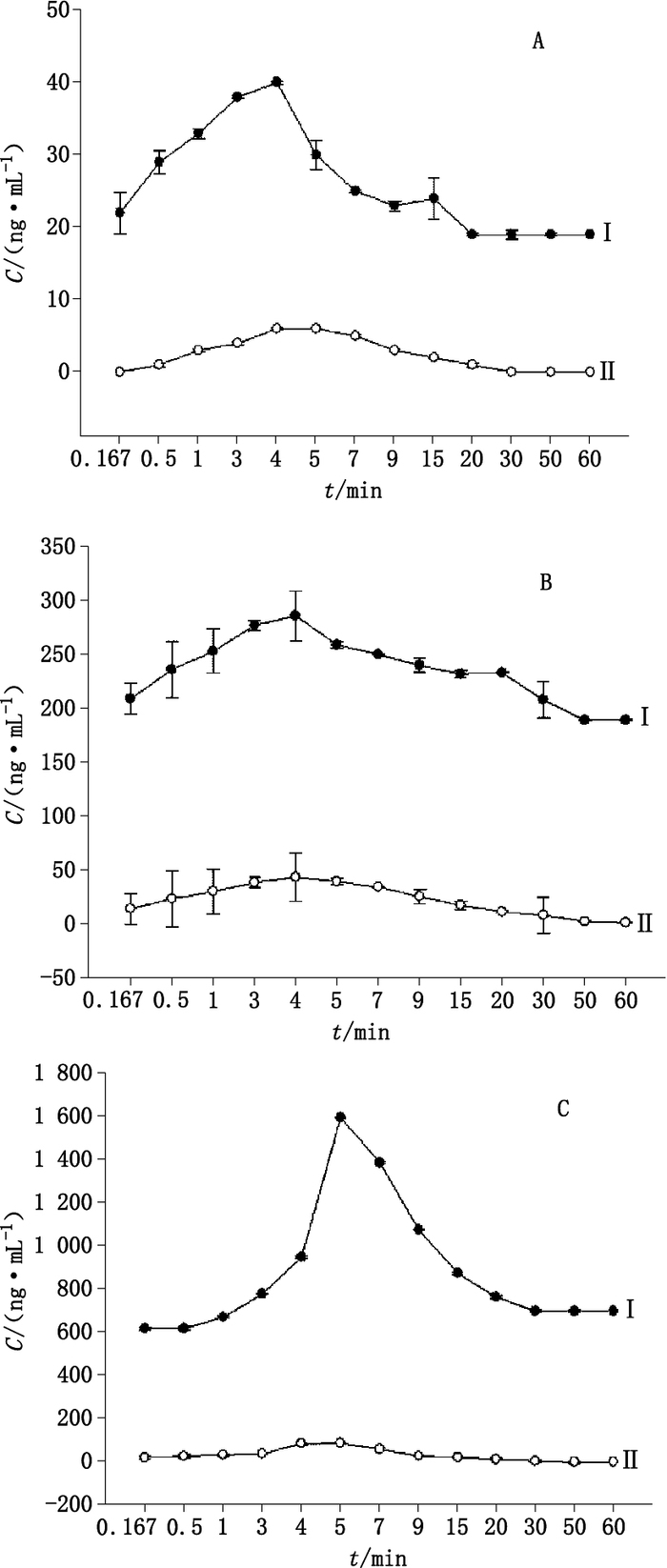
基于前期对CDPS的体内实验研究,发现其对学习记忆能力具有一定的保护作用。学习记忆功能是大脑的一项重要神经功能,作用机制与神经递质的释放密切相关。PC12细胞是目前较常用于神经系统疾病体外研究的细胞,给予CDPS 150 μg·mL-1后,其对PC12细胞3种神经递质释放的影响如图 3所示。从图 3中可见,与空白组(细胞样组)相比,给药组3种神经递质释放量明显增加,约为空白组的6倍左右,并且在3~5 min左右达到释放峰值,之后随着时间的增加释放量逐渐降低。
|
Ⅰ. CDPS组(CDPS greup)Ⅱ.空白组(blank group) 图 3 CDPS对多巴胺(A)、去甲肾上腺素(B)、谷氨酸(C)神经递质释放量影响的示意图 Figure 3 Effect of CDPS on dopamine(A), norepinephrine(B)and glutamate(C)release |
本实验采用UPLC/Q Exactive MS检测技术,建立了对PC12细胞分泌的多巴胺、去甲肾上腺素以及谷氨酸的定量检测方法。其通过高分辨质谱的Full MS/SIM扫描模式快速进行定性筛查和准确定量检测,与三重四极杆质谱相比,有效地简化了质谱参数的优化。对目标化合物同时进行选择性离子检测,空白培养基无杂质干扰。该方法的灵敏度高,3种神经递质线性范围宽,线性关系良好;加标回收率高,3种物质的精密度RSD均小于10%,适用于从细胞水平,探讨神经递质的变化。
目前,测定神经递质较常用的方法有电化学分析法[12]、放射酶学法[13]、毛细管电泳法[14]、高效液相色谱法[15-17]。电化学分析法测定生物样品的稳定性较差,且修饰电极的使用寿命短,灵敏度不高;放射酶学法技术难度高,检测速度慢;毛细管电泳法的重复性较差,不适用于生物样品测定;高效液相色谱法测定过程比较烦琐,需要对部分在紫外无吸收的氨基酸类神经递质进行柱前和柱后衍生,这会在很大程度上影响实验进度[18],并且衍生的过程难以掌控,这就使
得衍生反应有可能衍生出非目标衍生物[19],这些都会给神经递质的准确测定带来很大的影响。随着药物定性定量研究的不断深入,具有高分辨率、高灵敏度、高采集速度,样品处理简单等特点的超高效液相色谱-质谱联用系统的分析技术成为近年来发展较快的分析手段。在液-质联用(UPLC/Q Exactive MS)系统中,UPLC不仅是分离系统,也是Q Exactive MS的进样系统[20],色谱流动相不仅应根据样品分子结
构进行选择使其得以有效分离,还要符合质谱系统中电喷雾离子化(ESI)的要求。而适用于ESI的溶剂应该具备下列特点:能使样品在溶液中形成离子;有利于离子蒸发;较低的粘度和表面张力以利于雾化[21]。根据相关文献对流动相组成的报道,本研究先后试过乙腈-水、甲醇-水磷酸盐缓冲液及甲醇-水-三乙胺-甲酸等系统。用乙腈-水作为流动相,无法使待测药物与相邻杂质很好的分离;甲醇-水-磷酸盐缓冲液作为流动相,杂质响应值增强;乙腈-水中加入少量醋酸胺和甲酸后,可以完全排除内源性杂质对多巴胺、去甲肾上腺素以及谷氨酸的干扰,通过调整醋酸铵和甲酸的比例,可以改变目标物的色谱行为,且醋酸铵具有扫尾功效,峰形得到改善[22-25]。故最终选用的流动相系统为乙腈-水(0.1%甲酸,10 mmol·L-1)(4:96),待测神经递质和杂质可以得到良好的分离,流动相性质相对稳定,可以满足试验需要。
综上所述,本课题组采用液-质联用(UPLC/Q Exactive MS)的方法,结合前期肉苁蓉改善学习记忆方面的体内研究[26-27],在PC12细胞的基础上测定多巴胺、去甲肾上腺素、谷氨酸3种神经递质释放量,结果与前期结论一致。本文建立的针对PC12细胞中3种神经递质含量的测定方法具有快速、高效和灵敏性度高等特点,适用于生物体外相关神经递质的含量测定。
| [1] |
陈志宏, 高福禄, 庞晓静. 中药天年饮对衰老大鼠学习记忆及脑单胺类神经递质含量的影响[J]. 时珍国医国药, 2006, 17(1): 7. CHEN ZH, GAO FL, PANG XJ. Effects of traditional Chinese medicine Tiannianyin learning memory and monoamine neurotransmitter contents in brain of aging rats[J]. Lishizhen Med Mater Med Res, 2006, 17(1): 7. |
| [2] |
陈晶, 陈燕惠. 高压氧对缺氧缺血性脑损伤大鼠海马突触超微结构及突触素表达的影响[J]. 中华儿科杂志, 2010, 48(3): 199. CHEN J, CHEN YH. Effect of synaptic ultrastructure and synaptophysin expression in hippocampus of rats with hyperbaric oxygen on hypoxic ischemic brain damage[J]. Chin J Pediat, 2010, 48(3): 199. |
| [3] |
张中启, 罗质璞. 学习记忆的胆碱能机制与去甲肾上腺素能和5-羟色胺能介质系统的关系[J]. 中国药理学通报, 1994(2): 81. ZHANG ZQ, LUO ZP. The cholinergic mechanism of learning and memory and the relationship between norepinephrine and 5-HT[J]. Chin Pharmacol Bull, 1994(2): 81. |
| [4] |
赵靖平. 新型去甲肾上腺素能与特异性5-羟色胺能抗抑郁药米氮平[J]. 中华精神科杂志, 2002, 35(4): 253. ZHAO JP. Novel noradrenergic and specific 5-HT serotonergic antidepressant mirtazapine[J]. Chin J Psychiat, 2002, 35(4): 253. |
| [5] |
宋文婷, 徐立, 刘建勋. 脑缺血后谷氨酸及其受体介导的神经细胞损伤及相关药物研究进展[J]. 中国药理学通报, 2012, 28(6): 747. SONG WT, XU L, LIU JX. Research progress in glutamate and its receptor mediated neuronal injury after cerebral ischemia and related drugs[J]. Chin Pharmacol Bull, 2012, 28(6): 747. |
| [6] |
赵永才, 吴耿安, 黄亨奋. 运动与记忆:N-甲基-D-天冬氨酸受体和谷氨酸在学习记忆中的作用[J]. 中国临床康复, 2005, 9(37): 101. ZHAO YC, WU GA, HUANG HF. Exercise and memory:the role of N-methyl-D-aspartate receptor and glutamate in learning and memory[J]. Chin J Clin Rehabilit, 2005, 9(37): 101. DOI:10.3321/j.issn:1673-8225.2005.37.071 |
| [7] |
李新田, 杨来启, 林昱. 芪参复康胶囊对衰老模型小鼠单胺类神经递质的影响[J]. 华西药学杂志, 2008, 23(6): 646. LI XT, YANG LQ, LIN Y. Effects of Shenqi Fukang capsule on monoamine neurotransmitter in aging model mice[J]. West China J Pharm, 2008, 23(6): 646. |
| [8] |
MICHALSKI A, DAMOC E, HAUSCHILD JP, et al. Mass spectrometrybased proteomics using q exactive, a high-performance benchtop quadrupole orbitrap mass spectrometer[J]. Mol Cell Proteomics, 2011, 10(9): M111. 011015. DOI:10.1074/mcp.M111.011015 |
| [9] |
尹若曦, 李刚, 俞腾飞. 肉苁蓉多糖对东莨菪碱所致学习记忆障碍模型小鼠在突触可塑性方面的保护作用[J]. 中国药理学通报, 2014, 30(6): 801. YIN RX, LI G, YU TF. Protective effect of Cistanche deserticola polysaccharide on synaptic plasticity in mice with learning and memory impairment induced by scopolamine[J]. Chin Pharmacol Bull, 2014, 30(6): 801. |
| [10] |
NG J, PAPANDREOU A, HEALES SJ, et al. Monoamine neurotransmitter disorders——clinical advances and future perspectives[J]. Nat Rev Neurol, 2015, 11(10): 567. |
| [11] |
中国药典2015版. 一部[S]. 2015: 442 ChP 2015. Vol Ⅰ[S]. 2015:442 |
| [12] |
CHEN HJ, HOU WC, LIU JS, et al. Molecular cloning and characterization of a cDNA encoding asparaginyl endopeptidase from sweet potato(Ipomoea batatas(L.)Lam)senescent leav[J]. J Exp Bot, 2004, 55(398): 825. DOI:10.1093/jxb/erh095 |
| [13] |
石一鸣. 儿茶酚胺酶促放射测定法[J]. 第二军医大学学报, 1989(6): 567. SHI YM. Catecholamine stimulated emission spectrometry[J]. J Sec Milit Med Univ, 1989(6): 567. |
| [14] |
CHEN HJ, HOU WC, LIU JS, et al. Molecular cloning and characterization of a cDNA encoding asparaginyl endopeptidase from sweet potato(Ipomoea batatas(L.)Lam)senescent leaves[J]. J Exp Bot, 2004, 55(398): 825. DOI:10.1093/jxb/erh095 |
| [15] |
俞军龄, 陈再兴, 毛小元. HPLC法测定tremor大鼠脑组织中谷氨酸和GABA含量[J]. 中国药理学通报, 2009, 25(11): 1530. YU JL, CHEN ZX, MAO XY. Determination of glutamate and GABA in brain tissue of tremor rats by HPLC[J]. Chin Pharmacol Bull, 2009, 25(11): 1530. DOI:10.3321/j.issn:1001-1978.2009.11.031 |
| [16] |
王丽, 宋志峰, 黄璜. HPLC测定不同产地冬虫夏草中氨基酸的含量[J]. 中成药, 2010, 32(6): 984. WANG L, SONG ZF, HUANG H. Determination of amino acids in Cordyceps sinensis from different habitats by HPLC[J]. Chin Patent Med, 2010, 32(6): 984. |
| [17] |
张宇浩, 马昱, 郭曦. 反相高效液相色谱法测定大鼠脑组织中4种氨基酸类神经递质[J]. 中国临床医学, 2012, 19(3): 227. ZHANG YH, MA Y, GUO X. Determination of 4 kinds of amino acid neurotransmitters in brain tissue of rats by reversed phase high performance liquid chromatography[J]. Chin J Clin Med, 2012, 19(3): 227. |
| [18] |
周政华, 杨元, 洪君蓉. 固相萃取-离子色谱-积分脉冲安培法测定人血清中游离氨基酸[J]. 分析化学, 2007, 35(7): 1063. ZHOU ZH, YANG Y, HONG JR. Determination of free amino acids in human serum by solid phase extraction ion chromatography integrated pulsed amperometric detection[J]. Anal Chem, 2007, 35(7): 1063. |
| [19] |
SAGARA K, OSHIMA T, MISAKI T. A simultaneous determination of norephedrine, pseudoephedrine, ephedrine and methylephedrine in Ephedrae Herba and oriental pharmaceutical preparations by ionpair high-performance liquid chromatography[J]. Chem Pharm Bull, 1983, 31(7): 2359. DOI:10.1248/cpb.31.2359 |
| [20] |
马天宇, 布仁, 俞腾飞. UPLC/Q Exactive MS检测家兔血浆中乌头碱、次乌头碱、新乌头碱血药浓度的方法研究[J]. 中药材, 2015(9): 1886. MA TY, BU R, YU TF. Study on Exactive MS method for the determination of aconitine, aconitine and aconitine in rabbit plasma by UPLC/Q[J]. J Chin Med Mater, 2015(9): 1886. |
| [21] |
LIU H, GARRETT T, GU L. Profiling the metabolome changes caused by cranberry proanthocyanidins in female rats using a UPLC-Q exactive-ms based global metabolomics approach[J]. Faseb J, 2015, 29(1): 112. |
| [22] |
邓鸣, 刘会臣, 薛洪源, 等. HPLC-MS法同时测定人血浆中普伐他汀及其主要代谢物3'α-异普伐他汀[J]. 药物分析杂志, 2005, 22(2): 160. DENG M, LIU HC, XUE HY, et al. Simultaneous determination of pravastatin and its major metabolite 3'-alpha-pravastatin in human plasma by HPLC-MS[J]. ChinJ Pharm Anal, 2005, 22(2): 160. |
| [23] |
CHEN DW, GAO J, BING L, et al. Rapid screening and confirmation of pesticide residues in potato by high-resolution benchtop Q exactive LC-MS[J]. Chin J Anal Chem, 2014, 42(4): 579. |
| [24] |
ACEÑA J, PÉREZ S, GARDINALI P, et al. Structure elucidation of phototransformation products of unapproved analogs of the erectile dysfunction drug sildenafil in artificial freshwater with UPLC-Q exactive-MS[J]. J Mass Spectrom, 2014, 49(12): 1279. DOI:10.1002/jms.3461 |
| [25] |
PENG WW, LI W, LI JS, et al. The effects of Rhizoma Zingiberis on pharmacokinetics of six aconitum alkaloids in herb couple of Radix Aconiti Lateralis-Rhizoma Zingiberis[J]. J Ethnopharmacol, 2013, 148(2): 579. DOI:10.1016/j.jep.2013.04.056 |
| [26] |
GAO L, PENG XM, HUO SX, et al. Memory enhancement of acteoside (verbascoside)in a senescent mice model induced by a combination of D-gal and AlCl3[J]. Phytother Res, 2015, 29(8): 1131. DOI:10.1002/ptr.v29.8 |
| [27] |
GAO L, PENG X, HUO S, et al. Acteoside enhances expression of neurotrophin-3 in brain tissues of subacute aging mice induced by D-galactose combined with aluminum trichloride[J]. Chin J Cell Mol Immunol, 2014, 30(10): 1022. |
 2017, Vol. 37
2017, Vol. 37 
