2. 白城市食品药品检验所, 白城 137000
2. Baicheng Institute for Food and Drug Control, Baicheng 137000, China
保心宁片是由丹参、当归和枳壳等干浸膏以及三七药材粉末所制成的中药复方制剂,具有活血化瘀、行气止痛的功效[1],临床上用于治疗心绞痛、心律失常,改善冠心病症状等[2]。目前共有8家生产企业生产,4个质量标准,其质量标准只有性状、鉴别、某种单一成分的含量测定及常规检查,尽管目前已有对保心宁中的某些成分进行含量测定的报道[3-8],但不能全面地体现出总体特征。为了避免原料来源、生产工艺等众多因素影响保心宁片的临床疗效与质量作用,亟需建立安全、全面、可行的质量控制方法。
由于保心宁片是由中药浸膏与药材粉末制成的中药复方制剂,制剂有效成分多且复杂,仅通过对指标性成分的定性定量分析不能达到对制剂实现全面的质量控制[9]。特征图谱是一种综合的、可量化的鉴别模式,能有效地检测和控制中药产品的真实性、质量的一致性及稳定性[10-12]。本文采用高效液相色谱法建立保心宁片的特征图谱,旨在为保心宁片的质量控制提供进一步的实验依据。
1 仪器与试药 1.1 仪器安捷伦公司Agilent 1200高效液相色谱仪;Sartorius公司BT-125D型分析天平;Capcell PAK C18色谱柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶;日本资生堂公司)。天津市泰斯特仪器有限公司DK-98ⅡA电热恒温水浴锅。
1.2 试剂与材料对照品丹参素钠(批号110855-201412,纯度99.5%)、原儿茶醛(批号110810-201007,纯度98.2%)、柚皮苷(批号110722-201111,纯度93.2%)、新橙皮苷(批号111857-201102,纯度99.6%)、迷迭香酸(批号111871-2011102,纯度99.8%)、丹酚酸B(批号111562-201514,纯度93.7%)、二氢丹参酮Ⅰ(批号0868-200103)、隐丹参酮(批号110852-200806,纯度98.7%)、丹参酮Ⅰ(批号0867-200205,供含量测定用)、丹参酮ⅡA(批号110766-200619,供含量测定用)均购自中国食品药品检定研究院;乙腈为色谱纯,水为超纯水,其他试剂均为分析纯。
保心宁片中各味药材(丹参、三七、当归、枳壳)购自北京同仁堂股份有限公司,由吉林省药品检验所中药专家温立义鉴定为基原正确药材,生姜购于超市。保心宁片共8批,来自4个生产厂家,分别为通化正和药业集团股份有限公司(批号为140622、150603、150903、151202、160108,编号S1~S5)、修正药业集团股份有限公司(批号为150102,编号S6)、四川巴中普瑞制药有限公司(批号为151203,编号S7)、湖北广仁药业有限公司(批号为1605010,编号S8)。
2 方法与结果 2.1 色谱条件采用Capcell PAK C18色谱柱(4.6 mm×250 mm,5 μm),以乙腈-0.05%磷酸水作为流动相进行梯度洗脱,梯度程序见表 1,流速0.8 mL·min-1,柱温30 ℃,检测波长270 nm。
|
|
表 1 梯度洗脱时间表 Table 1 Gradient elution |
精密称取丹参素钠等8个待测成分的对照品适量,置于25 mL量瓶中,加甲醇配制成每1 mL含丹参素钠0.2 mg,原儿茶醛0.03 mg,柚皮苷0.2 mg,新橙皮苷0.2 mg,迷迭香酸0.1 mg,丹酚酸B 0.1 mg,二氢丹参酮Ⅰ 0.03 mg,隐丹参酮0.02 mg,丹参酮Ⅰ0.05 mg,丹参酮ⅡA 0.01 mg的混合溶液,即得。
2.2.2 供试品溶液取样品,去除糖衣后,精密称定,研细,取1 g,精密称定,具塞锥形瓶中,加入甲醇25 mL,称量,加热回流90 min,放冷,再称量,用甲醇补足减失的量,摇匀,滤过,取续滤液即得。
2.2.3 阴性样品溶液按处方比例及制备工艺,分别制备缺丹参和枳壳的阴性样品,按供试品溶液的制备方法制备成阴性样品溶液。
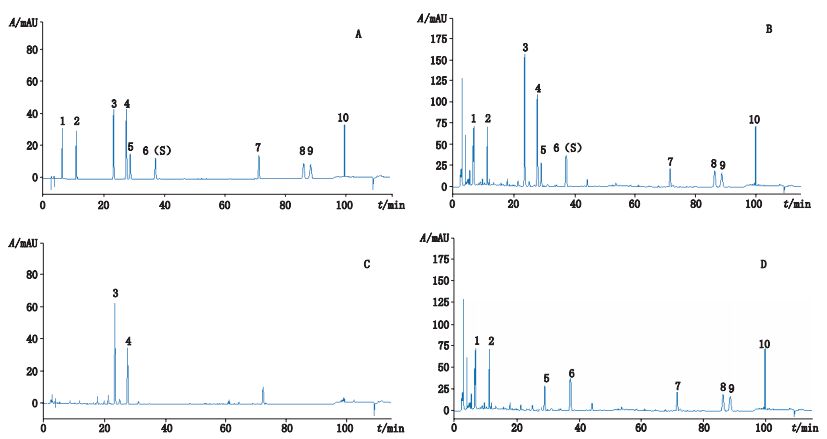
2.3 方法学考察在上述色谱条件下,分别精密吸取对照品溶液、供试品溶液和各阴性样品品溶液各10 μL,注入液相色谱仪,记录色谱图;结果显示,样品中其他成分对8个待测成分的测定无干扰,见图 1。
|
1.丹参素钠(tanshional sodium)2.原儿茶醛(protocatechuic aldehyde)3.柚皮苷(naringin)4.新橙皮苷(neohesperindin)5.迷迭香酸(rosmarinic acid)6.丹酚酸B(salvianolic acid B)7.二氢丹参酮Ⅰ(dihydrotanshione Ⅰ)8.隐丹参酮(cryptotanshinone)9.丹参酮Ⅰ(tanshinone Ⅰ)10.丹参酮ⅡA(tanshinone ⅡA) 图 1 混合对照品(A)、样品(B)、丹参阴性样品(C)及枳壳阴性样品(D)色谱图 Figure 1 HPLC chromatograms of mixed reference substances(A), sample(B), sample without Salviae Miltiorrhizae Radix et Rhizoma(C) and sample without Aurantii Fructus(D) |
精密吸取混合对照品溶液1、2、5、10、15、20、25 μL,分别按“2.1”项下色谱条件进行测定;以待测成分的进样量(μg)对相应的峰面积进行线性回归,计算回归方程,结果见表 2。
|
|
表 2 8个成分回归方程、相关系数及线性范围 Table 2 Regression equations, correlation coefficients and linear ranges of 8 batches of chemical components |
精密吸取供试品溶液10 μL,按“2.1”项下色谱条件,连续进样6次,计算各共有峰相对保留时间及相对峰面积,通过相似度软件计算相似度。结果显示,各共有峰相对保留时间的RSD均小于0.3%;相对峰面积的RSD小于3.0%,相似度接近于1.0。表明仪器精密度良好。
2.3.3 稳定性试验取保心宁片,按“2.2.2”项下方法制备供试品溶液,在“2.1”项下色谱条件分别于0、4、8、12、18、24 h进样10 μL,计算各共有峰相对保留时间及相对峰面积,通过相似度软件计算相似度。结果显示,各共有峰相对保留时间的RSD均小于0.3%;相对峰面积的RSD小于3.0%,相似度接近于1.0。表明供试品溶液24 h内稳定性良好。
2.3.4 重复性试验取保心宁片6份,分别按照“2.2.2”项下方法制备供试品溶液,分别精密吸取10 μL按“2.1”项下条件进样测定,计算各共有峰相对保留时间及相对峰面积,通过相似度软件计算相似度。结果显示,各共有峰相对保留时间的RSD均小于0.3%;相对峰面积的RSD小于3.0%,相似度接近于1.0。表明方法重复性良好。
2.3.5 耐用性试验 2.3.5.1 不同色谱柱对测定的影响分别吸取“2.2.2”项下的供试品溶液10 μL,选用Gemini C18(4.6 mm×250 mm,5 μm)、Sepax C18(4.6 mm×250 mm,5 μm)、Apollo C18(4.6 mm×250 mm,5 μm)3根不同品牌的色谱柱,按“2.1”项下色谱条件进样,结果均能达到系统适用性要求。
2.3.5.2 柱温对测定的影响分别精密吸取“2.2.2”项下的供试品溶液10 μL,柱温分别在25、30、35 ℃时进样,记录色谱图,计算各共有峰的相对保留时间及相对峰面积,通过相似度软件计算相似度。结果显示,各共有峰相对保留时间的RSD均小于0.3%;相对峰面积的RSD小于3.0%,相似度接近于1.0。表明柱温变化对供试品色谱峰的影响不大。
2.3.6 回收率试验称取已知含量样品(编号S1)0.5 g,共6份,精密称定,加入混合对照品溶液(含0.264 8 mg·mL-1柚皮苷、0.325 3 mg·mL-1新橙皮苷、0.006 7 mg·mL-1迷迭香酸、0.051 2 mg·mL-1丹酚酸B、0.002 1 mg·mL-1二氢丹参酮Ⅰ、0.002 5 mg·mL-1隐丹参酮、0.003 4 mg·mL-1丹参酮Ⅰ、0.000 8 mg·mL-1丹参酮ⅡA)25 mL,按“2.2.2”项下方法制备供试溶液,按“2.1”项下色谱条件进样10 μL进行测定,分别计算回收率。结果显示,8个成分的回收率在96.8%~99.9%之间,RSD均小于3.0%。
2.4 特征图谱的建立 2.4.1 混合对照品的分析精密吸取“2.2.1”项下的混合对照品溶液10 μL,按照“2.1”项下的色谱条件进样,结果见图 1。由图可知,在此条件下,8个待测成分均得到较好分离。
2.4.2 共有峰的确定及参照峰的选择吸取“2.2.1”项下的混合对照品溶液10 μL,按照“2.1”项下的色谱条件进样,结果见图 1-A;对各样品色谱图进行分析可知,不同批次的样品均具有一致的特征峰,共标示出10个共有峰。选取丹参中有效成分丹酚酸B峰[峰6(S)]作为参照峰,分别计算各共有峰的相对保留时间,结果见表 3。
|
|
表 3 8批保心宁片共有峰相对保留时间 Table 3 Relative retention time of 8 Baoxinning tablets |
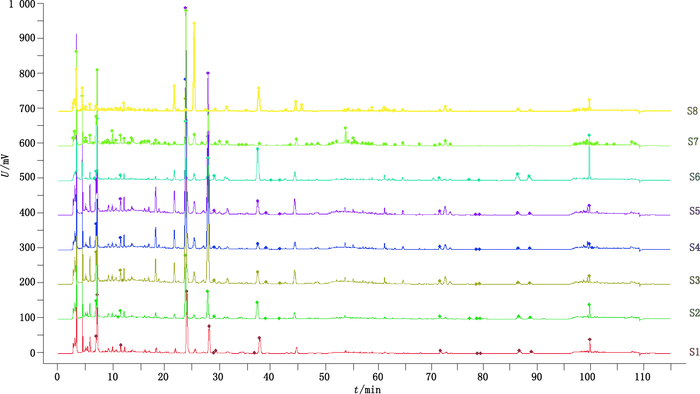
将上述8批样品HPLC图谱,通过国家药典委员会研制的《中药色谱指纹图谱相似度评价系统》软件,8批样品色谱峰的共有模式见图 2。由图 2可以看出,S1~S5为同一厂家不同批号样品的特征图谱,图谱中成分种类和含量差别都不大;S6~S8为不同厂家特征图谱,图谱中各成分种类差别不大,但各个成分的含量差异显著,成分间的比例关系也各不相同。由此可见,同一厂家的质量相对稳定,各个厂家之间存在明显差异。
|
S1~S5.同一厂家不同批号样品(samples of different batches of the same manufacturer) S6~S8.不同厂家不同样品(different samples of different manufacturers) 图 2 8批保心宁片色谱图共有模式 Figure 2 HPLC chromatograms of 8 batches of Baoxinning tablets |
按照“2.3”项下方法制备8批样品的供试品溶液,按照“2.1”项下的色谱条件进行测定,记录峰面积,采用外标法分别计算8个批次的8个指标成分的含量,结果见表 4。
|
|
表 4 保心宁片中8个成分含量测定结果(mg·片-1,n=6) Table 4 Assay of 8 components in Baoxinning tablets(mg per tablet, n=6) |
结果表明,同一厂家不同批号产品间各成分含量相对比较稳定,但不同厂家之间含量存在明显差异,究其原因可能是因为其投料及生产工艺存在差别,但各个厂家标示的用法用量却一致,临床应用时可能会引起较大的药效偏差。为了更好地控制产品质量,建议应该严格控制投料的质量和规范生产工艺,对8个指标成分的含量进行限定。
3 讨论 3.1 提取溶剂和方法的考察本实验考察水、50%甲醇、70%甲醇水和100%甲醇等溶剂对保心宁片的提取,结果表明水与甲醇提取的样品存在较大差异,其中,水提样品色谱峰信息较少;而随着甲醇浓度的升高,色谱峰数量也随之增多,结合制剂的前期制备工艺,选择纯甲醇作为提取溶剂。
实验中也考察了回流提取、超声提取、索氏提取等提取方法;结果显示,索氏提取和回流提取所得色谱峰的峰面积相差不大,超声提取含量较低,且相差较大。因此,综合考虑,最终选取回流提取作为提取方法。
3.2 检测波长的选择[13]在实验中同时检测了丹参总酚酸提取物、丹参酮提取物以及枳壳中的成分,其中,丹参总酚酸的最大吸收波长为286 nm,丹参酮提取物的最大吸收波长为270 nm,枳壳中的成分最大吸收波长为283 nm,各个波长间相差不大,因此,在试验中最终选取各个成分都能得到较好分离的270 nm作为最终的检测波长。
3.3 流动相的选择实验中考察了甲醇-水、甲醇-磷酸水、乙腈-水、乙腈-磷酸水等流动相进行洗脱;结果显示,甲醇-水、乙腈-水洗脱系统出峰的数量较少,甲醇-磷酸水洗脱系统得到的色谱峰基线不平且峰形不好,乙腈-磷酸水洗脱系统得到的色谱峰信息最多且各成分分离情况相对较好,故最终选定乙腈-磷酸水系统作为流动相。
3.4 小结中医讲究用整体观念治疗疾病,因此建立中药质量标准时必须尽可能地将药品的内在质量表现出来。本实验通过对保心宁片进行HPLC特征图谱和8个指标性成分的含量测定,能够较全面地反映保心宁片的总体特征,可以全面、简便、有效地反映其内在质量,可作为保心宁片的质量控制手段之一。
| [1] |
卫生部药品标准. 第二册[S]. 1990: 175 Drug Specifications Promulgated by the Ministry of Public Health, P R China. Vol 2[S]. 1990:175 |
| [2] |
陈小丽, 陈建宗, 吕召学. 保心宁片治疗冠心病心绞痛的临床研究[J]. 广东药学院学报, 2002, 18(3): 233. CHEN XL, CHEN JZ, LÜ ZX. Clinical study of Baoxinning tablets in the treatment of coronary heart disease with angina pectoris[J]. Acad J Guangdong Coll Pharm, 2002, 18(3): 233. |
| [3] |
李海泉. 高效液相色谱梯度洗脱法同时测定保心宁片中3种皂苷含量[J]. 中国药业, 2011, 20(1): 34. LI HQ. Simultaneous determination of 3 kinds of saponins in Baoxinning tablets by HPLC with gradient elution[J]. China Pharm, 2011, 20(1): 34. |
| [4] |
张婷, 魏尊喜. RP-HPLC法同时测定保心宁胶囊中三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1的含量[J]. 安徽医药, 2010, 14(5): 531. ZHANG T, WEI ZX. Simultaneous determination of notoginsenoside R1 and ginsenoside Rg1, Rb1 in Baoxinning capsules by HPLC[J]. Anhui Med Pharm, 2010, 14(5): 531. |
| [5] |
李小曲, 汪霞. 反相HPLC法同时测定保心宁胶囊中丹参酮ⅡA的含量[J]. 中国现代药物应用, 2008, 2(17): 44. LI XQ, WANG X. RP-HPLC determination Baoxinning capsule in the contents of tanshinone ⅡA[J]. Chin J Mod Drug Appl, 2008, 2(17): 44. DOI:10.3969/j.issn.1673-9523.2008.17.025 |
| [6] |
王向娟. 保心宁胶囊中柚皮苷与新橙皮苷的含量测定[J]. 医药导报, 2015, 34(2): 258. WANG XJ. Determination of naringin and neohesperidin in Baoxinning capsules[J]. Her Med, 2015, 34(2): 258. |
| [7] |
方涛, 刘平. 高效液相色谱法测定保心宁胶囊中丹酚酸B的含量[J]. 中国药师, 2008, 11(2): 202. FANG T, LIU P. Determination of the content of salvianolic acid B in Baoxinning capsules by HPLC[J]. China Pharm, 2008, 11(2): 202. |
| [8] |
韩君, 李春英, 韩文宇. 高效液相色谱法测定保心宁胶囊中隐丹参酮与丹参酮ⅡA含量[J]. 亚太传统医药, 2013, 9(6): 37. HAN J, LI CY, HAN WY. Determination of Baoxinning capsules of crytotanshinone and tanshinone ⅡA content by HPLC[J]. Asia-Pac Tradit Med, 2013, 9(6): 37. |
| [9] |
汪艳平, 戴德雄, 谢媛媛, 等. 骨刺胶囊HPLC指纹图谱[J]. 中成药, 2016, 28(1): 98. |
| [10] |
王晴, 王英姿, 李友林, 等. 红鹤方制剂HPLC指纹图谱研究[J]. 北京中医药大学学报, 2016, 39(1): 40. WANG Q, WANG YZ, LI YL, et al. HPLC fingerprint study of Honghe Fang preparation[J]. J Beijing Univ Tradit Chin Med, 2016, 39(1): 40. |
| [11] |
叶建晨. 复方金银花颗粒高校液相色谱特征图谱研究及指标性成分的含量测定[J]. 中国实验方剂学杂志, 2012, 18(16): 105. YE JC. Study on the specific chromatogram of compound Jinyinhua granule and determination of target components by HPLC[J]. Chin J Exp Tradit Med Form, 2012, 18(16): 105. |
| [12] |
白埔, 萨础拉, 董玉. 蒙药复方森登-4特征图谱及其中6个指标性成分的含量测定[J]. 北京中医药大学学报, 2016, 39(6): 489. BAI P, SA CL, DONG Y. Specific chromatogram of Mongolian medicine compound Sendeng-4 and simultaneous determination of its six index components[J]. J Beijing Univ Tradit Chin Med, 2016, 39(6): 489. |
| [13] |
中国药典2015年版. 一部[S]. 2015: 246, 397, 398 ChP 2015. Vol Ⅰ[S]. 2015:246, 397, 398 |
 2017, Vol. 37
2017, Vol. 37 
