2. 南京中医药大学药学院, 南京 210023
2. College of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China
五味子为木兰科植物五味子Schisandra chinensis(Turcz.)Baill.的干燥成熟果实。其味酸甘,性温,有收敛固涩、益气生津、补肾宁心的功效,用于久嗽虚喘、梦遗滑精、遗尿尿频、心悸失眠等症[1],已在临床上使用数千年。现有文献报道[2-3]五味子中含有木脂素、挥发油、多糖、有机酸、鞣质等成分,其中木脂素成分是其主要活性成分,具有保肝护肝[4]、镇静催眠、抗病毒、抗肿瘤及抗炎作用[5-6]。肝作为体内药物摄取、代谢的主要器官,来源于人正常肝组织且具有与正常肝细胞相似生物功能的L-02肝细胞可在细胞水平上提供药物在肝中摄取、代谢等信息,是评价药物成分对肝细胞功能影响的理想体外模型[7-8],本实验采用L-02肝细胞探索五味子中木脂素成分在肝细胞内的摄取情况,为进一步探索五味子保肝护肝等药理作用及其机制提供实验依据。
目前分析五味子中木脂素成分的方法有TLC[9]、HPLC[10-12]、HPLC-MS[13-15],UPLC-MS[16]和GC-MS[17],但是这些方法多集中测定五味子饮片、制剂及灌胃给予五味子提取物后大鼠血浆中的木脂素成分,对人肝细胞中木脂素成分的含量测定未见文献报道。为体现中药多为口服的传统,采用五味子提取液的给药方法,受影响因素较多,例如提取液的细胞毒性、提取液的给药量控制、被测成分的空间结构等,更增大了被测成分含量测定的难度。液-质联用技术由于分离能力强,灵敏度高及分析速度快,已成为一种有效便捷的含量测定方法,得到了广泛应用。为了研究五味子中木脂素成分保肝护肝的物质基础,本文建立了一种简便、快速、灵敏、准确测定人肝细胞中五味子甲素和五味子乙素的液-质联用分析方法。
1 仪器、试药及细胞 1.1 仪器Agilent 1200-6120B型单重四极杆液质联用色谱仪(Agilent公司),配有双元泵、脱气机、柱温箱、自动进样器、DAD检测器和电喷雾离子源(ESI);依利特Inertsil ODS-C18色谱柱(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶为填充剂);微型涡旋混合仪(上海沪西分析仪器有限公司);超纯水器(Millipore,Bedford,MA,USA);立式压力蒸汽灭菌器(上海申安医疗器械厂);5%CO2培养箱(Forma 311,USA);酶联免疫检测仪(SPECTRA MAX190)。
1.2 试药对照品五味子甲素(批号110764-200609)、五味子乙素(批号110765-200710)均购自中国食品药品检定研究院,供含量测定用。内标物睾丸酮购自德国Dr. Ehrenstorfer公司(生产编号80917,99.5%)。胎牛血清(Fetal Bovine Serum,FBS,91109002)、胰蛋白酶(trypsin,27250-018)均购自GIBCO,USA。五味子饮片购自安徽丰原铜陵中药饮片有限公司(辽宁,批号101215)。DMEM(赛默飞世尔生物化学制品有限公司,NVK0324)。乙腈为色谱纯,其余试剂均为市售分析纯,水为超纯水。
1.3 细胞L-02肝细胞,购自美国典型培养物保存中心(American Typy Culture Collection,ATCC)。
2 方法与结果 2.1 色谱条件采用依利特ODS-C18色谱柱(250 mm×4.6 mm,5 μm),以乙腈-0.05%甲酸水溶液(45:55)为流动相,流速1.0 mL·min-1,柱温30 ℃,进样量5 μL。
2.2 质谱条件离子源为电喷雾离子源ESI,毛细管电压3 kV,干燥气流速10 L·min-1,干燥气温度350 ℃,雾化气压力241.38 kPa,碎裂电压100 V,离子化模式为正离子模式,扫描方式为选择性检测(SIM)模式,选择的检测离子质荷比(m/z)为五味子甲素401.0、五味子乙素417.0和内标物睾丸酮289.0。
2.3 溶液的配制 2.3.1 混合对照品溶液分别精密称取五味子甲素和五味子乙素的对照品适量,用甲醇配制成单一对照品储备液(五味子甲素质量浓度1.29 mg·mL-1,五味子乙素质量浓度1.14 mg·mL-1);精密吸取各单一对照品储备液适量,配制成每1 mL含五味子甲素6.45 μg和五味子乙素5.70 μg的混合对照品储备液。分别精密吸取混合对照品储备液适量,用甲醇稀释成五味子甲素质量浓度为0.101、0.202、0.403、0.806、1.163、3.225、6.450 μg·mL-1和五味子乙素质量浓度为0.089、0.178、0.356、0.713、1.425、2.850、5.700μg·mL-1的系列混合对照品溶液。
2.3.2 内标溶液精密称取睾丸酮适量,用乙腈溶解配制成每1 mL含睾丸酮0.228 mg的内标储备液;另精密吸取内标储备液适量,用乙腈稀释成每1 mL含睾丸酮2.28 μg的内标溶液。
2.3.3 供试品溶液取醋五味子饮片适量,粉碎成粗粉。称取醋五味子粗粉适量,加8倍量80%乙醇加热回流提取2次,每次1.5 h,过滤,合并滤液,减压回收乙醇,浓缩得浸膏。将浸膏用D’Hanks溶液稀释到1 g·mL-1,过滤除菌,4 ℃避光保存,备用。
2.4 样品的采集取复苏的L-02肝细胞,加入含有10%胎牛血清的DMEM培养液,于37 ℃、5% CO2及饱和湿度的细胞培养箱中连续培养,取处于对数生长期的细胞,先用D’Hanks溶液洗涤2遍,再用0.25%胰蛋白酶消化约2 min,加入含10%胎牛血清的DMEM培养液终止消化,并用吸管轻轻吹打培养皿至细胞成悬液,吸至离心管,于1 000 r·min-1离心5 min,弃上清,同法再洗涤2遍后,用含10%胎牛血清的DMEM培养基稀释细胞至5×105个·mL-1,种至6孔板上,每孔2 mL。加入含醋五味子样品溶液的培养基,使药物终浓度为3 mg·mL-1,分别于1、2、3、4、6、8和24 h移除上清,用D’Hanks溶液快速清洗细胞单层。用细胞刮取器刮下细胞,加入1 mL去离子水清洗细胞到离心管中,300 W超声粉碎细胞10 min,得细胞粉碎液。
2.5 细胞样品的处理取细胞粉碎液,5 000 r·min-1离心10 min,精密吸取上清液100 μL,混合对照品溶液30 μL,涡旋30 s,精密加入内标溶液20 μL,涡旋30 s,再精密加入乙腈200 μL沉淀蛋白,涡旋2 min,最后于高速离心机上14 000 r·min-1离心15 min,吸取上清液5 μL进行HPLC-MS分析。
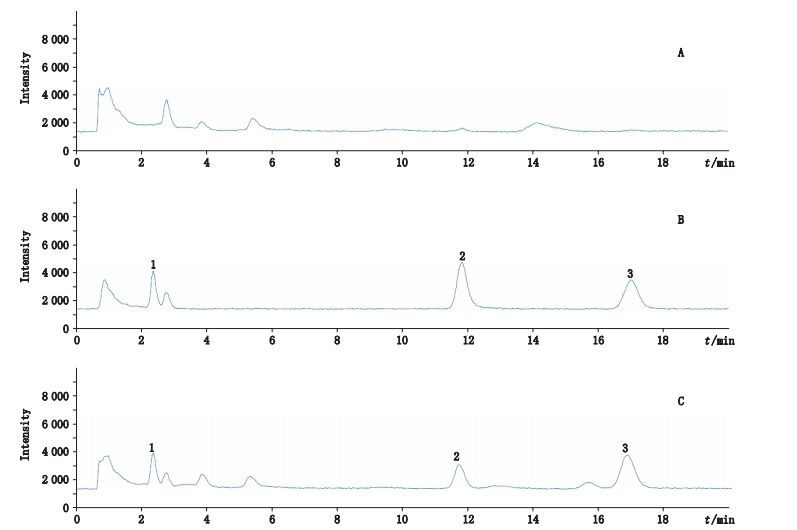
2.6 组织样品方法学考察 2.6.1 专属性试验取空白细胞粉碎液、空白细胞粉碎液加入适量混合对照品溶液和内标溶液、给药后细胞粉碎液加入内标溶液各100 μL,按照“2.5”项下方法处理后并按照上述色谱条件进行HPLC-MS分析。获得空白肝细胞破碎液色谱图(图 1-A),空白肝细胞破碎液加入混标和内标溶液色谱图(图 1-B),肝细胞给予醋五味子提取物后3 h的肝细胞样品加入内标溶液色谱图(图 1-C)。结果表明,组织中的内源性物质不干扰五味子甲素、五味子乙素和内标物的测定。
|
1.睾丸酮(IS,testosterone)2.五味子甲素(deoxyschisandrin)3.五味子乙素(schisandrin B)A.空白肝细胞破碎液(blank L-02 cell sample)B.空白肝细胞破碎液+混标溶液+内标物(blank L-02 cell spiked with mixed standard and internal standard)C.肝细胞给予醋五味子提取物后3 h的肝细胞样品+内标物(L-02 cell 3 h after culture with extract of vinegar-processed) 图 1 L-02肝细胞中选择离子HPLC-MS色谱图 Figure 1 Selected ion monitoring chromatograms of L-02 cell |
精密吸取空白细胞粉碎液100 μL,分别精密加入不同浓度的混合对照品溶液30 μL,涡旋30 s,配制成五味子甲素质量浓度为0.023、0.047、0.093、0.186、0.372、0.744、1.489 μg·mL-1,五味子乙素质量浓度为0.021、0.041、0.082、0.164、0.329、0.658、1.315 μg·mL-1的系列混合对照品组织液,并按照上述色谱条件进行HPLC-MS分析,每个浓度平行处理5份。以各对照品峰面积与内标峰面积的比值对相应的对照品质量浓度进行线性回归,得五味子甲素、五味子乙素相应的回归方程:
Y=15.511 1X-0.121 9 r=0.996 6
Y=15.206 4X-0.320 8 r=0.998 4
线性范围分别为0.023~1.489和0.021~1.315 μg·mL-1。结果表明所测成分在各自的线性范围内线性关系良好。
2.6.3 稳定性试验精密吸取空白细胞粉碎液100 μL,分别精密加入不同浓度的混合对照品溶液30 μL,涡旋30 s,配制成五味子甲素质量浓度为0.023、0.093、0.372 μg·mL-1,五味子乙素质量浓度为0.021、0.082、0.329 μg·mL-1的低、中、高3种质控样品,按“2.5”项下进行操作处理,每个浓度平行处理5份,室温下放置12、24、72 h后,按照上述色谱条件下进行HPLC-MS分析,测定细胞粉碎液中五味子甲素、五味子乙素和睾丸酮色谱峰的峰面积,并计算各待测峰与内标峰的峰面积比值,根据比值计算其日内稳定性和日间稳定性的RSD。结果表明供试品稳定性良好,见表 1。
|
|
表 1 测定方法的精密度、稳定性和提取回收率 Table 1 Precision, stability and extraction recovery of the method |
精密吸取空白细胞粉碎液100 μL,分别精密加入不同浓度的混合对照品溶液30 μL,涡旋30 s,配制成五味子甲素质量浓度为0.023、0.093、0.372 μg·mL-1,五味子乙素质量浓度为0.021、0.082、0.329 μg·mL-1的低、中、高3种质控样品,按“2.5”项下进行操作处理,每个浓度平行处理5份,连续测定3 d,按照上述色谱条件进行HPLC-MS分析,测定细胞粉碎液中五味子甲素、五味子乙素和睾丸酮色谱峰的峰面积,并计算各待测峰与内标峰的峰面积比值,根据比值计算其日内精密度和日间精密度的RSD。结果表明仪器精密度良好,见表 1。
2.6.5 回收率试验精密吸取空白细胞粉碎液100 μL,分别精密加入不同浓度的混合对照品溶液30 μL,涡旋30 s,配制成五味子甲素质量浓度为0.023、0.093、0.372 μg·mL-1、五味子乙素质量浓度为0.021、0.082、0.329 μg·mL-1的低、中、高3种质控样品,按“2.5”项下进行操作处理,每个浓度平行处理5份,按照上述色谱条件进行HPLC-MS分析,测定空白细胞粉碎液中五味子甲素、五味子乙素和内标睾丸酮色谱峰的峰面积,并计算各待测峰与内标峰峰面积的平均比值A;另配制相同低、中、高浓度的混合对照品溶液各1份,同样按照上述色谱条件进行HPLC-MS分析,测定五味子甲素、五味子乙素和内标睾丸酮色谱峰的峰面积,计算各浓度对照品溶液中各成分峰面积与内标峰峰面积的平均比值B;以A/B×100%得到各浓度下各待测成分的提取回收率。结果见表 1。
2.7 结果测定按照上述方法测定并计算给药后L-02肝细胞中五味子甲素和五味子乙素的浓度,结果以每1 mL细胞液中含有的被测成分量(μg)表示,结果见表 2。
|
|
表 2 给予醋五味子提取物后肝细胞中五味子甲素和五味子乙素的含量测定结果 Table 2 Determined results of deoxyschisandrin and schisandrin B in L-02 cell after culture with extract of vinegar-processed S. chinensis |
本研究考察了细胞液的多种处理方法,包括乙醚、氯仿的液-液萃取法和乙腈、甲醇、三氟乙酸沉淀蛋白法。结果显示,乙腈沉淀蛋白方法简单易行,稳定可靠,内源性物质不干扰成分的测定。另对氮气吹干复溶与否进行了考察,发现氮气吹干复溶后被测成分的回收率降低,并且方法稳定性不符合生物样品含量测定要求。
3.2 质谱检测参数优选本研究对各个质谱参数进行了优选,包括被测成分和内标物的相对分子质量、分子碎裂电压、干燥气流速和干燥气温度等。运用SCAN模式优选出五味子甲素、五味子乙素和内标物睾丸酮的相对分子质量;对碎裂电压(80、100、120、150 V)优选发现,各成分在100 V时响应值最大;对干燥气流速(8、10、12 L·min-1)和干燥气温度(320、350、380 ℃)优选发现,干燥气流速10 L·min-1和干燥气温度350 ℃时各成分的峰面积最大。
3.3 供试品对细胞毒性研究为避免醋五味子提取物对L-02肝细胞毒性对本研究的影响,在开始前采用MTT法进行了测定,发现细胞存活率均随药物剂量的升高先平衡后降低,即醋五味子给药剂量从0 mg·mL-1升高到3 mg·mL-1时,对细胞基本上不产生毒性,细胞存活率由100%下降到99.21%,但由3 mg·mL-1继续升高时,细胞的存活率下降,直到100 mg·mL-1时的3.26%,细胞几无存活。
3.4 被测成分的选择本实验在研究时同时对生五味子提取物和五味子含量最高的五味子醇甲进行了含量研究,发现生五味子提取物给予肝细胞后,细胞中的五味子甲素和五味子乙素基本检测不到;而给予醋五味子提取物后,五味子甲素和五味子乙素能够被准确定量,提示五味子经醋制后能够促进五味子中木脂素成分在肝细胞中的摄取,但是五味子中含量最高的五味子醇甲在两者中均未检测到,可能与五味子醇甲的空间结构及基团有关,具体原因有待进一步探讨研究。
3.5 研究结论本实验所建立的方法操作简单,灵敏度高,干扰小,简化了细胞样品的处理过程。实验结果显示,五味子甲素和五味子乙素在肝细胞中的摄取均呈先升高后降低的趋势,在3 h时达到最大摄取,24 h基本消除完成。
| [1] |
中国药典2015年版. 一部[S]. 2015: 66 ChP 2015. Vol Ⅰ[S]. 2015:66 |
| [2] |
徐丽华, 黄芳, 孙萌, 等. 南北五味子镇静催眠活性部位共有成分的分析[J]. 分析化学, 2009, 37(6): 828. XU LH, HUANG F, SUN M, et al. Common hypnagogic active constituents of Schisandra sphenanthera and Schisandra chinensis[J]. Chin J Anal Chem, 2009, 37(6): 828. |
| [3] |
官艳丽, 曹沛, 郁开北. 北五味子化学成分的研究[J]. 中草药, 2006, 37(2): 185. GUAN YL, CAO P, YU KB, et al. Studies on the chemical constituents from the fruit of Schisandra chinensis[J]. Chin Tradit Herb Drugs, 2006, 37(2): 185. |
| [4] |
陶小芳, 宿树兰, 江署, 等. 五味子药渣提取物中木脂素类成分分析及其对急性肝损伤模型大鼠的保护作用[J]. 中草药, 2016, 47(17): 3051. TAO XF, SU SL, JIANG S, et al. Analysis of lignan components in Schizandrae Fructus residue extracts and their protective effects on acute-hepatic damnification rats[J]. Chin Tradit Herb Drugs, 2016, 47(17): 3051. DOI:10.7501/j.issn.0253-2670.2016.17.015 |
| [5] |
邱宏涛, 赵筱萍, 李正, 等. 基于网络药理学的五味子木脂素类主要药效作用研究[J]. 中国中药杂志, 2015, 40(3): 522. QIU HT, ZHAO XP, LI Z, et al. Study on main pharmacodynamic effects for Schisandra lignans based upon network pharmacology[J]. China J Chin Mater Med, 2015, 40(3): 522. |
| [6] |
IP SP, POON MK, CHE CT, et al. Schisandrin B protects against carbon tetrachloride toxicity by enhancing the mitochondrial glutathione redox status in mouse liver[J]. Free Radic Boil Med, 1996, 21(5): 709. DOI:10.1016/0891-5849(96)00179-7 |
| [7] |
薛春苗, 张冰, 林志健. 仙茅及其有效成分对不同状态L-02细胞PXR-CYP3A的影响研究[J]. 中国中药杂志, 2013, 38(19): 3348. XUE CM, ZHANG B, LIN ZJ. Study on effect of Curculiginis Rhizoma and its active ingredients on PXR-CYP3A of L-02 cells in different states[J]. China J Chin Mater Med, 2013, 38(19): 3348. |
| [8] |
林佩, 陆建美, 张光远, 等. 何首乌活性成分在肝L-02细胞中吸收及代谢产物的LC-MS/MS定性分析[J]. 中国药学杂志, 2015, 50(12): 1048. LIN P, LU JM, ZHANG GY, et al. Study on absorption and metabolism of active compounds of Polygoni Multiflori Radix in hepatic L-02 cells by liquid chromatography tandem-mass spectrometry[J]. Chin Pharm J, 2015, 50(12): 1048. |
| [9] |
LU Y, CHEN DF. Analysis of Schisandra chinensis and Schisandra sphenanthera[J]. J Chromatogr A, 2009, 1216(11): 1980. DOI:10.1016/j.chroma.2008.09.070 |
| [10] |
胡俊扬, 陆兔林, 毛春芹, 等. HPLC法同时测定五味子饮片中6个木脂素类成分的含量[J]. 药物分析杂志, 2011, 31(12): 2225. HU JY, LU TL, MAO CQ, et al. HPLC simultaneous determination of six lignans in Fructus Schisandrae[J]. Chin J Pharm Anal, 2011, 31(12): 2225. |
| [11] |
胡俊扬, 陆兔林, 毛春芹, 等. HPLC法同时测定不同产地五味子中8种木脂素类成分[J]. 中成药, 2012, 34(2): 313. HU JY, LU TL, MAO CQ, et al. Simultaneous determination of eight lignans in Schisandra chinensis(Turcz.)Baill. from different habitats by HPLC[J]. Chin Tradit Pat Med, 2012, 34(2): 313. |
| [12] |
HALSTEAD CW, LEE S, KHOO CS, et al. Validation of a method for the simultaneous determination of four Schisandra lignans in the raw herb and commercial dried aqueous extracts of Schisandra chinensis(Wuweizi)by RP-LC with DAD[J]. J Pharm Biomed, 2007, 45(1): 30. DOI:10.1016/j.jpba.2007.05.016 |
| [13] |
WANG BL. Simultaneous quantification of four active Schisandra lignans from a traditional Chinese medicine Schisandra chinensis (Wuweizi)in rat plasma using liquid chromatography/mass spectrometry[J]. J Chromatogr B, 2008, 865(1): 114. |
| [14] |
李惠连, 季德, 毛春芹, 等. LC-MS测定大鼠血浆中五味子的3个木脂素成分及其药动学研究[J]. 中国药理学通报, 2013, 29(9): 1313. LI HL, JI D, MAO CQ, et al. Rapid determination of three lignans in the fruits of Schisandra chinensis by LC-MS methods and analysis of their pharmacokinetics in rat plasma[J]. Chin Pharmacol Bull, 2013, 29(9): 1313. |
| [15] |
YANG J, IP SP, YEUNG HJ, et al. HPLC-MS analysis of Schisandra lignans and their metabolites in Caco-2 cell monolayer and rat everted gut sac models and in rat plasma[J]. Acta Pharm Sin B, 2011, 1(1): 46. DOI:10.1016/j.apsb.2011.04.007 |
| [16] |
李伟, 刘亚丽, 宋永贵, 等. UPLC-Q-TOF-MSE结合OPLS-DA模式快速鉴定南、北五味子化学成分与识别差异标志物[J]. 中草药, 2015, 46(15): 2212. LI W, LIU YL, SONG YG, et al. Rapid identification on chemical constituents in fruits of Schisandra sphenanthera and Schisandra chinensis and discrimination markers by UPLC-Q-TOF-MSE combined with OPLS-DA[J]. Chin Tradit Herb Drugs, 2015, 46(15): 2212. DOI:10.7501/j.issn.0253-2670.2015.15.006 |
| [17] |
向智敏, 李会林, 张骊. 五味子超临界CO2提取物的气相色谱-质谱分析[J]. 色谱, 2003, 21(6): 568. XIANG ZM, LI HL, ZHANG L. Study on supercritical carbon dioxide extracted from Schisandra chinensis by gas chromatographymass spectrometry[J]. Chin J Chromatogr, 2003, 21(6): 568. |
 2017, Vol. 37
2017, Vol. 37 
