川西獐牙菜Swertia mussotii Franch.是龙胆科Gentianaceae獐牙菜属Swertia L.植物,藏译音名“桑滴”,俗称藏茵陈;具有清热利胆、除湿、平肝风、舒肝健胃、强心、养血、解毒等作用,主要用于治疗肝功能紊乱和黄疸,具有抗炎、退热、利胆及利尿等功效[1-2],分布于我国西藏、青海、甘肃。生于山坡、河谷、林下、灌丛、水边,海拔1 900~3 800 m[3]。川西獐牙菜中化学成分主要为萜类、环烯醚萜苷类、三萜类黄酮及多元酚类、有机酸等[4]。现代药理学研究表明,川西獐牙菜之所以具有许多药理活性与其中的化学成分有着必然联系[5]。其中含有的龙胆苦苷、獐牙菜苷、獐牙菜苦苷等环烯醚萜苷类成分,具有清热解毒、利胆退黄之功效,对于黄疸型肝炎,病毒性肝炎具有显著效果[6];芒果苷和齐墩果酸具有抗炎护肝作用[7]。这些化学成分将成为川西獐牙菜生物活性的物质基础。
有关川西獐牙菜的研究多为化学成分综述概括及药理作用和临床应用[5, 8],不同提取溶剂部位化学成分的研究及红外光谱分析[9-11];有效成分提取工艺和制备的研究也有相关文献报道[12-14],也有采用HPLC-ESI/MS测定龙胆科植物藏茵陈甲醇提取物中獐牙菜苦苷、龙胆苦苷、芒果苷等的含量[15],采用HPLC法测定川西獐牙菜中有效成分落干酸、龙胆苦苷、獐牙菜苦苷、芒果苷中部分成分的含量[16],而未见采用快速溶剂萃取仪在线提取并采用UPLC法同时测定川西獐牙菜中有效成分的文献报道。本文使用ASE 350快速溶剂萃取仪通过在线净化过程加入乙醚除去川西獐牙菜中的脂类物质,继续加入甲醇用ASE在线提取出样品中包括苦苷类和黄酮类的6个主要有效成分,并采用UPLC法对这6个有效成分进行定量分析,为青海川西獐牙菜的质量控制提供依据。
1 仪器和试药 1.1 仪器Waters公司ACQUITY UPLC超高效液相色谱仪、Empower色谱工作站;迪马科技Endeavorsil-C18(2.1 mm×100 mm,1.8 μm;填料:高纯球形十八烷基硅烷键合硅胶);DIONEX公司ASE 350快速溶剂萃取仪(配备有34 mL不锈钢萃取池);METTLER TOLEDO公司MS205DU型分析电子天平;昆山超声仪器科技有限公司KQ-100E型超声波清洗器;上海摩勒生物科技有限公司MOLELEMENT元素型超纯水机。
1.2 试药对照品獐牙菜苦苷(批号14080127)、獐牙菜苷(批号14010221)、异荭草苷(批号12122723)、异牡荆素(批号1406021)、芒果苷(批号12121335)均购自上海同田生物技术股份有限公司,对照品龙胆苦苷(批号110770-201314)购自中国食品药品检定研究院;以上对照品标示纯度均 > 98%。流动相用甲醇为色谱纯,冰乙酸、提取用的甲醇均为分析纯,试验用水为超纯水。
自青海收集10批野生川西獐牙菜,其来源见表 1,经中国科学院西北高原生物研究所高庆波副研究员鉴定为川西獐芽菜(Swertia mussotii Franch.)的干燥全草。样品预处理:采集的川西獐牙菜药材阴干后粉碎过60目筛,置密封袋中密封,干燥保存。
|
|
表 1 来自青海川西獐牙菜样品信息 Table 1 Sample information of Swertia mussotii Franch. collected from Qinghai |
色谱柱:Endeavorsil-C18(2.1 mm×100 mm,1.8 μm);流动相:甲醇(A)-0.1%乙酸水溶液(B),梯度洗脱(0~15 min,15%A→30%A;15~20 min,30%A→65%A;20~25 min,65%A);流速:0.2 mL·min-1;检测波长:260 nm;柱温:室温;进样量:5 μL。
2.2 溶液制备 2.2.1 对照品储备液精密称取獐牙菜苦苷、龙胆苦苷、獐牙菜苷、芒果苷的对照品适量,分别置于10 mL量瓶中;精密称取异荭草苷和异牡荆素的对照品适量,分别置于25 mL量瓶中。均取甲醇加入至上述量瓶中使对照品溶解并稀释至刻度,摇匀,作为各待测成分的对照品储备液(各浓度分别为獐牙菜苦苷1.635 mg·mL-1,龙胆苦苷5.227 mg·mL-1,獐牙菜苷2.173 mg·mL-1,芒果苷1.504 mg·mL-1,异荭草苷0.901 6 mg·mL-1,异牡荆素0.713 6 mg·mL-1)。
2.2.2 供试品溶液称取样品粉末0.5 g,精密称定,置于烧杯中,先加入10 g硅藻土搅拌混和均匀后转入提前加装纤维素滤片的34 mL不锈钢萃取池中,空隙部分用硅藻土填满。在室温条件下用10 mL乙醚静置提取8 min,循环提取1次,弃去乙醚提取液。然后在70 ℃下用10 mL甲醇静置提取15 min,循环提取2次。收集瓶冷却至室温,将提取液用甲醇稀释并定容至100 mL,微孔滤膜(0.22 μm)过滤后取续滤液,即得。
2.3 系统适用性试验分别取混合对照品溶液和供试品溶液各5 μL,在“2.1”项色谱条件下,注入UPLC进行测定,并记录色谱图,见图 1。在本试验条件下,供试品溶液和混合对照品溶液的色谱图中各吸收峰的理论板数均不低于3 000。同时将样品与各对照品的色谱图进行对照,根据保留时间及紫外吸收光谱图对川西獐牙菜中苦苷类和黄酮类共6个成分进行定性,各色谱峰的峰形和分离度较好,与相邻色谱峰的分离度均大于1.5,拖尾因子在0.95~1.05之间,达到理想的分离结果。可以准确测定其峰面积,并以峰面积进行定量分析。
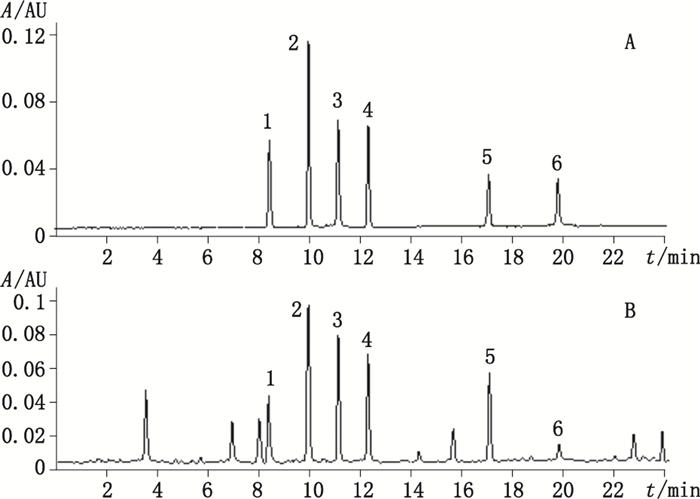
|
1.獐牙菜苦苷(swertiamarin)2.龙胆苦苷(gentiopicroside)3.獐牙菜苷(sweroside)4.芒果苷(mangiferin)5.异荭草苷(isoorientin)6.异牡荆素(isovitexin) 图 1 对照品(A)和样品(B)的UPLC色谱图 Figure 1 UPLC chromatograms of mixed reference substances(A)and representative sample(B) |
分别精密吸取6个对照品的储备液适量,置于同一量瓶中,用甲醇制备成系列混合对照品溶液:獐牙菜苦苷0.510 9、1.022、2.044、4.087、8.174 mg·L-1,龙胆苦苷1.633、3.267、6.534、13.07、26.13 mg·L-1,獐牙菜苷0.679 0、1.358、2.716、5.432、10.86 mg·L-1,芒果苷0.470 0、0.940 0、1.880、3.760、7.520 mg·L-1,异荭草苷0.281 8、0.563 5、1.127、2.254、4.508 mg·L-1,异牡荆素0.223 0、0.446 0、0.892 0、1.784、3.568 mg·L-1。精密吸取此系列混合对照品溶液各5 μL在“2.1”项色谱条件下,注入UPLC进行测定,每个溶液进样3次,记录色谱峰面积,以色谱峰面积积分值的平均值Y为纵坐标,对应的对照品质量浓度X(mg·L-1)为横坐标,进行回归分析,各成分的线性关系考察结果见表 2,表明各待测成分的线性关系良好。取混合对照品溶液适量,以甲醇逐级稀释,进样测定;以稀释后的混合对照品溶液测出的信号与空白样品(萃取池中不含样品只填充硅藻土的甲醇提取液)测出的平均信号(做空白试验5次,取信号均值)进行比较,按“2.1”项色谱条件注入UPLC进行测定,直到信噪比(S/N)为10时的相应浓度作为定量限(LOQ),信噪比(S/N)为3时的相应浓度作为检测限(LOD),结果见表 2。
|
|
表 2 川西獐牙菜中6个主要有效成分的线性关系、定量限和检测限结果(n=3) Table 2 Linearity, LOQ and LOD of six main bioactive constituents in Swertia mussotii Franch. |
精密吸取混合对照品溶液5 μL,按“2.1”项色谱条件连续进样6次,记录各色谱峰面积值,计算得獐牙菜苦苷、龙胆苦苷、獐牙菜苷、芒果苷、异荭草苷和异牡荆素峰面积的RSD分别为0.17%、0.44%、0.93%、0.65%、0.82%、0.10%,结果表明仪器的精密度良好。
2.6 重复性试验取同一批川西獐牙菜药材样品(6号样品)0.5 g共6份,精密称定,分别按“2.2.2”项下方法制备供试品溶液,并按“2.1”项下色谱条件进样5 μL;结果测得獐牙菜苦苷、龙胆苦苷、獐牙菜苷、芒果苷、异荭草苷和异牡荆素的含量平均值(n=6)分别为5.45、9.04、4.83、4.20、4.06、0.36 mg·g-1,RSD分别为1.8%、0.94%、1.6%、1.4%、1.0%、1.8%。结果表明该方法的重复性较好。
2.7 稳定性试验取同一份供试品溶液,室温放置,分别在制备后0、2、4、6、8、12、24 h时按“2.1”项下色谱条件进样5 μL,记录各色谱峰面积值;结果獐牙菜苦苷、龙胆苦苷、獐牙菜苷、芒果苷、异荭草苷和异牡荆素峰面积的RSD分别为1.6%、0.85%、1.8%、2.0%、0.90%、1.9%,表明供试品溶液在24 h内稳定性良好。
2.8 加样回收试验称取已知含量的6号样品粉末9份,每份0.25 g,精密称定,分别精密加入高、中、低3个浓度的混合对照品溶液(獐牙菜苦苷0.648 8 mg·mL-1,龙胆苦苷1.045 mg·mL-1,獐牙菜苷0.521 5 mg·mL-1,芒果苷0.473 8 mg·mL-1,异荭草苷0.489 4 mg·mL-1,异牡荆素0.042 2 mg·mL-1)1、2、3 mL,每个浓度3份,分别按“2.2.2”项下方法制备供试溶液,并按“2.1”项下色谱条件进样5 μL,计算各成分的平均回收率和RSD。结果獐牙菜苦苷、龙胆苦苷、獐牙菜苷、芒果苷、异荭草苷和异牡荆素的平均加样回收率(n=9)分别为96.4%(RSD=2.1%)、98.2%(RSD=1.5%)、100.1%(RSD=2.6%)、97.3%(RSD=1.9%)、98.6%(RSD=1.1%)、98.0%(RSD=1.8%)。
2.9 样品测定取所收集的青海川西獐牙菜样品粉末,应用所建立的方法按“2.2.2”项下方法制备供试品溶液,并按“2.1”项下色谱条件进样5 μL,采用标准曲线法(按回归方程)计算样品中6个有效成分的平均含量,结果见表 3。
|
|
表 3 青海川西獐牙菜中6个有效成分的测定结果(mg·g-1,n=3) Table 3 Contents of six main bioactive constituents in Swertia mussotii Franch from Qinghai |
将表 3中列出的10批样品中的3种苦苷类成分和3种黄酮类成分的含量进行归纳,比较青海互助县、玉树州和平安区的川西獐牙菜中这两类成分的含量差别,并采用SPSS 16.0统计软件分别进行单因素方差分析。
由结果可知:(1)采集于同一年份(2015年)的互助与玉树样品中的苦苷类成分总含量显著性概率P < 0.05,具有显著性差异;(2)采集于同一年份的上述两产地样品中的黄酮类成分总含量显著性概率P > 0.05,不具有显著性差异;(3)同一产地不同地点的样品中苦苷类成分总含量和黄酮类成分总含量的显著性概率均为P > 0.05,说明这3个不同地区之间这些有效成分的总含量均不具有显著性差异。
3 讨论与结论 3.1 前处理中的净化在供试品溶液制备中若直接加甲醇提取,经UPLC分析发现色谱峰很多,有些杂质峰与目标成分色谱峰无法分离,分析其原因是由于样品中的部分脂类成分等物质被甲醇提取出来,对被测物造成一定干扰,且极性小的脂溶性成分会附着在色谱柱的硅胶键合相上,难以洗脱完全,对专用的色谱柱造成一定的损害。故在用甲醇提取前先加除脂溶剂乙醚,以除去绝大多数的脂类物质,减免干扰峰的出现,使各目标成分与其他杂质峰具有较好的分离度,测定准确,并且提前除杂对色谱柱起到了保护作用。
3.2 ASE的使用目的与除脂类物质最佳条件考察提取川西獐牙菜中有效成分的常规方法有超声法、加热回流法等,而这些方法有的是一次性提取1 h以上,有的是经多次提取后合并滤液,提取时间同样是至少1 h,再加上水浴回流除脂1 h以上至少要2 h,操作烦琐、费时,且多次提取在转移残渣时易造成损失。本文使用ASE多组分高效萃取技术,一方面,通过在线净化和在线提取,整个试验过程均只在1个萃取池中进行,不仅很好地避免了因重复提取转移残渣时造成的损失,而且还免去了后续的净化过程;另一方面,该仪器可设定温度和压力,在高压条件下被分析物溶解性增加,降低溶剂粘度有利于溶剂分子向基质中扩散,缩短提取时间,本试验连同除脂和提取目标成分一共30 min,极大地提高了提取效率,此外溶剂用量也很少。
利用SPSS16.0统计软件,对川西獐牙菜除去脂类成分的最佳条件统计分析,进行正交试验设计。以提取出的脂类物质得率为评价指标,考察了提取溶剂、静置提取时间和循环提取次数。由于各单因素之间有相互交叉影响,在单因素试验的基础上设计了三因素三水平L9(34)正交试验。由结果可知最佳提取工艺为:用乙醚静置提取8 min,循环提取1次时除去脂类物质效率最高。
试验时还考察了乙醚除脂对有效成分含量的影响。待最佳除脂条件和最佳有效成分提取条件确定后,将用乙醚除脂后再用甲醇提取和直接用甲醇提取的两组样品溶液中的6个有效成分含量进行独立样本t检验,结果两组数据之间显著性概率P > 0.05,均不具有显著性差异,说明该除脂条件不会引起6个被测有效成分的损失。
3.3 提取条件的优化以6个主要有效成分各自的含量为评价指标,由单因素循环试验结果可知:
(1)最佳提取温度。獐牙菜苷在80 ℃条件下含量最高,异荭草苷在60 ℃条件下含量最高,而其余几种成分均在70 ℃条件下含量最高。由于獐牙菜苷在70 ℃和80 ℃,异荭草苷在60 ℃和70 ℃测得含量无显著性差异(P > 0.05),又考虑到试验条件的一致性,确定最佳提取温度为70 ℃;(2)最佳提取时间。异荭草苷和异牡荆素在提取10 min时含量最高,而其余几种成分在提取15 min时含量最高。由于异荭草苷和异牡荆素在提取10 min和15 min时测得含量无显著性差异(P > 0.05),确定最佳提取时间为15 min;(3)最佳循环提取次数。除了龙胆苦苷和芒果苷需要循环提取3次即可达到含量最高外,其余4种有效成分均在循环提取2次时含量最高,而龙胆苦苷和芒果苷在循环提取2次和3次时测得含量无显著性差异(P > 0.05),确定最佳循环提取次数为2次。综上所述,最佳提取工艺为用甲醇在70 ℃下静置提取15 min,循环提取2次。
3.4 有效成分的数据分析由实验测定结果可知:(1)青海川西獐牙菜中,苦苷类成分中龙胆苦苷含量最高,黄酮类成分中主要是芒果苷;(2)青海同一地区内的两类成分的总量差别不大,但同一类成分中每个目标成分差异显著,尤其是玉树不同地区的苦苷类成分总量差异较大。
3.5 结论UPLC通过现代各种技术的综合运用,已被广泛应用于中药复方成分的分析,特别是同时对多种成分进行分析时能大大缩短分析时间。本方法简单,灵敏度高,分析时间短,重复性好,适用于同时测定川西獐牙菜中苦苷类成分和黄酮类成分的含量,可作为川西獐牙菜的质量控制方法。
| [1] |
贾敏如, 李星炜. 中国民族药志要[M]. 北京: 中国医药科技出版社, 2005, 591. JIA MR, LI XW. Ethnodrug of China[M]. Beijing: China Medical Science Press, 2005, 591. |
| [2] |
郭爱华. 龙胆科獐牙菜属药用植物化学成分和药理作用的研究进展[J]. 山西中医学院学报, 2005, 1(6): 57. GUO AH. Advances in chemical constituents and pharmacology of Swertia L.in Gentianaceae[J]. J Shanxi Coll Tradit Chin Med, 2005, 1(6): 57. |
| [3] |
中国科学院中国植物志编辑委员会. 中国植物志[M]. 第62卷. 北京: 科学出版社, 1988, 400. Flora of China Committee, Chinese Academy of Sciences. Flora of China[M]. Vol 62. Beijing: Science Press, 1988, 400. |
| [4] |
周永福, 黄飞燕, 文荣荣, 等. 川西獐牙菜的化学成分研究[J]. 云南民族大学学报(自然科学版), 2011, 20(1): 14. ZHOU YF, HUANG FY, WEN RR, et al. Studies on chemical constituents in Swertia mussotii Franch[J]. J Yunnan Univ Natl(Nat Sci Ed), 2011, 20(1): 14. |
| [5] |
孟宪华, 陈德道, 张樱山, 等. 川西獐牙菜的化学成分、药理作用和临床应用研究进展[J]. 现代药物与临床, 2012, 27(2): 176. MENG XH, CHEN DD, ZHANG YS, et al. Research progress on chemical constituents, pharmacological actions, and clinical applications of Swertia mussotii[J]. Drug Clin, 2012, 27(2): 176. |
| [6] |
朱钰叶, 张喜德, 张洪泉. 藏药獐牙菜属植物的药理研究进展[J]. 中国野生植物资源, 2008, 27(1): 5. ZHU YY, ZHANG XD, ZHANG HQ. Research progress on pharmacological actions of Tibetan folk medicine Swertia L[J]. Chin Wild Plant Resour, 2008, 27(1): 5. |
| [7] |
孙洪发, 胡伯林, 丁经业, 等. 川西獐牙菜甙类成分[J]. 植物学报, 1991, 33(1): 31. SUN HF, HU BL, DING JY, et al. The glucosides from Swertia mussotii Franch[J]. Acta Bot Sin, 1991, 33(1): 31. |
| [8] |
马徐, 刘越, 冯晓晓, 等. 藏茵陈川西獐牙菜的生物学研究进展[J]. 中华中医药杂志, 2016, 31(3): 948. MA X, LIU Y, FENG XX, et al. Biological research progress of Swertia mussotii Franch as a famous Tibetan medicine[J]. China J Tradit Chin Med Pharm, 2016, 31(3): 948. |
| [9] |
井灵. 藏药川西獐牙菜醇提物正丁醇萃取部位化学成分的研究[D]. 西宁: 青海师范大学, 2015 JING L.Studies on Chemical Constituents in n-Butanol Extract of Methanolic Extract from Tibetan Folk Medicine Swertia mussotii Franch.[D].Xining:Qinghai Normal University, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10746-1015661595.htm |
| [10] |
杨红霞, 马芳, 杜玉枝, 等. 藏药川西獐牙菜及其不同提取物的红外光谱分析[J]. 光谱学与光谱分析, 2014, 34(11): 2973. YANG HX, MA F, DU YZ, et al. Analysis of infrared spectrum of Swertia mussotii Franch and its different extracts[J]. Spectrosc Spect Anal, 2014, 34(11): 2973. DOI:10.3964/j.issn.1000-0593(2014)11-2973-05 |
| [11] |
江莉, 臧立华, 刘广华, 等. 川西獐牙菜甲醇提取物的气相色谱-质谱分析[J]. 山东大学学报(理学版), 2005, 40(6): 117. JIANG L, ZANG LH, LIU GH, et al. Analysis of methanol-soluble components of Swertia mussotii Franch by gas chromatography-mass spectrometry[J]. J Shandong Univ(Nat Sci), 2005, 40(6): 117. |
| [12] |
马丽娜, 张铁军, 田成旺, 等. 大孔树脂分离纯化川西獐牙菜中环烯醚萜苷类和口山酮类成分的工艺研究[J]. 中草药, 2010, 41(2): 227. MA LN, ZHANG TJ, TIAN CW, et al. Purification technology of iridoid glycosides and xanthones from Swertia mussotii by macroporous resin[J]. Chin Tradit Herb Drugs, 2010, 41(2): 227. |
| [13] |
雷宇佳, 高明哲, 王莉, 等. 制备型高效液相色谱法分离纯化川西獐牙菜提取物中的龙胆苦苷[J]. 色谱, 2010, 28(9): 902. LEI YJ, GAO MZ, WANG L, et al. Preparation of gentiopicroside from the extract of Swertia mussotii Franch by preparative high performance liquid chromatography[J]. Chin J Chromatogr, 2010, 28(9): 902. |
| [14] |
袁叶飞, 胡祥宇. 川西獐牙菜中芒果苷的提取分离研究[J]. 时珍国医国药, 2009, 20(8): 1840. YUAN YF, HU XY. Research on extraction and separation of mangiferin in Swertia Mussotii Franch[J]. Lishizhen Med Mater Med Res, 2009, 20(8): 1840. |
| [15] |
李玥, 邹爱英. 液相色谱-质谱联用同时测定藏茵陈中的6种有效成分[J]. 天津药学, 2016, 28(1): 8. LI Y, ZOU AY. Simultaneous determination of six active ingredients in Swertia mussotii Franch by HPLC-ESI/MS[J]. Tianjin Pharm, 2016, 28(1): 8. |
| [16] |
卢永昌, 林鹏程, 李连隆. HPLC测定青海不同地区川西獐牙菜活性成分的含量[J]. 中成药, 2009, 31(10): 1558. LU YC, LIN PC, LI LL. Determination of active ingredients in Swertia mussotii Franch from different regions of Qinghai by HPLC[J]. Chin Tradit Pat Med, 2009, 31(10): 1558. DOI:10.3969/j.issn.1001-1528.2009.10.023 |
 2017, Vol. 37
2017, Vol. 37 
