β-内酰胺类抗生素中的聚合物是诱发过敏反应的重要过敏源[1-4],为保证药品的安全性,中国药典对其进行严格的控制[5]。随着色谱分离技术的发展,聚合物的质控手段也越来越多样化[6-7],由早期的葡聚糖凝胶G10柱(Sephadex G10)系统[8-13]发展到了高效凝胶色谱柱系统[14-25]。中国药典2015年版已采用TSKgel色谱柱对头孢米诺、头孢地嗪等头孢菌素类药物中的聚合物杂质进行控制。常用的凝胶介质有葡聚糖、琼脂糖、亲水性多孔硅胶和乙烯共聚体等基质。目前文献报道的用于水溶性β-内酰胺类抗生素聚合物分析的高效凝胶填料有Superdex peptide(葡聚糖交联琼脂糖)、TSK G2000SW(亲水性多孔硅胶)、TSK-GEL PW系列(亲水性多孔刚性聚合物)等[26-27],其均富含羟基等亲水基团,能够与溶质的极性基团产生特异性相互作用,但由于凝胶介质除了具有分子排阻作用外,还产生吸附、疏水等非排阻作用,不同凝胶介质的非排阻作用的不同使得其对聚合物分离的专属性具有明显差异[27]。
阿莫西林克拉维酸钾是临床上广泛使用的含酶抑制剂的阿莫西林复方制剂,时有其在临床中诱发过敏反应的不良报道[28-30],因此对此类复方制剂中的聚合物控制越来越受到关注。中国药典2015年版[5]、英国药典(BP 2016)[31]、美国药典(USP 39)[32]均收载了阿莫西林克拉维酸钾的复方制剂。中国药典2015年版采用Sephadex G10色谱系统对阿莫西林原料中的聚合物进行了控制,但对阿莫西林克拉维酸钾复方制剂未收载聚合物分析方法,在有关物质测定项下,也未将聚合物作为特定杂质进行质控;英国药典(BP 2016)和美国药典(USP 39)在有关物质项下,将阿莫西林二聚体作为特定杂质进行控制,但仅控制二聚体,能否全面控制各类聚合物杂质未见文献报道。因此急需建立一种有效的方法对阿莫西林克拉维酸钾复方制剂中的聚合物杂质进行控制。文献报道,Sephadex G10和TSK G2000SW色谱系统均不适宜分析青霉素类抗生素与克拉维酸钾复方制剂中的聚合物杂质,TSK2500 PWxl型高效凝胶柱可用于此类制剂中的聚合物杂质分析[26],但文献对方法的专属性缺乏系统的研究。本文拟综合运用高效凝胶排阻色谱法(HPSEC法)、二维高效液相色谱法(2D-HPLC法)[13]、柱切换-LC-MS法[33]等现代色谱技术,对基于TSK2500 PWxl型高效凝胶柱的HPSEC方法的专属性进行系统的研究,同时对利用药典中有关物质分析方法控制聚合物杂质的可行性进行评价,进而确立方便、准确及专属性强的测定阿莫西林克拉维酸钾复方制剂中聚合物的分析方法。
1 材料与方法 1.1 仪器HPLC-UV色谱系统由Ultimate 3000型四元低压梯度泵、U3000型自动进样器、U3000型柱温箱、及4波长UV检测器组成,工作站为Chromeleon 6.8版(DIONEX公司);二维色谱系统为Summit 100型,包括P680型双三元低压梯度泵、ACI-100型自动进样器、Tcc-100型柱温箱及PDA-100型二极管阵列检测器组成,工作站为Chromeleon 6.8版(DIONEX公司);柱切换LC-MS系统由HPLC色谱系统(包括NanoSpace S1-2二元高压梯度泵、自动进样器、柱温箱、切换阀和PDA检测器;日本资生堂公司)和Qtrap 3200型MS/MS质谱仪(ABsiecx公司)组成,工作站为Analyst 1.6版。TSK-gel G2500PWxl色谱柱(7.8 mm×30 cm;填料:刚性、球形、亲水的多孔甲基丙烯酸酯;日本TOSOH公司),Thermal BDS HYPERSIL C18色谱柱(4.6 mm×250 mm,5 μm;填料:碱性去活十八烷基硅烷键合硅胶;Thermal公司),Prodigy 5u ODS 100A色谱柱(4.6 mm×150 mm,5 μm;填料:十八烷基硅烷键合硅胶,纯度99.999%;菲罗门公司)。
1.2 样品与试剂阿莫西林克拉维酸钾系统适用性对照品(批号130588-201202)、α-对羟基苯甘氨酸对照品(批号130435-200502,含量为99.4%)由中国食品药品检定研究院提供;阿莫西林克拉维酸钾(2:1)原料(批号B324458AA、B303454AA、B306095AA)、阿莫西林钠克拉维酸钾(5:1)原料(批号B289765、B289767、B289768)、阿莫西林钠克拉维酸钾(5:1)近效期原料(批号B230951)由北京托普高端化工产品有限责任公司提供。注射用阿莫西林钠过效期样品(批号230951,湖北威尔曼制药有限公司生产)由中国食品药品检定研究院提供。
乙腈为色谱纯,其他化学试剂均为分析纯,水为实验室自制双蒸水。
1.3 HPSEC法采用TSK-gel G2500PWxl色谱柱(7.8 mm×30 cm),流动相A为磷酸盐缓冲液(pH 7.0)[0.1 mol·L-1磷酸氢二钠溶液-0.1 mol·L-1磷酸二氢钠溶液(61:39)],流动相B为乙腈,梯度洗脱(0~15.0 min,维持100%的流动相A;15.0~20.0 min,流动相A降低至10%;20.0~30.0 min,维持流动相A为90%;30.0~31.0 min,恢复流动相A至100%;31.0~50.0 min,维持流动相A为100%),流速0.7 mL·min-1,检测波长220 nm,柱温30 ℃,进样量20 μL。稀释溶剂:0.01 mol·L-1的磷酸二氢钾缓冲液(用2 mol·L-1氢氧化钠溶液调节pH至6.0);样品溶液浓度:4.0 mg·mL-1。用于HPSEC法分析聚合物杂质。
1.4 RP-HPLC优化法采用Thermal BDS HYPERSIL C18色谱柱(4.6 mm×250 mm,5 μm),流动相A为0.01 mol·L-1磷酸二氢钾溶液(用2 mol·L-1氢氧化钠溶液调节pH至6.0),流动相B为0.01 mol·L-1磷酸二氢钾溶液(用2 mol·L-1氢氧化钠溶液调节pH至6.0)-乙腈(20:80),梯度洗脱(0~12.0 min,维持98%的流动相A;12.0~32.0 min,流动相A降低至70%;32.0~42.0 min,降低流动相A为0%;42.0~52.0 min,维持流动相A为0%;52.0~53.0 min,升高流动相A至98%;53.0~70.0 min,维持流动相A为98%),流速1.0 mL·min-1,柱温30 ℃,检测波长230 nm。用于比较评价中国药典2015年版有关物质方法对聚合物的分离分析能力。
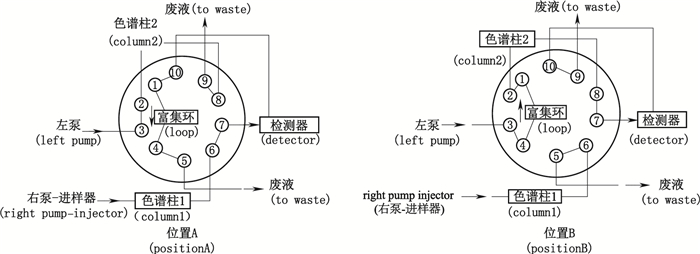
1.5 2D-HPLC法色谱系统Ⅰ同“1.4”项RP-HPLC优化法;色谱系统Ⅱ(中国药典2015年版有关物质方法)[5]:采用Thermal BDS HYPERSIL C18色谱柱(4.6 mm×250 mm,5 μm),流动相A为0.01 moL·L-1磷酸二氢钾溶液(用2 mol·L-1氢氧化钠溶液调节pH至6.0),流动相B为0.01 mol·L-1磷酸二氢钾溶液(用2 mol·L-1氢氧化钠溶液调节pH至6.0)-乙腈(20:80),梯度洗脱(0~12.0 min,维持98%的流动相A;12.0~32.0 min,流动相A降低至70%;32.0~34.0 min,升高流动相A为98%;34.0~55.0 min,维持流动相A为98%),流速1.0 mL·min-1,柱温30 ℃,检测波长230 nm。切换阀的连接方式如图 1所示[33],切换程序:①将切换阀设为A位置,采用右泵,以TSK凝胶色谱系统(色谱系统Ⅰ)对样品进行分离,同时采用色谱系统Ⅱ对RP C18色谱柱进行平衡;②当采用色谱系统Ⅰ分离的目标杂质出峰后,将切换阀设为B位置;③采用色谱系统Ⅱ将柱后定量环中的目标杂质洗脱至第2根色谱柱中,并采用色谱系统Ⅱ进行分离分析。用于对HPSEC色谱系统分离的聚合物杂质在RP-HPLC色谱系统中进行定位。
|
图 1 2D-HPLC中10孔切换阀示意图 Figure 1 Schemes of the column-switching HPLC. |
色谱系统Ⅲ同色谱系统Ⅱ;色谱系统Ⅳ:采用Prodigy 5u ODS 100A(4.6 mm×150 mm,5 μm)色谱柱,流动相A为含有1%甲酸的水溶液,流动相B为含有1%甲酸的乙腈溶液,梯度洗脱(0~6.7 min,维持100%的流动相A(脱盐处理);6.7~30.0 min,将流动相A降低至10%;30.0~40 min,维持流动相A为10%;40.0~41.0 min,升高流动相A至100%;41.0~55.0 min,维持流动相A 100%),流速0.5 mL·min-1,柱温为室温;切换阀为六通阀A和B,切换用定量环体积500 µL。用于对高聚合态聚合物进行定性研究。
1.7 溶液配制阿莫西林克拉维酸钾系统适用性对照品溶液:取阿莫西林克拉维酸钾系统适用性对照品适量,加0.01 mol·L-1的磷酸二氢钾缓冲液(pH 6.0)溶解并稀释制成每1 mL中约含2.5 mg的溶液,即得。
阿莫西林克拉维酸钾(2:1)原料样品溶液:取阿莫西林克拉维酸钾(2:1)原料约30 mg,加0.01 mol·L-1的磷酸二氢钾缓冲液(pH 6.0)溶解并稀释制成每1 mL中约含阿莫西林2.5 mg的溶液,即得。
阿莫西林克拉维酸钾(5:1)原料样品溶液:取阿莫西林克拉维酸钾(5:1)原料约24 mg,加0.01 mol·L-1的磷酸二氢钾缓冲液(pH 6.0)溶解并稀释制成每1 mL中约含阿莫西林2.5 mg的溶液,即得。
阿莫西林克拉维酸钾聚合物混合溶液:称取阿莫西林钠克拉维酸钾原料(5:1)近效期样品约3.0 g,置10 mL量瓶中,加10 mL水溶解,常温条件下放置72 h后,取1 mL置100 mL的量瓶中,加0.01 mol·L-1的磷酸二氢钾缓冲液(pH 6.0)稀释至刻度,质量浓度约为2.5 mg·mL-1,作为阿莫西林克拉维酸钾聚合物混合溶液。
阿莫西林钠聚合物混合溶液:称取注射用阿莫西林钠过效期样品约2.5 g(置10 mL量瓶中,加10 mL蒸馏水溶解,常温条件下放置72 h后,取1 mL置100 mL的量瓶中,加0.01 mol·L-1的磷酸二氢钾缓冲液(pH 6.0)稀释至刻度,质量浓度约为2.5 mg·mL-1,作为阿莫西林钠聚合物混合溶液。
2 结果与讨论 2.1 建立阿莫西林克拉维酸钾中聚合物杂质分析用HPSEC法本文在文献[26]的基础上,对HPSEC法的色谱条件进行了进一步研究,主要包括流动相的种类与洗脱程序、检测波长和样品稀释用溶剂等三方面因素。
2.1.1 流动相的选择基于凝胶色谱柱填料的特性以及阿莫西林和克拉维酸钾均为离子型化合物的结构特点,分别选用pH 5.0、pH 6.0、pH 7.0磷酸盐缓冲液[0.1 mol·L-1磷酸氢二钠溶液-0.1 mol·L-1磷酸二氢钠溶液(61:39)] 3种流动相等度洗脱,测定阿莫西林克拉维酸钾(5:1)原料样品溶液的聚合物,如图 2所示。结果显示,随缓冲液pH的增加,分离得到的杂质峰数目增多,阿莫西林主峰、克拉维酸钾主峰与邻近杂质的分离度明显提高,说明高pH的缓冲溶液更有利于聚合物的分离。
|
图 2 不同pH的0.1 mol·L-1缓冲液条件下的液相色谱图 Figure 2 HPLC chromatograms in 0.1 mol·L-1 buffer with different pH values |
图 2显示,在阿莫西林主峰后尚有杂质峰检出,为了改善这些杂质峰的峰形,缩短出峰时间,在阿莫西林主峰后采用梯度洗脱。
2.1.2 检测波长的选择设定220、230、254、270 nm 4个波长,同时对阿莫西林克拉维酸钾(5:1)原料样品溶液进行测定,如图 3所示。在220、230 nm波长处阿莫西林、克拉维酸及克拉维酸主峰前杂质峰的响应最强,在254 nm和270 nm波长处克拉维酸的响应较弱。由于体现阿莫西林结构的最大特征吸收波长为220 nm和275 nm,同时参考中国药典[5]阿莫西林克拉维酸钾制剂有关物质的检测波长(230 nm)和文献资料报道[26]的检测波长(220 nm),最终选定220 nm为检测波长。
|
图 3 不同检测波长条件下的色谱图 Figure 3 Typical chromatograms in different detective wavelength |
阿莫西林和克拉维酸钾在酸性条件下和碱性条件下均易发生降解反应,因此选择一种合适的样品溶剂对于保持样品溶液的稳定性尤为重要。为此,本研究分别采用了0.01mol·L-1的pH 7.0缓冲液、0.05 mol·L-1的pH 7.0缓冲液、0.1 mol·L-1的pH 7.0缓冲液,发现在pH 7.0条件下,样品的稳定性较差,在0.5 h内会发生明显的降解反应,溶液颜色由无色变为深红色。参考中国药典2015年版二部[5]中阿莫西林克拉维酸钾片剂的有关物质方法,最后决定采用0.01 mol·L-1的pH 6.0的磷酸二氢钾缓冲液作为稀释溶剂,该溶液在4 ℃条件下,可以保持稳定4 h,同时样品的溶解度可以达到4.0 mg·mL-1,不需要碳酸钠作为助溶剂。
基于以上参数的重新考察与优化,本文建立了阿莫西林克拉维酸钾中聚合物杂质分析用HPSEC法,具体的色谱条件参见仪器与方法部分。与文献报道的方法[26]相比,本方法着重提高了对阿莫西林主峰后杂质的洗脱能力,同时对样品溶液的稳定性条件进行了新的探索。
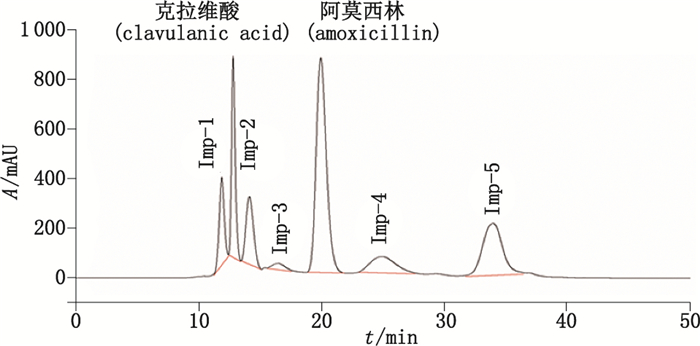
2.2 2D-HPLC法分析HPSEC法分离聚合物杂质的专属性为了考察HPSEC法分离聚合物杂质的专属性,本文选取了明确含有阿莫西林二聚体和三聚体的阿莫西林克拉维酸钾系统适用性对照品作为样品,采用建立的HPSEC法进行分析,记录色谱图,如图 4所示。
|
图 4 HPSEC法分析阿莫西林克拉维酸钾系统适用性对照品的典型色谱图 Figure 4 Typical chromatogram of the amoxicillin and potassium clavulanate system standard by HPSEC method |
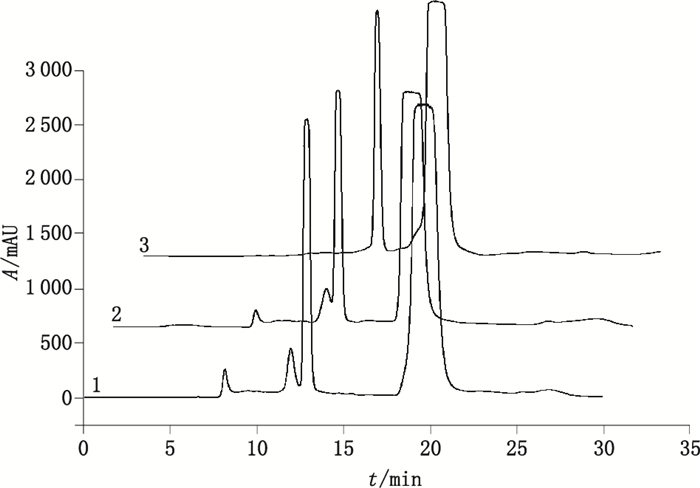
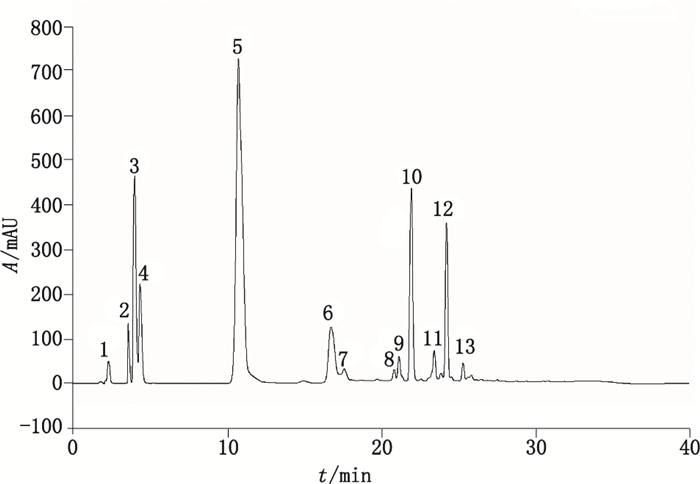
在图 4中除了克拉维酸和阿莫西林的色谱峰外,还检出5个杂质峰,分别为Imp-1~Imp-5。其中,在克拉维酸主峰的两侧存在2个杂质Imp-1和Imp-2,在阿莫西林主峰后面,还存在2个展宽严重的杂质峰Imp-4和Imp-5。
按照分子排阻色谱法的分离特性,理论上出峰顺序是按照分子量由大至小排列。阿莫西林主峰前的杂质一般为聚合物峰,但不排除极性较强但分子量小于阿莫西林的开环物等杂质在阿莫西林主峰前出峰[27]。主峰后理论上应为分子量小于阿莫西林的小分子杂质峰。为了进一步确认HPSEC色谱系统中聚合物的出峰位置,本文通过2D-HPLC法对阿莫西林克拉维酸钾系统适用性对照品展开研究,确定聚合物的位置,再对样品进行分析,控制其聚合物的含量。
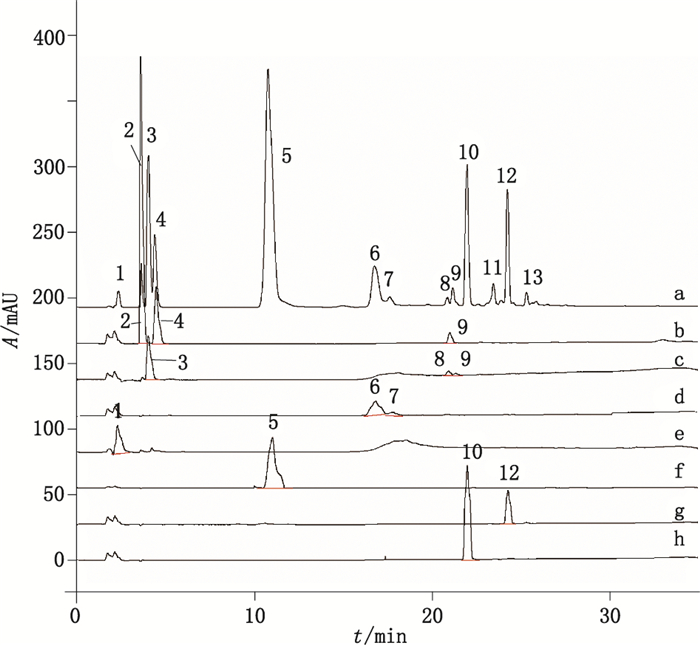
2.2.1 2D-HPLC法归属HPSEC法分离的各杂质峰采用上述的2D-HPLC方法,按照表 1中的2D-HPLC色谱条件在规定的时间点,将阿莫西林克拉维酸钾系统适用性对照品和HPSEC法分离得到的7个色谱峰进行切换分析,记录色谱图,如图 5和图 6所示,归属各杂质峰。通过以上的二维色谱法分析发现,在G2500PWxl色谱系统下,阿莫西林的聚合物杂质并非按照分子筛的原理在阿莫西林主峰前出峰,而是开环二聚体与克拉维酸色谱峰的保留时间相同,闭环二聚体则在主峰后保留时间约为26.0 min处出峰。即G2500PWxl色谱系统并不是单纯按分子筛原理分离的色谱系统,其中还有反相吸附色谱的特征。另外,Imp-4(阿莫西林闭环二聚体)的色谱峰半峰宽长达4 min,对聚合物杂质的定量分析存在严重的影响。研究结果提示TSKPW系列色谱柱对青霉素类抗生素聚合物分离的的专属性较差。
|
|
表 1 二维色谱法归属阿莫西林克拉维酸钾系统适用性对照品在HPSEC系统的色谱峰 Table 1 Specification of the peaks in amoxicillin and clulvanate potassium systematic standardin HPSEC system by application of the two-dimensional chromatographic method |
|
2,4.噻唑酸(penicilloic acids of amoxicillin)3.克拉维酸(clavulanic acid)5.阿莫西林(amoxicillin)9.阿莫西林开环二聚体(amoxicillin ring-opened dimer)10.阿莫西林二酮哌嗪(amoxicillin diketopiperazine)12.阿莫西林闭环二聚体(amoxicillin ring-closed dimer)13.阿莫西林开环二聚体(amoxicillin ring-closed trimer)其他为未知峰(The other was unknown peak) 图 5 阿莫西林克拉维酸钾系统适用性对照品在切换模式下的典型色谱图 Figure 5 Typical chromatogram of amoxicillin and potassium clavalanate systematic standard under column-switching condition |
|
a.阿莫西林克拉维酸钾系统适用性对照品(amoxicillin and clavulanate systematic standard)b. Imp-1 c.克拉维酸(clavulanic acid)d. Imp-2 e. Imp-3 f.阿莫西林(amoxicillin)g. Imp-4 h. Imp-5 图 6 HPSEC图中7个色谱峰与系统适用性对照品的典型切换色谱图比较 Figure 6 Typical column-switching chromatogramic comparision of seven peaks in HPSEC chromatogram and systematic standard |
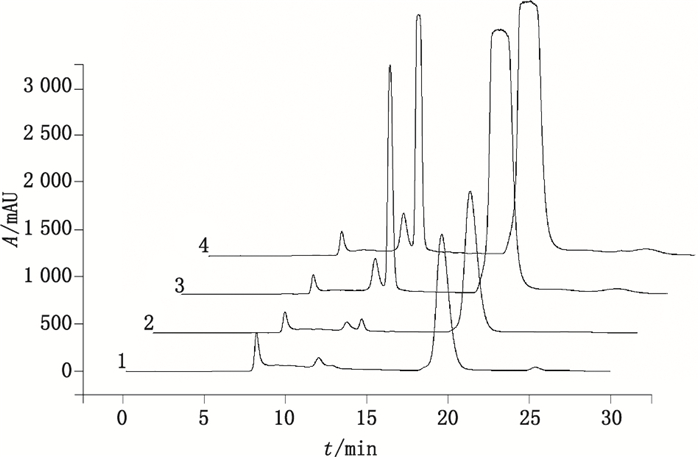
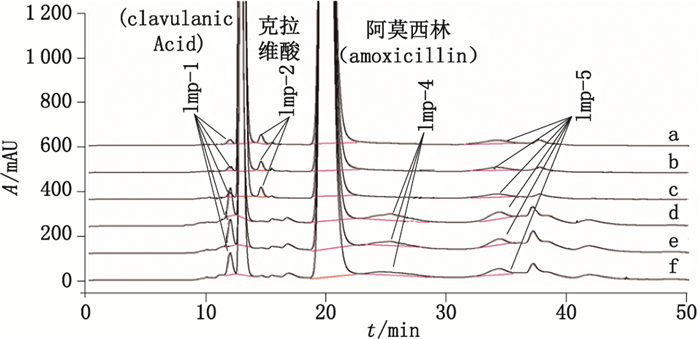
采用上述HPSEC方法,分别对3批阿莫西林克拉维酸钾(2:1)样品和3批阿莫西林克拉维酸钾(5:1)样品进行分析,结果表明,该6批样品的聚合物杂质均无法进行有效质控,原因与系统适用性对照品的情况一致,即聚合物的色谱峰严重展宽,无法有效准确定量计算。相关色谱图参见图 7。阿莫西林克拉维酸钾(2:1)样品色谱图中的Imp-2,经对羟基苯甘氨酸对照品添加试验,证明的其为对羟基苯甘氨酸。
|
a,b,c.阿莫西林(amoxicillin)-克拉维酸钾(potassium clavalanate)(2:1)d,e,f.阿莫西林(amoxicillin)-克拉维酸钾(potassium clavalanate)(5:1) 图 7 阿莫西林克拉维酸钾原料的典型HPSEC色谱图 Figure 7 Typical HPSEC chromatograms of amoxicillin and potassium clavalanate raw material |
前述研究表明,HPSEC法无法有效对阿莫西林克拉维酸钾中的聚合物进行质控。中国药典2015年版二部中的阿莫西林克拉维酸钾制剂的有关物质项下的RP-HPLC法,能够有效对阿莫西林开环二聚体、闭环二聚体、闭环三聚体进行分离,说明该方法具有一定的聚合物质控能力,但是,该方法能否对更高聚合态的聚合物进行质控仍需要方法验证。
2.3.1 建立聚合物验证用优化RP-HPLC法为了验证中国药典2015年版二部收载的有关物质方法对聚合物的分离检测能力,同时也对阿莫西林克拉维酸钾原料样品中的更高聚合态聚合物进行检测,本研究在现有的RP-HPLC方法的基础上,继续加大色谱系统的有机相比例,将有机相乙腈的洗脱比例由28%提高至80%,梯度洗脱程序参见仪器与方法部分,建立了聚合物验证用优化RP-HPLC方法。
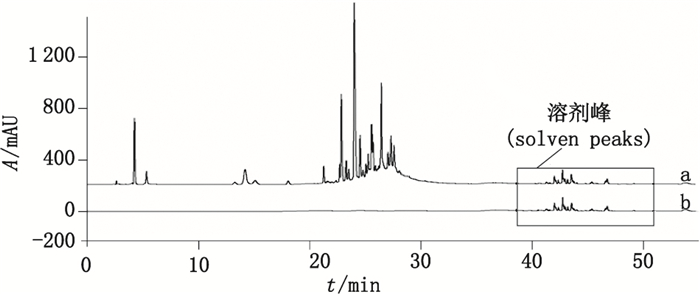
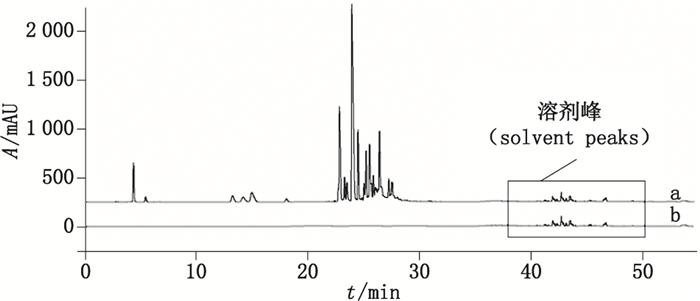
为了获得更高聚合度的聚合物杂质,参考文献[3],制备了阿莫西林聚合物混合溶液及阿莫西林克拉维酸钾聚合物混合溶液。采用上述验证用RP-HPLC方法,分别对空白溶剂、阿莫西林聚合物混合溶液、阿莫西林克拉维酸钾聚合物混合溶液进行分析,结果参见图 8、9。结果表明,所有聚合物杂质均在32 min之前出峰,在扩展的洗脱程序32~52 min期间未检出任何杂质,这说明中国药典2015年版二部收载的RP-HPLC法能够检出全部的聚合物杂质。
|
图 8 阿莫西林聚合物混合溶液(a)及空白溶剂(b)的典型色谱图 Figure 8 Typical RP-HPLC chromatogram of amoxicillin mixed polymer solution(a)and blank solution(b) |
|
图 9 阿莫西林克拉维酸钾聚合物混合溶液(a)及空白溶剂(b) Figure 9 Typical RP-HPLC chromatogram of amoxicillin and potassium clavulanate mixed polymer solution(a)and blank solution(b) |
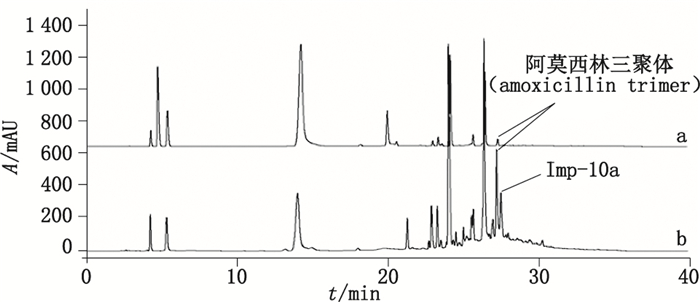
上述实验表明,在阿莫西林聚合物混合溶液和阿莫西林克拉维酸钾聚合物混合溶液中,均检出了大量的杂质峰,经与阿莫西林克拉维酸系统适用性对照品的色谱图比较,可见在保留时间为27.6 min处检出了比阿莫西林闭环三聚体保留时间还长的杂质Imp-10a以及若干小杂质(图 10),初步推测这些杂质峰为阿莫西林的更高聚合态的杂质。本研究通过柱切换LC-MS法对未知的聚合物杂质Imp-10a的结构进行推断。
|
图 10 系统适用性对照品(a)与阿莫西林克拉维酸钾聚合物(b)的典型色谱图 Figure 10 Typical RP-HPLC chromatograms of systematic suitability standard solution(a)and amoxicillin and potassium clavulanate mixed polymer solution(b) |
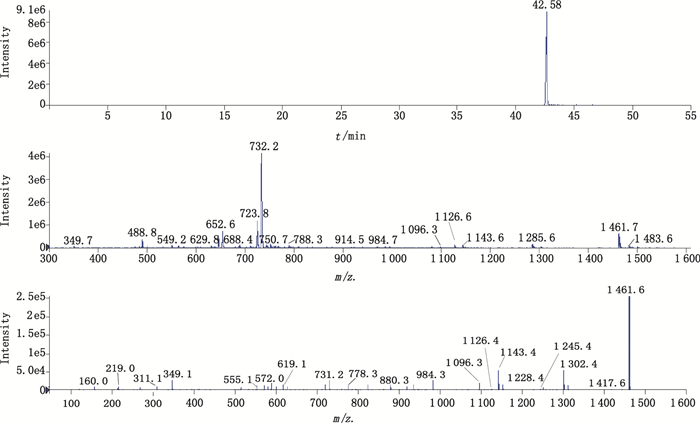
采用上述的柱切换LC/MS方法,对杂质Imp-10a进行质谱分析,其选择性离子流色谱(XIC)图、正离子增强母离子扫描(+EMS)图及正离子增强子离子扫描(+EPI)@m/z 1461.5 [M+H]的二级质谱如图 11所示。
|
图 11 阿莫西林克拉维酸钾聚合物溶液中杂质Imp-10a的质谱图 Figure 11 Typical LC-MS chromatograms of Imp-10a in amoxicillin and potassium clavulanate mixed polymer solution |
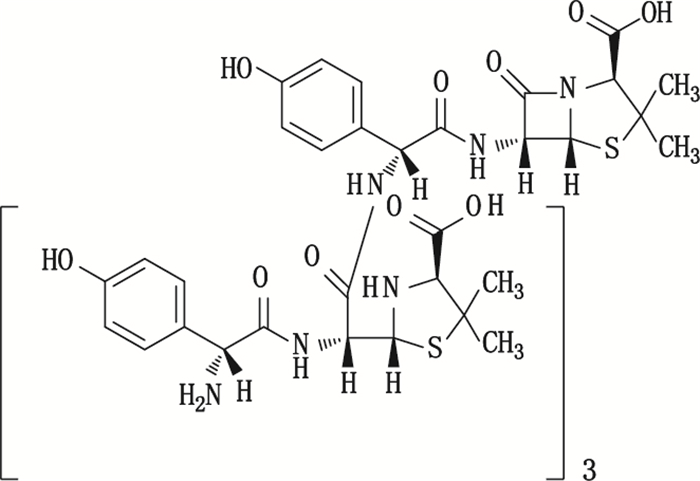
在杂质Imp-10a的+EMS图中给出了m/z 1 461.7、m/z 1 483.6、m/z 732.2的离子,推测分别为杂质Imp-10a的[M+H]+、[M+Na]+和[M+2H]2+峰,说明杂质Imp-10a的相对分子质量为1 460.7,为阿莫西林相对分子质量的4倍。在二级质谱中存在m/z 1 302.4、m/z 1 143.4、m/z 984.3以及m/z 825.4的碎片离子则说明分子中存在4个159 Da的青霉素母核。而m/z 1 096.3、m/z 731.2的碎片推测为聚合位点的酰胺键断裂形成的三聚体和二聚体碎片。因此推测为杂质Imp-10a为阿莫西林的闭环四聚体。化学结构参见图 12。
|
图 12 杂质Imp-10a的推测化学结构式 Figure 12 The deduced chemical structure of Imp-10a |
柱切换-LC-MS法的结果显示,阿莫西林克拉维酸钾聚合物溶液中的杂质Imp-10a为阿莫西林闭环四聚体,进一步证明了采用中国药典2015年版二部收载的有关物质方法对高聚合态的聚合物杂质进行质控是可行的。
2.4 样品测定采用上述方法对6批样品中的聚合物杂质进行分析,典型色谱图如图 13所示,聚合物杂质含量参见表 2,其中杂质Imp-9号为阿莫西林闭环二聚体。杂质6和杂质10分别为开环二聚体和闭环三聚体。
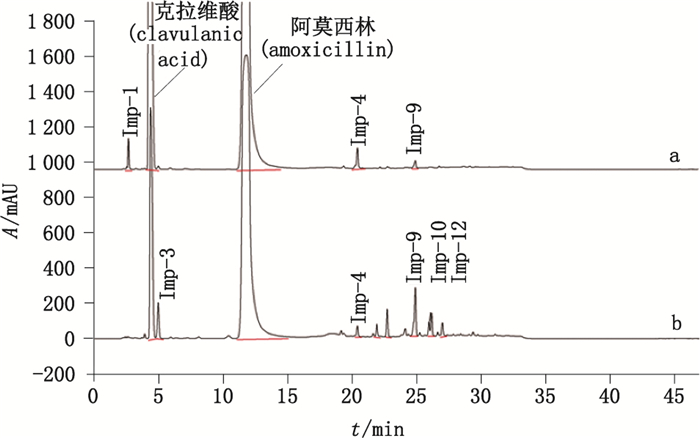
|
图 13 阿莫西林克拉维酸钾(2:1)原料(a)及阿莫西林克拉维酸钾(5:1)原料(b)的典型色谱图 Figure 13 Typical RP-HPLC chromatograms of amoxicillin and potassium clavulanate(2:1)raw material(a)and amoxicillin and potassium clavulanate(5:1)raw material(b) |
|
|
表 2 阿莫西林克拉维酸钾原料的聚合物分析结果(%) Table 2 Assay of polymer impurities in amoxicillin and potassium clavulanate raw materials |
由实验结果可知,在3批阿莫西林克拉维酸钾(2:1)原料的色谱图中,均只检出1种聚合物杂质,即闭环二聚体,未检出开环二聚体、闭环三聚体和闭环四聚体以及更高聚合态的聚合物杂质;含量范围0.11%~0.15%;在3批阿莫西林钠克拉维酸钾(5:1)原料的色谱图中,均检出2种聚合物杂质,分别为闭环二聚体和闭环三聚体,未检出开环二聚体、闭环三聚体和闭环四聚体以及更高聚合态的聚合物杂质;聚合物总量范围0.76%~0.79%。表 2中各杂质的含量为以阿莫西林对照品经外标法计算得到的各杂质占样品中阿莫西林的百分比,因未检出克拉维酸的相关杂质,故克拉维酸不参与杂质含量的计算。
3 结论本文综合运用HPSEC法、2D-HPLC法、柱切换-LC-MS法等现代色谱分析技术,充分证明了基于TSK2500 PWxl型高效凝胶柱系统的HPSEC法不能对阿莫西林克拉维酸钾中的聚合物杂质进行有效质控,中国药典2015年版二部收载的RP-HPLC有关物质方法分析聚合物杂质准确,专属性强,建议在质量标准中,将聚合物杂质作为特定杂质,设定质控限度,从而严格控制聚合物的含量。
| [1] |
金少鸿. 头孢菌素过敏反应的研究进展[J]. 国外药学:抗生素分册, 1984(3): 191. JIN SH. Research progress of cephalosporins allergic reaction[J]. World Notes Antibiot, 1984(3): 191. |
| [2] |
金少鸿. 抗生素的过敏反应-Ⅰ.β一内酰胺类抗生素的过敏反应[J]. 中国临床药理学杂志, 1986, 2(4): 251. JIN SH. Allergic reactions of antibiotics-an allergic reaction from β-lactam antibiotics[J]. Chin J Clin Pharmacol, 1986, 2(4): 251. |
| [3] |
金少鸿, 胡昌勤. β内酰胺类抗生素过敏反应的研究[J]. 医学研究杂志, 2002, 31(4): 22. JIN SH, HU CQ. Study on the allergic reaction of the amide antibiotics[J]. Bull Med Res, 2002, 31(4): 22. |
| [4] |
金少鸿. β-内酰胺类抗生素的质量和过敏反应关系的评述[J]. 中国抗生素杂志, 1988, 13(1): 65. JIN SH. A review on relationship between quality of β-lactam antibiotics and allergic reactions[J]. Chin J Antibiot, 1988, 13(1): 65. |
| [5] |
中国药典2015年版. 二部[S]. 2015: 434 ChP 2015. Vol Ⅱ[S]. 2015:434 |
| [6] |
胡昌勤. β-内酰胺抗生素聚合物分析技术的展望[J]. 中国新药杂志, 2008, 17(24): 2098. HU CQ. Developments on analysis of polymers of β-lactam antibiotics[J]. Chin J New Drugs, 2008, 17(24): 2098. DOI:10.3321/j.issn:1003-3734.2008.24.006 |
| [7] |
夏鸣, 杭太俊, 李小敏, 等. β-内酰胺类抗生素中高分子聚合物杂质检查方法的研究综述[J]. 药学进展, 2007, 31(11): 501. XIA M, HANG TJ, LI XM, et al. A review on the test methods for high-molecular weight polymer impurities in β-lactam antibiotics[J]. Prog Pharm Sci, 2007, 31(11): 501. DOI:10.3969/j.issn.1001-5094.2007.11.005 |
| [8] |
胡昌勤, 丁宏, 赵嘉才, 等. 氨苄青霉素, 羧苄青霉素中寡聚物的分离分析[J]. 中国抗生素杂志, 1994, 19(3): 210. HU CQ, DING H, ZHAO JC, et al. Isolation and analysis of Ampicillin and isolation and carbencillin oligomers[J]. Chin J Antibiot, 1994, 19(3): 210. |
| [9] |
金少鸿, 经洁. 氨苄青霉素聚合物的研究-Ⅰ.氨苄青霉素聚合物的分离分析[J]. 中国抗生素杂志, 1987, 12(4): 245. JIN SH, JING J. udies on ampicillin polymers:Ⅰ. Isolation and characterization of ampicillin polymers[J]. Chin J Antibiot, 1987, 12(4): 245. |
| [10] |
金少鸿, 经洁. 氨苄青霉素聚合物的研究-Ⅱ.氨苄青霉素中聚合物的含量测定[J]. 中国抗生素杂志, 1987, 12(4): 245. JIN SH, JING J. Studies on ampicillin polymers Ⅱ. Determination of ampicillin polymers in ampicillin preparations[J]. Chin J Antibiot, 1987, 12(4): 245. |
| [11] |
胡昌勤, 孙丽丽, 金少鸿. β-内酰胺抗生素在SephadexG-10凝胶色谱中色谱行为的定量关系[J]. 药物分析杂志, 1997, 17(2): 78. HU CQ, SUN LL, JIN SH. Quantitative chromatographic behavior and the structure relationship of β-lactam antibiotics on Sephadex G-10 gel chromatography[J]. Chin J Pharm Anal, 1997, 17(2): 78. |
| [12] |
胡昌勤, 孙学兰, 金少鸿, 等. 凝胶-紫外法测定青霉素中致敏性高分子杂质的含量[J]. 中国抗生素杂志, 1989, 14(6): 399. HU CQ, SUN XL, JIN SH, et al. Gel filtration-UV method for detection of the content of GH molecular weight allergenic impurities in penicillin preparations[J]. Chin J Antibio, 1989, 14(6): 399. |
| [13] |
杨美琴, 金少鸿, 胡昌勤. HPLC-柱切换法归属青霉素钠有关物质中的聚合物分析[J]. 药物分析杂志, 2009, 29(10): 1615. YANG MQ, JIN SH, HU CQ. Analysis of polymer impurities in related substances of benzylpenicillin sodium by HPLC-columnswitching[J]. Chin J Pharm Anal, 2009, 29(10): 1615. |
| [14] |
晏会根. 高效分子排阻色谱法测定头孢硫脒聚合物含量[J]. 海峡药学, 2010, 22(3): 62. YAN HG. Determination of the polymer in cefathiamidine by HPSEC[J]. Strait Pharm J, 2010, 22(3): 62. |
| [15] |
魏立平, 武向锋, 刘成红, 等. 高效分子排阻色谱法测定头孢拉定胶囊中的聚合物[J]. 解放军药学学报, 2010, 26(5): 436. WEI LP, WU XF, LIU CH, et al. Determination of the polymer in cefradine capsule by high performance size exclusion chromatography[J]. Pharm J Chin PLA, 2010, 26(5): 436. |
| [16] |
肖甜甜, 杨颖, 鲁延迅. 高效分子排阻色谱法分析头孢米诺钠[J]. 中国药事, 2013, 27(8): 867. XIAO TT, YANG Y, LU YX. Analysis of cefminox sodium by HPSEC[J]. Chin Pharm Aff, 2013, 27(8): 867. |
| [17] |
王健松, 周卫军, 刘敏, 等. 高效分子排阻色谱法测定头孢西丁钠中高分子杂质的含量[J]. 中南药学, 2013, 11(11): 842. WANG JS, ZHOU WJ, LIU M, et al. Determination of macromolecule impurities in cefoxitin by HPSEC[J]. Cent South Pharm, 2013, 11(11): 842. DOI:10.7539/j.issn.1672-2981.2013.11.013 |
| [18] |
王成刚, 曹轶, 张喆, 等. 高效分子排阻色谱法分析头孢噻肟钠中的聚合物[J]. 药物分析杂志, 2009, 29(5): 814. WANG CG, CAO Y, ZHANG Z, et al. HPSEC determination of the polymers in cefotaxime sodium[J]. Chin J Pharm Anal, 2009, 29(5): 814. |
| [19] |
冀亚敏, 吴韶梅, 张亚莉, 等. 高效分子排阻色谱法测定比阿培南中聚合物杂质[J]. 中国抗生素杂志, 2015, 40(1): 51. JI YM, WU SM, ZHANG YL, et al. Determination of polymerized impurities in biapenem by HPSEC[J]. Chin J Antibiot, 2015, 40(1): 51. |
| [20] |
刘晓瑜, 金舒, 邱海强, 等. 高效分子排阻色谱法分析拉氧头孢钠中的聚合物等杂质[J]. 中国药师, 2015, 18(2): 247. LIU XY, JIN S, QIU HQ, et al. Determination of impurities including polymers in latamoxef sodium by HPSEC[J]. Chin Pharm, 2015, 18(2): 247. |
| [21] |
王成刚, 王俊秋, 张喆, 等. 高效分子排阻色谱法测定头孢羟氨苄胶囊中的高分子杂质[J]. 中国药学杂志, 2011, 46(13): 1027. WANG CG, WANG JX, ZHANG Z, et al. Determination of high molecular weight impurities in cefadroxil capsules by HPSEC[J]. Chin Pharm J, 2011, 46(13): 1027. |
| [22] |
袁林, 王丽, 邱海强. 高效分子排阻色谱法测定头孢唑肟钠中聚合物的含量[J]. 中国抗生素杂志, 2016, 41(5): 348. YUAN L, WANG L, QIU HQ. Determination of impurities including polymers in ceftizoxime sodium by HPSEC[J]. Chin J Antibiot, 2016, 41(5): 348. |
| [23] |
张雷, 董红环, 刘洋, 等. 高效分子排阻色谱法测定头孢呋辛酯片中的高分子量杂质[J]. 中国抗生素杂志, 2015, 40(12): 922. ZHANG L, DONG HH, LIU Y, et al. Determination of the high molecular weight related substance in cefuroxime axetil tablets by high performance size exclusion chromatography[J]. Chin J Antibiot, 2015, 40(12): 922. DOI:10.3969/j.issn.1001-8689.2015.12.007 |
| [24] |
林波, 文随方, 云冲, 等. 磷酸盐浓度对测定替卡西林钠/克拉维酸钾(15:1)中高分子杂质分离效果的影响[J]. 国外医药:抗生素分册, 2015, 36(1): 19. LIN B, WEN SF, YUN C, et al. The influence of the separation by phosphate buffer for the determination of high molecular mass impurities in ticarcillin disodium and clavulanate potassium(15:1)[J]. World Notes Antibiot, 2015, 36(1): 19. |
| [25] |
钟雅妮, 刘俊华, 林小洁, 等. HPLC法测定替卡西林钠克拉维酸钾(15:1)中的高分子杂质[J]. 药物分析杂志, 2011, 31(5): 871. ZHONG YN, LIU JH, LIN XJ, et al. HPLC determination of high molecular mass impurities in ticarcillin disodium and clavulanate potassium(15:1)[J]. Chin J Pharm Anal, 2011, 31(5): 871. |
| [26] |
顾立素, 胡昌勤, 金少鸿. 安美汀中高分子杂质的分离分析与质量控制[J]. 药物分析杂志, 2001, 21(1): 13. GU LS, HU CQ, JIN SH. Studies on the separation and quality control of high molecular weight impurities in augmentin[J]. Chin J Pharm Anal, 2001, 21(1): 13. |
| [27] |
蔡姗英, 胡昌勤, 冯芳. b-内酰胺抗生素在Superdex peptide凝聚过滤色谱柱上的色谱行为[J]. 中国抗生素杂志, 2002, 27(3): 157. CAI SY, HU CQ, FENG F. Chromatographic behavior of β-lactam antibiotics in Superdex peptid gel filtration chromatography[J]. Chin J Antibiot, 2002, 27(3): 157. |
| [28] |
刘皈阳, 于锋英, 陈超, 等. 阿莫西林与阿莫西林-克拉维酸钾不良反应的对比研究[J]. 药物不良反应杂志, 2010, 12(6): 397. LIU GY, YU FY, CHEN C, et al. Comparative study on adverse reactions of amoxicillin versus amoxicillin/clavulanate potassium[J]. Adverse Drug React J, 2010, 12(6): 397. |
| [29] |
钟玫. 572例阿莫西林钠克拉维酸钾不良反应报告分析[J]. 实用医院临床杂志, 2013, 10(6): 153. ZHONG M. Analysis of 572 adverse reaction reports of amoxicillin/clavulanate potassium[J]. Pract J Clin Med, 2013, 10(6): 153. |
| [30] |
王忠山, 刘红, 王会丽, 等. 阿莫西林/克拉维酸钾的少见不良反应[J]. 药物不良反应杂志, 2004, 6(4): 246. WANG ZS, LIU H, WANG HL, et al. Uncommon adverse reactions to amoxicillin clavulanate potassium[J]. Adverse Drug Reaction J, 2004, 6(4): 246. |
| [31] |
BP 2016. Vol Ⅲ[S]. 2016:344
|
| [32] |
USP 39-NF 34[S]. 2016:2526
|
| [33] |
LU L, LI J, JIN SH, et al. Combination of reversed phase liquid chromatography and zwitterion exchange-reversed phase-hydrophilic interaction mixed-mode liquid chromatography coupled with mass spectrometry for the analysis of antibiotics and their impurities[J]. J Chin Pharm Sci, 2014, 23(2): 106. |
 2017, Vol. 37
2017, Vol. 37 
