2. 甘肃陇神戎发药业股份有限公司, 兰州 730101;
3. 甘肃省高校中藏药化学与质量研究省级重点实验室, 兰州 730000;
4. 甘肃省道地药材质量标准化技术研究与推广工程实验室, 兰州 730000
2. Gansu Longshen Rongfa Pharmaceutical CO., LTD, Lanzhou 730101, China;
3. Key Laboratory of Chemistry and Quality for Traditional Chinese Medicines of the College of Gansu Province, Lanzhou 730000, China;
4. Gansu province Engineering Laboratory for TCM standardization technology and popularization, Lanzhou 730000, China
白虎汤为传统中药清热方剂,始载于汉·张仲景的《伤寒论》,具有清热生津、除烦止渴之功效,主治气分热盛四大症(身大热、口大渴、汗大出、脉洪大)。方中以大寒之石膏为君,清肺胃热而止烦渴,除阳明气分之热;臣以知母,甘寒质润,滋阴润燥,佐以炙甘草、粳米,益气生津、养胃和中[1]。现代临床常用于治疗感染性疾病,如流行性出血热、流行性乙型脑炎、大叶性肺炎以及小儿夏季热、牙龈炎等属气分热盛者[2-4]。本实验采用定性鉴别、含量测定的研究方法并结合指纹图谱技术建立其质量标准,以期为有效控制该颗粒剂的质量,保证临床安全用药提供实验依据。
1 仪器与材料 1.1 仪器Agilent 1100高效液相色谱仪(G1312A二元泵、G1313A自动进样器、G1316A柱温箱、Agilent 1100化学工作站,安捷伦仪器公司),Agilent ZORBAX SB-C18柱(填料:十八烷基硅烷键合硅胶,4.6 mm×250 mm,5 μm;安捷伦仪器公司),G1315B DAD检测器(安捷伦仪器公司),UM3000蒸发光散射检测器(上海通微分析技术有限公司);ATS4自动点样仪(瑞士卡玛公司);KQ-500DE型数控超声波清洗器(昆山市仪器有限公司);Sartorius电子天平[十万分之一,德国,赛多利斯科学仪器(北京)有限公司],硅胶G薄层板(烟台江友硅胶开发有限公司),聚酰胺薄膜(浙江省台州市路桥四甲生化塑料厂)。
1.2 材料芒果苷对照品(批号:111607-200402,含量测定用)、知母皂苷BⅡ对照品(批号:111839-201505,纯度:96.5%),由中国食品药品检定研究院提供;甘草对照药材(120904-201519)、知母对照药材(121070-201105),由中国食品药品检定研究院提供。10批白虎汤颗粒样品,甘草、知母的阴性颗粒样品(分别缺少甘草、知母的其余处方药材按白虎汤颗粒制备工艺制备而得),均由甘肃陇神戎发药业有限公司提供;水为超纯水,甲醇、乙腈(天津市百世化工有限公司)均为色谱纯,其余试剂为分析纯。
2 薄层色谱鉴别 2.1 甘草的鉴别[5]分别精密称取研细的10批白虎汤颗粒粉末各2.0 g,置圆底烧瓶中,加乙醚40 mL,回流提取1 h,滤过,药渣加甲醇30 mL,加热回流提取1 h,滤过,滤液蒸干,残渣加水40 mL使溶解,用水饱和正丁醇萃取3次,每次20 mL,合并正丁醇液,用水洗涤3次,弃去水液,正丁醇液蒸干,残渣加甲醇5 mL使溶解,作为供试品溶液。取甘草对照药材和阴性颗粒样品各2.0 g,按供试品制备方法制成甘草对照药材溶液和阴性对照溶液。再取甘草酸单铵盐对照品,加甲醇制成每1 mL含2 mg的溶液,作为对照品溶液。分别吸取上述溶液各2 μL,自动点样仪点于同一硅胶G板,以乙酸乙酯-冰醋酸-甲酸-水(30:2:2:4)为展开剂展开,展距8 cm,取出,晾干,喷以10%硫酸乙醇溶液,105 ℃加热至斑点显色清晰,置紫外灯(365 nm)下检视。供试品色谱中,在与对照品相应的位置上,显相同颜色的荧光斑点,阴性无干扰。见图 1。
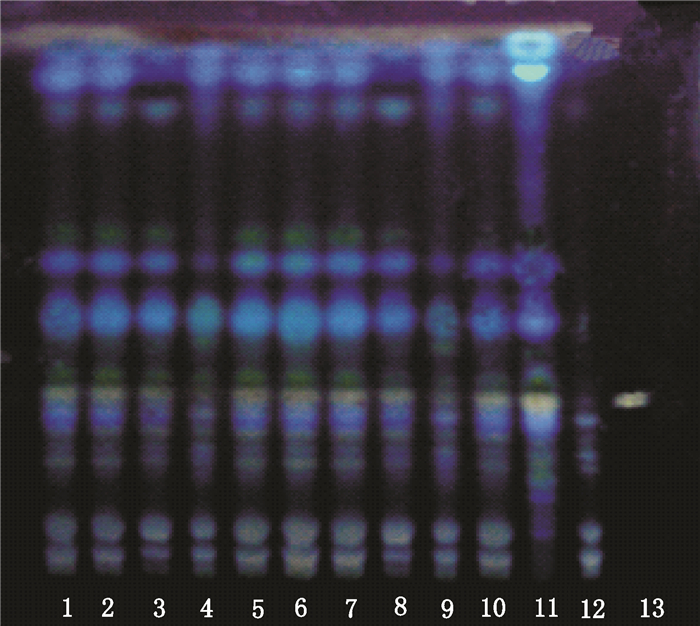
|
1-10.10批白虎汤颗粒供试品(Baihu decoction granules samples)11.甘草对照药材(Radix Glycyrrhizae reference herb)12.阴性对照(negetive sample)13.甘草酸铵对照品(Ammonium Glycyrrhizinate reference substance) 图 1 白虎汤颗粒中甘草(甘草酸铵)薄层色谱图 Figure 1 TLC chromatogram of Radix Glycyrrhizae (Ammonium Glycyrrhizinate) in Baihu decoction granules |
分别取10批白虎汤颗粒,研细,精密称取粉末2.0 g,加70%乙醇10 mL,超声(25 ℃,功率500 W,频率40 kHz)提取20 min,取上清液作为供试品溶液。取知母对照药材和阴性颗粒样品各2.0 g,按供试品制备方法制成知母对照药材溶液和阴性对照溶液。再取芒果苷对照品适量,加70%乙醇配制成0.5 mg·mL-1的溶液,作为对照品溶液。吸取上述溶液各4 μL,分别点于同一聚酰胺薄膜上,以无水乙醇-水(1:1)为展开系统展开,展距6 cm,取出,晾干,置紫外灯(365 nm)下检视。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点,阴性无干扰。见图 2。
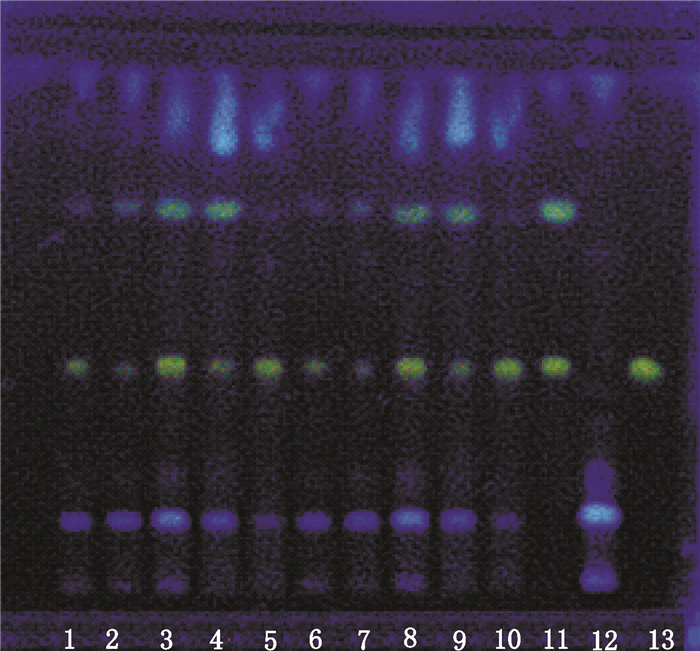
|
1-10.10批白虎汤颗粒供试品(Baihu decoction granules samples)11.知母对照药材(Anemarrhenae Rhizoma reference herb)12.阴性对照(negetive sample)13.芒果苷对照品(mangiferin reference substance) 图 2 白虎汤颗粒中知母(芒果苷)薄层色谱图 Figure 2 TLC chromatogram of Anemarrhenae Rhizoma (mangiferin) in Baihu decoction granules |
分别精密称取10批研细的白虎汤颗粒粉末各2.0 g,加30%丙酮10 mL,超声(25 ℃,功率500 W,频率40 kHz)处理20 min,取上清液,硅藻土(每10 mL提取液用硅藻土0.5 g)过滤后,滤液作为供试品溶液。取知母对照药材和阴性颗粒样品各2.0 g,按供试品制备方法制成知母对照药材溶液和阴性对照溶液。再取知母皂苷BⅡ对照品适量,加30%丙酮配制成1 mg·mL-1的溶液,作为对照品溶液。吸取上述溶液各4 μL,分别点于同一硅胶G薄层板,以正丁醇-冰醋酸-水(4:1:5)为展开系统展开,展距8 cm,取出,晾干,喷以5%香草醛-硫酸乙醇溶液,105 ℃加热至斑点显色清晰。供试品色谱中,在与对照品相应的位置上,显相同颜色的斑点,阴性无干扰。见图 3。
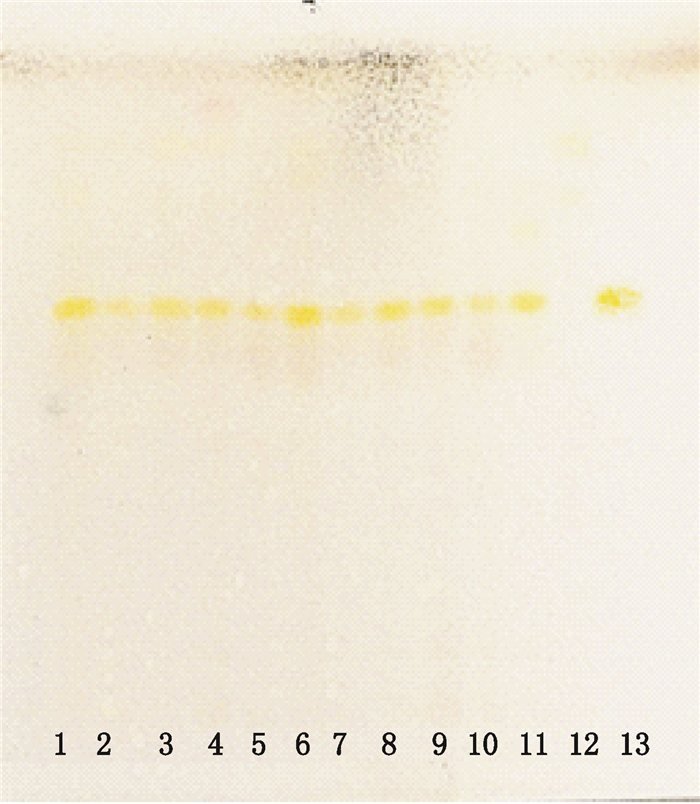
|
1-10.10批白虎汤颗粒供试品(Baihu decoction granules samples)11.知母对照药材(Anemarrhenae Rhizoma reference herb)12.阴性对照(negetive sample)13.知母皂苷BⅡ对照品(timosaponin BⅡ reference substance) 图 3 白虎汤颗粒中知母(知母皂苷BⅡ)薄层色谱图 Figure 3 TLC chromatogram of Anemarrhenae Rhizoma (timosaponin BⅡ) in Baihu decoction granules |
色谱柱:Agilent ZORBAX SB-C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈-0.4%甲酸水(13:87);进样量:10 μL;流速:1 mL·min-1;柱温:25 ℃,紫外检测器检测波长:258 nm。
3.1.2 知母皂苷BⅡ流动相:乙腈-水(25:75);ELSD漂移管温度90 ℃,载气流速3.0 L·min-1,其余条件同“3.1.1”。
3.2 对照品溶液的制备 3.2.1 芒果苷对照品溶液精密称取芒果苷对照品7.01 mg,50%乙醇溶解并定容于25 mL量瓶中,配制成浓度为0.280 4 mg·mL-1的溶液。
3.2.2 知母皂苷BⅡ对照品溶液精密称取知母皂苷BⅡ对照品25.30 mg,30%丙酮溶解并定容于25 mL容量瓶中,配制成浓度为1.012 mg·mL-1的溶液。
3.3 供试品溶液的制备取白虎汤颗粒粉末(批号:2015101002)约1.0 g,精密称定,置具塞锥形瓶中,精密加入50%乙醇50 mL,称量,超声处理(功率500 W,频率40 kHz)45 min,放冷,再称量,用50%乙醇补足减失的量,摇匀,滤过,滤液用微孔滤膜(0.45 μm)滤过,取续滤液,得测定芒果苷含量的供试品溶液。
取白虎汤颗粒粉末(批号:2015101002)约1.0 g,精密称定,置具塞锥形瓶中,精密加入30%丙酮25 mL,称量,超声处理(功率500 W,频率40 kHz)30 min,放冷,再称量,用30%丙酮补足减失的量,摇匀,滤过,滤液用微孔滤膜(0.45 μm)滤过,取续滤液,得测定知母皂苷BⅡ含量的供试品溶液。
3.4 阴性对照溶液的制备取知母阴性颗粒样品,按“3.3”项下对应方法制得阴性对照溶液。
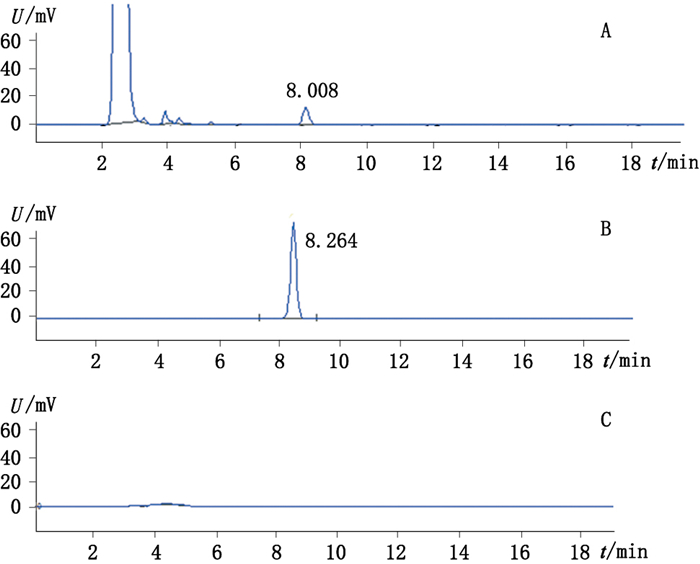
3.5 系统适应性试验分别吸取芒果苷和知母皂苷BⅡ供试品溶液、对照品溶液及阴性对照溶液各10 μL,按“3.1”项下色谱条件进样,记录色谱图,结果供试品色谱中,在与对照品色谱相同保留时间有对应的峰,阴性对照溶液无干扰。表明系统适应性较好。如图 4、5所示。
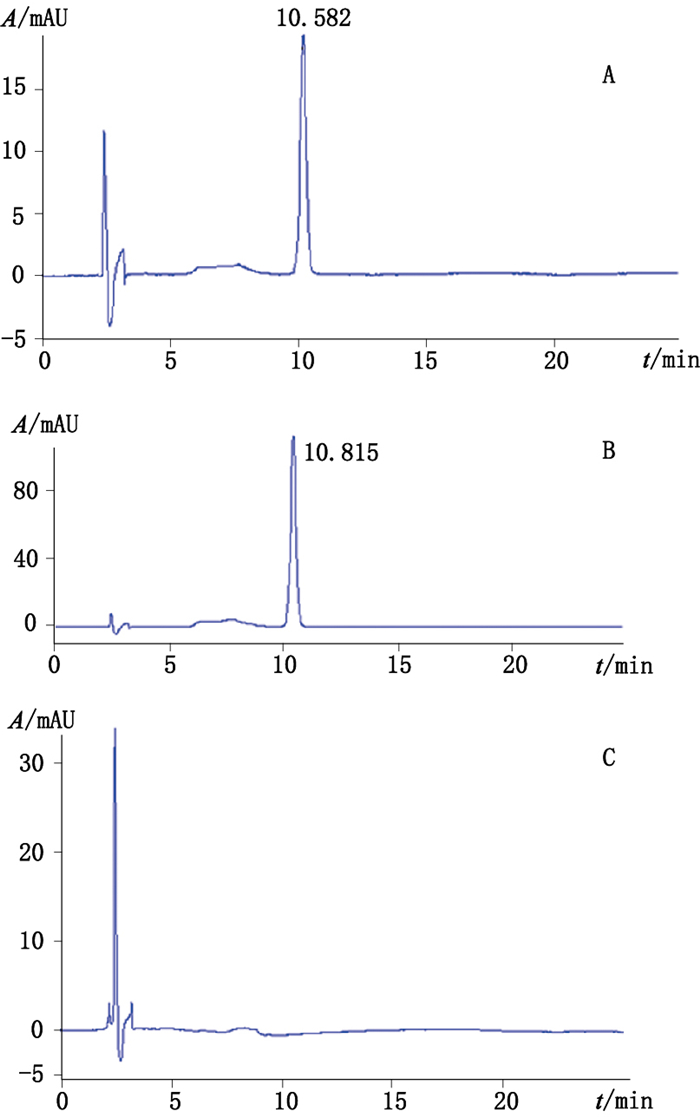
|
A.白虎汤颗粒(Baihu decoction granules sample)B.芒果苷对照品(mangiferin reference substance)C.阴性对照(negetive sample) 图 4 白虎汤颗粒中知母(芒果苷)高效液相色谱图 Figure 4 HPLC chromatogram of Anemarrhenae Rhizoma (mangiferin) in Baihu decoction granules |
|
A.白虎汤颗粒(Baihu decoction granules sample)B.知母皂苷BⅡ对照品(timosaponin BⅡ reference substance)C.阴性对照(negetive sample) 图 5 白虎汤颗粒中知母(知母皂苷BⅡ)高效液相色谱图 Figure 5 HPLC chromatogram of Anemarrhenae Rhizoma (timosaponin BⅡ)in Baihu decoction granules |
分别吸取“3.2”项下制备的芒果苷对照品溶液0.5、1.0、1.5、2.0、2.5、3.0 mL,用50%乙醇定容至10 mL的容量瓶中,按“3.1.1”色谱条件进行测定,以峰面积值(Y)对对照品浓度(X)进行线性回归,得回归方程:
Y=20.29X+38.36 r=0.999 9
结果表明芒果苷在14.02~84.12 μg·mL-1范围内线性关系良好。
3.6.2 知母皂苷BⅡ分别吸取“3.2”项下制备的知母皂苷BⅡ对照品溶液0.5、1.0、2.0、3.0、4.0 mL,用30%丙酮定容至10 mL的容量瓶中,按“3.1.2”色谱条件进行测定,以峰面积值(Y)对对照品浓度(X)进行线性回归,得回归方程:
Y=1.497X+1.484 r=0.999 7
结果表明知母皂苷BⅡ在101.2~809.6 μg·mL-1范围内线性关系良好。
3.7 精密度试验分别精密吸取“3.2”项下制备的芒果苷和知母皂苷BⅡ对照品溶液,按“3.1”色谱条件进行测定,连续进样6次,记录峰面积,结果芒果苷峰面积RSD=0.32%,知母皂苷BⅡ峰面积RSD=2.28%,表明精密度良好。
3.8 重复性试验取同批次的白虎汤颗粒共6份,精密称定,按“3.3”项下方法制备供试品溶液,按“3.1”项下色谱条件进行测定,计算芒果苷和知母皂苷BⅡ的含量。结果芒果苷含量的RSD=0.98%,知母皂苷BⅡ含量的RSD=1.8%,表明重复性良好。
3.9 稳定性试验取同一供试品溶液,分别在0、2、4、8、12、24 h时按“3.1”色谱条件进样,记录峰面积,结果芒果苷峰面积的RSD=1.2%,知母皂苷BⅡ峰面积的RSD=0.76%,表明室温条件下供试品在24 h内稳定。
3.10 加样回收率试验精密称取同批次已知芒果苷(2.91 mg·g-1)和知母皂苷BⅡ(17.22 mg·g-1)含量的白虎汤颗粒样品约0.5 g,各9份,于具塞锥形瓶中,分别分为3组,每组分别精密加入浓度为1.50 mg·mL-1的芒果苷对照品溶液和浓度为7.87 mg·mL-1的知母皂苷BⅡ对照品溶液0.8、1.0、1.2 mL,再分别精密加入50%乙醇50 mL、30%丙酮25 mL,然后按“3.3”项下对应方法制备供试品溶液,按“3.1”色谱条件进行测定,计算回收率。结果芒果苷和知母皂苷BⅡ的平均加样回收率分别为99.5%(RSD=1.5%)和98.5%(RSD=2.3%)。
3.11 样品含量测定精密称取10批白虎汤颗粒样品,按“3.3”项下方法制备供试品溶液,按“3.1”色谱条件进样分析,测定芒果苷和知母皂苷BⅡ的平均含量。结果见表 1。
|
|
表 1 10批白虎汤颗粒含量测定(n=10) Table 1 Content determination of 10 batches ofBaihu decoction granules |
色谱柱:Agilent ZORBAX SB-C18柱(4.6 mm×250 mm,5 μm);流动相:0.4%甲酸水(A)-乙腈(B)梯度洗脱(0~30 min,5%B~62%B;30~35 min,62%B~100%B;35~60 min,100%B);进样量:10 μL;流速:0.8 mL·min-1;柱温:25 ℃;紫外检测器检测波长:258 nm。
4.1.2 HPLC-ELSD流动相:水(A)-乙腈(B)梯度洗脱(0~23 min,5%B~49%B;23~25 min,49%B~100%B;25~30 min,100%B);ELSD飘移管温度为90 ℃,载气流速为3.0 L·min-1。其余条件同“4.1.1”。
4.2 供试品溶液的制备取白虎汤颗粒粉末(批号:2015101002)约1.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称量,超声提取(25 ℃,频率40 kHz,功率500 W)45 min,放冷,再称量,甲醇补足减失的量。滤过,滤液用微孔滤膜(0.45 μm)滤过,取续滤液,即得。
4.3 对照品溶液的制备使用“3.2”项下制备的对照品溶液。
4.4 精密度试验取同一供试品溶液,按“4.1”色谱条件连续进样5次,检测指纹图谱,分别以芒果苷和知母皂苷BⅡ为HPLC-UV和HPLC-ELSD指纹图谱参照峰,比较各色谱峰的相对保留时间和相对峰面积,结果HPLC-UV指纹图谱中各共有峰相对保留时间和相对峰面积的RSD分别小于0.35%、2.5%,HPLC-ELSD指纹图谱中各共有峰相对保留时间和相对峰面积的RSD分别小于0.35%、1.3%,表明精密度良好。
4.5 稳定性试验取同一供试品溶液,按“4.1”色谱条件,分别在第0、2、6、12、24 h检测指纹图谱,比较各色谱峰的相对保留时间和相对峰面积,结果HPLC-UV指纹图谱中各共有峰相对保留时间和相对峰面积的RSD分别小于0.27%、2.9%,HPLC-ELSD指纹图谱中各共有峰相对保留时间和相对峰面积的RSD分别小于0.19%、2.7%,表明室温下供试品在24 h内稳定。
4.6 重复性试验取同批次的白虎汤颗粒样品共5份,精密称定,按“4.2”项下方法制备供试品溶液,按“4.1”项下色谱条件检测指纹图谱,比较各色谱峰的相对保留时间和相对峰面积,结果HPLC-UV指纹图谱中各共有峰相对保留时间和相对峰面积的RSD分别小于0.21%、1.8%,HPLC-ELSD指纹图谱中各共有峰相对保留时间和相对峰面积的RSD分别小于0.17%、2.7%,表明本方法的重复性良好。
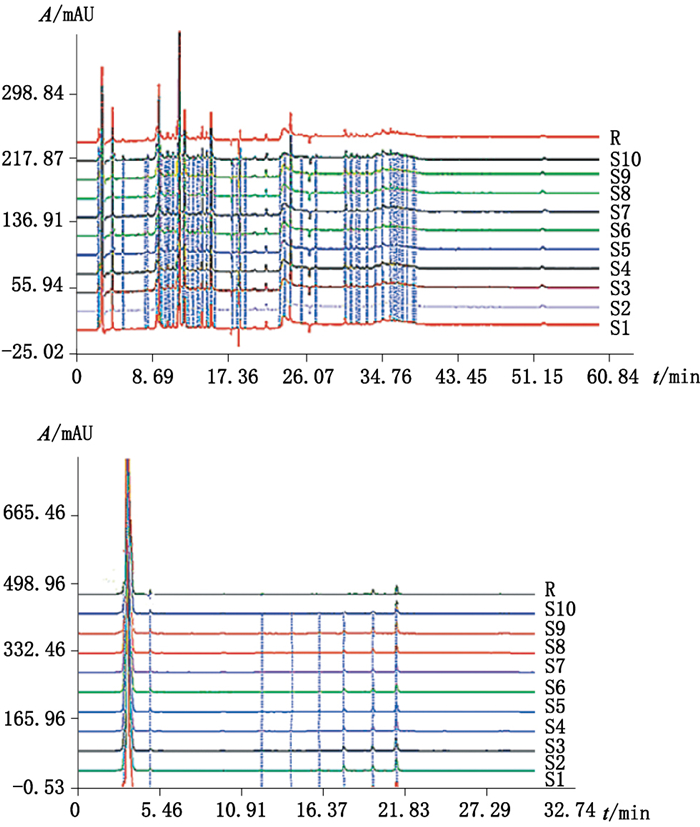
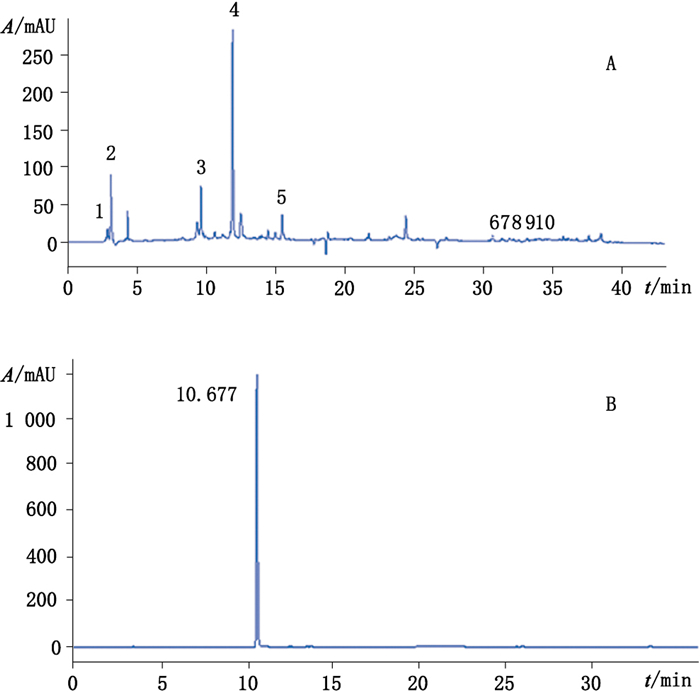
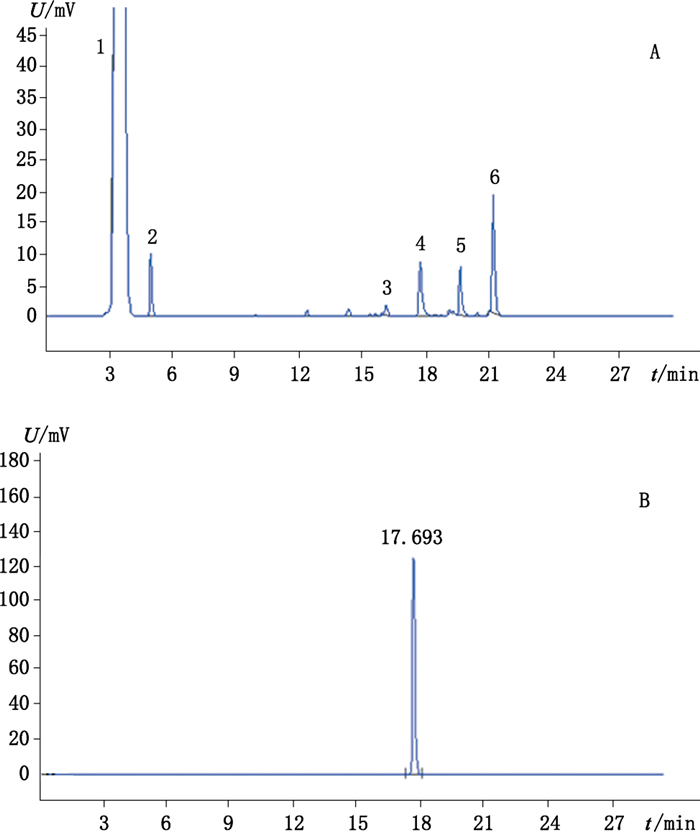
4.7 指纹图谱的建立取10批白虎汤颗粒样品,按“4.2”项下方法制备供试品溶液,按“4.1”项下色谱条件进行检测,记录色谱图,采用“中药色谱指纹图谱相似度评价系统(2004A版)”软件,对10批供试品的色谱图进行比较分析[10-11],如图 6所示,R为自动生成的对照指纹图谱,S1~S10分别代表10批白虎汤颗粒样品。选择归一化峰面积大于0.5%的色谱峰作为指纹峰,将在所有色谱图中均出现的峰作为共有峰,最终HPLC-UV色谱图中共标定了10个共有峰(图 7-A),相对保留时间分别为:2.977,3.239,9.746,12.016,15.110,30.818,31.489,32.054,32.319,33.292。通过与芒果苷对照品色谱图(图 7-B)比对,确定4号峰为芒果苷;HPLC-ELSD色谱图中共标定了6个共有峰(图 8-A),相对保留时间分别为:3.441,4.930,16.073,17.683,19.577,21.140。通过与知母皂苷BⅡ对照品色谱图(图 8-B)比对,确定4号峰为知母皂苷BⅡ。
|
图 6 10批白虎汤颗粒样品高效液相指纹图谱 Figure 6 HPLC fingerprints of 10 batches of Baihu decoction granules samples |
|
图 7 白虎汤颗粒甲醇提取物(A)、芒果苷对照品(B)HPLC/UV图(258nm) Figure 7 HPLC/UV chromatograms (258nm) of Baihu decoction granules of the methanol extracts(A)and mangiferin reference substance(B) |
|
图 8 白虎汤颗粒甲醇提取物(A)、知母皂苷BⅡ对照品(B)HPLC/ELSD图 Figure 8 HPLC/ELSD chromatograms of Baihu decoction granules of the methanol extracts(A)and timosaponin BⅡreference substance(B) |
采用中药色谱指纹图谱相似度评价系统(2004A版),将10批样品数据导入该软件,对选定的特征峰进行多点校正,自动匹配,得到对照指纹图谱[12],各批白虎汤颗粒样品的图谱与对照指纹图谱比较,计算其相似度,所得相似度计算结果均大于等于0.946(表 2),表明白虎汤颗粒甲醇提取物各批间质量均一稳定。
|
|
表 2 白虎汤颗粒甲醇提取物的相似度分析结果 Table 2 Similarity analysis results of methanol extract from Baihu decoction granules |
薄层色谱鉴别中参照中国药典2015年版一部方法,得到知母皂苷BⅡ的TLC图斑点模糊,拖尾严重,背景颜色较深,可能由于复方制剂成分复杂所导致,因此,用硅藻土对样品提取液进行纯化,除去部分干扰性成分,从而达到了较好的分离效果;甘草的薄层鉴别中,甘草酸显色较其他斑点慢,加热显色需稍长时间。
5.2 含量测定含量测定实验中考察了30%乙醇、50%乙醇、70%乙醇、甲醇对芒果苷的提取率,15%丙酮、30%丙酮、50%丙酮、无水丙酮、50%乙醇、50%甲醇对知母皂苷BⅡ的提取率,以甲醇提取中芒果苷含量最高,但色谱峰形较差,故选含量次之峰形较好的50%乙醇为芒果苷的提取溶剂;30%丙酮中知母皂苷BⅡ含量最高,故选用30%丙酮为知母皂苷BⅡ的提取溶剂。综合考虑超声提取、加热回流提取和索氏提取的提取时间及含量两方面因素,发现超声提取的效果更好,对比不同超声时间(30、45、60 min)及不同溶剂量的提取结果,发现芒果苷和知母皂苷BⅡ分别在45 min和30 min时即可提取完全,最佳的溶剂量分别为50 mL和25 mL。以大量文献数据为基础,本实验还考察了不同流动相(乙腈-0.4%甲酸水溶液、乙腈-0.2%冰乙酸水溶液)下的芒果苷的信号响应,发现乙腈-0.4%甲酸分离效较佳,峰型较好,各峰间分离度均达到1.5以上,因此确定为芒果苷的流动相。
5.3 指纹图谱的建立指纹图谱建立实验中发现50%乙醇的提取物分离度不理想,因此优选甲醇提取。通过参考文献,确定了漂移管温度为90 ℃,为获取较高的S/N结果,对载气流速为2.0、2.5、3.0 L·min-1时的信号响应进行考察,最终确定为3.0 L·min-1。
本实验优化和建立了方中知母、甘草的薄层色谱鉴别方法,并采用高效液相色谱法测定了主要成分芒果苷和知母皂苷BⅡ的含量,同时检测了10批白虎汤颗粒甲醇提取物的指纹图谱,并对其进行了相似度评价,结果满意,可用于该制剂的质量控制[13]。
| [1] |
罗元元. 白虎汤类方证研究[D]. 北京: 北京中医药大学, 2011 LUO YY. Study on Baihu Sort Prescription[D]. Beijing: Beijing University of Chinese Medicine, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10026-1011117974.htm |
| [2] |
潘圣融. 白虎汤现代临床应用文献研究[D]. 北京: 北京中医药大学, 2010 FAN SR. Baihu Dection of Modern Clinical Literature Research[D]. Beijing: Beijing University of Chinese Medicine, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10026-2010145021.htm |
| [3] |
赵海霞, 徐向东. 白虎汤的抗炎作用及其作用机理的研究[J]. 时珍国医国药, 2013, 24(1): 60. ZHAO HX, XU XD. Study of the anti-inflammatory effects of Baihu dection and its mechanism[J]. Lishizhen Med Mater Med Res, 2013, 24(1): 60. |
| [4] |
李以菊. 白虎汤加味治疗北京地区儿童病毒性脑炎的临床研究[J]. 中国中医基础学杂志, 2013, 19(12): 1443. LI YJ. Baihu dection addness clinical research for the treatment of children viral encephalitis in Beijing[J]. Chin J Basi Med Tradit Chin Med, 2013, 19(12): 1443. |
| [5] |
中国药典2015年版. 一部[S]. 2015: 86 ChP 2015. Vol Ⅰ[S]. 2015: 86 |
| [6] |
梁雷, 边宝林, 王宏洁. 不同产地知母药材中芒果苷和知母皂苷BⅡ的含量测定[J]. 中国实验方剂学杂志, 2010, 16(16): 49. LIANG L, BIAN BL, WANG HJ. Determination of mangiferin and timosaponin BⅡ in Anemarrhenae Rhizoma from different areas[J]. Chin Exp Tradit Med Form, 2010, 16(16): 49. DOI:10.3969/j.issn.1005-9903.2010.16.015 |
| [7] |
许重远. 知母皂苷B-Ⅱ的药代动力学及代谢机制研究[D]. 上海: 第二军医大学, 2013 XU CY, Studies on Pharmacokinetic and Metabolic Mechanism of Timosaponin BⅡ[D]. Shanghai: The Second Military Medical University, 2013 http://cdmd.cnki.com.cn/Article/CDMD-90030-1013233420.htm |
| [8] |
张志斐, 肖蓉, 袁志芳, 等. 河北道地药材知母HPLC-ELSD指纹图谱研究[J]. 药物分析杂志, 2006, 26(11): 1569. ZHANG ZF, XIAO R, YUAN ZF, et al. Studies on HPLC-ELSD fingerprint of crude Rhizoma Anemarrhenae from Hebei province[J]. Chin J Pharm Anal, 2006, 26(11): 1569. |
| [9] |
魏静娜, 刘征辉, 赵琳琳, 等. 知母药材的HPLC/PDA/ELSD指纹图谱研究[J]. 天津中医药, 2015, 32(10): 618. WEN JN, LIU ZH, ZHAO LL, et al. Studies on HPLC-ELSD fingerprint of Rhizoma Anemarrhenae[J]. Tianjin Med Pharm J, 2015, 32(10): 618. DOI:10.11656/j.issn.1672-1519.2015.10.10 |
| [10] |
李清艳, 王京丽, 王邠, 等. 苦瓜皂苷的HPLC-ELSD指纹图谱研究[J]. 药物分析杂志, 2014, 34(5): 889. LI QY, WANG JL, WANG B, et al. HPLC-ELSD fingerprint analysis of saponins in the fruits of Momordica charantia L[J]. Chin J Pharm Anal, 2014, 34(5): 889. |
| [11] |
赵敬堃, 王德生, 段淑荣, 等. 复智散HPLC-UV/ELSD指纹图谱的研究[J]. 南方医科大学学报, 2007, 27(12): 1830. ZHAO JK, WANG DS, DUAN SR, et al. Fingerprinting of Fuzhisan byhigh-performance liquid chromatography with ultraviolet and evaporative light scattering detector[J]. J South Med Univ, 2007, 27(12): 1830. DOI:10.3321/j.issn:1673-4254.2007.12.006 |
| [12] |
孙玉雯, 刘起华, 文谨, 等. 益髓生血颗粒特定指纹图谱及特征峰分析[J]. 中成药, 2014, 36(1): 125. SUN YW, LIU QH, WEN J, et al. Fingerprint chromatograms and characteristic peaks of Yisui Shengxue Granules[J]. Chin Tradit Pat Med, 2014, 36(1): 125. |
| [13] |
金经, 曾涛, 杨振宇. 葆癸胶囊质量标准研究[J]. 中药材, 2015, 38(2): 390. JIN J, ZENG T, YANG ZY. Studies on quality standard of Baokui capsules[J]. J Chin Med Mater, 2015, 38(2): 390. |
 2017, Vol. 37
2017, Vol. 37 
