吉非替尼是一种选择性表皮生长因子受体酪氨酸激酶抑制剂,作为铂剂化疗(一线化疗)和多烯紫杉醇化疗(二线化疗)都失败的局部晚期或转移性非小细胞(型)肺癌的治疗药物,成为第一种应用于肺癌的靶向药物[1-6]。合成吉非替尼的主要化学原料为3-氯-4-氟苯胺,而3,4-二氟苯胺和4-氯-3-氟苯胺是合成3-氯-4-氟苯胺过程中的附属产物,因其具有基因毒性,应在吉非替尼的生产过程中作为基因毒性杂质控制其含量。目前鲜有文献报道吉非替尼中杂质的测定方法,仅有的几篇报道也都仅限于杂质的液相色谱定量检测[7-11]。针对痕量基因毒性杂质的质谱定量测定方法还未见报道[12-15]。本文建立了一种吉非替尼中2种基因毒性杂质的质谱定量测定方法,操作简单,灵敏度高,可实现吉非替尼药物中2种痕量基因毒性杂质的质量控制。
1 仪器与试剂U3000液相色谱仪(美国赛默飞世尔科技公司),5500型四极杆串联线性离子肼质谱仪(美国应用生物系统公司),XS205型电子天平(瑞士梅特勒-托利多国际有限公司),Thermo Accucore C18色谱柱(填料为十八烷基键合硅胶,内径2.1 mm,长度100 mm,粒径2.6 μm;美国赛默飞世尔科技公司)。
吉非替尼样品(未上市,由齐鲁制药有限公司提供),3,4-二氟苯胺和4-氯-3-氟苯胺对照品均由齐鲁制药有限公司提供,乙腈(色谱纯,购自瑞典欧普森公司),甲酸(色谱纯,购自美国如意公司),水(纯净水,购自杭州娃哈哈集团有限公司)。
2 色谱条件与质谱条件 2.1 色谱条件采用色谱柱Accucore C18(2.1 mm×100 mm,2.6 μm;填料:十八烷基硅烷键合硅胶),以0.1%甲酸水溶液-0.1%甲酸乙腈溶液(70:30)为流动相,流速0.3 mL·min-1,柱温30 ℃,进样体积2 μL。
2.2 质谱条件采用ESI离子源正离子模式,多反应离子监测(MRM)模式下选择离子对m/z 130.1→83.1(3,4-二氟苯胺)和m/z 146.0→111.0(4-氯-3-氟苯胺);解簇电压90 V(3,4-二氟苯胺)、76 V(4-氯-3-氟苯胺);解离能量32 V(3,4-二氟苯胺)、26 V(4-氯-3-氟苯胺);入口电压10 V;出口电压12 V;碰撞气压力Medium;气帘气压力1.03 MPa;雾化压力0.38 MPa;辅助加热气压力0.38 MPa;离子喷雾电压5.5 kV;离子源温度500 ℃。
3 溶液的配制 3.1 对照品溶液精密称取3,4-二氟苯胺、4-氯-3-氟苯胺对照品各约10.01 mg,置100 mL量瓶中,加稀释剂乙腈-水(50:50)溶解并稀释至刻度,摇匀;精密量取1 mL,置100 mL量瓶中,用稀释剂乙腈-水(50:50)稀释至刻度,摇匀,配制成浓度为1 μg·mL-1对照品储备液;精密量取1 mL,置10 mL量瓶中,用稀释剂乙腈-水(50:50)稀释至刻度,摇匀;精密量取12 mL,置100 mL量瓶中,用稀释剂乙腈-水(50:50)稀释至刻度,摇匀,配成浓度为12 ng·mL-1的对照品溶液。
3.2 供试品溶液精密称取吉非替尼供试品约20.03 mg,置10 mL量瓶中,用稀释剂乙腈-水(50:50)振摇使溶解并稀释至刻度,取1 mL置2 mL离心管中,12 000 r·min-1离心10 min后取上清液,配制成浓度为2 mg·mL-1的吉非替尼供试品溶液。
4 方法学确证 4.1 专属性试验分别取12 ng·mL-1的3,4-二氟苯胺和4-氯-3-氟苯胺对照品溶液、2 mg·mL-1的吉非替尼供试品溶液、稀释剂乙腈-水(50:50),按上述条件进样分析,记录峰面积,图 1的结果显示,本方法3,4-二氟苯胺液质检测的保留时间为1.47 min左右,4-氯-3-氟苯胺的保留时间为3.75 min左右,空白样品中虽然在2.0 min左右有个杂质峰出现,但对目标物3,4-二氟苯胺和4-氯-3-氟苯胺的检测无干扰。
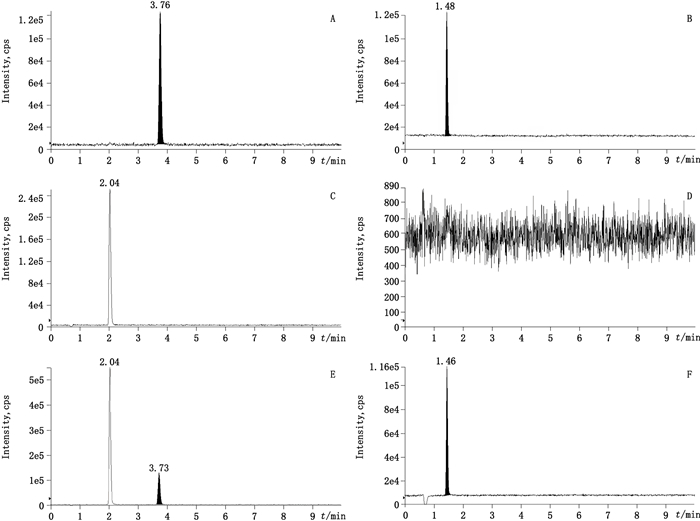
|
A. 4-氯-3-氟苯胺对照品(4-chloro-3-fluoroaniline)B. 3,4-二氟苯胺对照品(3,4-difluoroaniline)C.空白吉非替尼样品中4-氯-3-氟苯胺(4-chloro-3-fluoroaniline in blank Gefitinib sample)D.空白吉非替尼样品中3,4-二氟苯胺(3,4-difluoroaniline in blank Gefitinib sample)E.加标样品中4-氯-3-氟苯胺(blank Gefitinib sample spiked with 4-chloro-3-fluoroaniline)F.加标样品中3,4-二氟苯胺(blank Gefitinib sample spiked with 3,4-difluoroaniline) 图 1 专属性试验结果 Figure 1 Results of specificity tests |
取1 μg·mL-1对照品储备液,逐级稀释成浓度为24、18、12、9、6、1 ng·mL-1的标准溶液,按上述条件进样分析,记录峰面积,以3,4-二氟苯胺的峰面积对浓度进行线性回归,线性方程为:
Y=2.801×105X+4.517×103 r=0.999 4
以4-氯-3-氟苯胺的峰面积对浓度进行线性回归,线性方程为:
Y=5.063×104X+9.593×105 r=0.999 2
结果表明,3,4-二氟苯胺和4-氯-3-氟苯胺在浓度1~24 ng·mL-1范围内线性良好。
4.3 检测限和定量限取3,4-二氟苯胺和4-氯-3-氟苯胺对照品储备液逐级稀释,按上述条件进样分析,在满足检测要求的情况下,最终确定0.4ng·mL-1为方法的检测限浓度,1.0 ng·mL-1为方法的定量限浓度,样品添加1.0 ng·mL-1定量限浓度对照品溶液的质谱检测结果如图 2所示。分别对3,4-二氟苯胺和4-氯-3-氟苯胺定量限浓度的检测稳定性进行考察,计算RSD分别为2.2%和1.7%(n=6)。
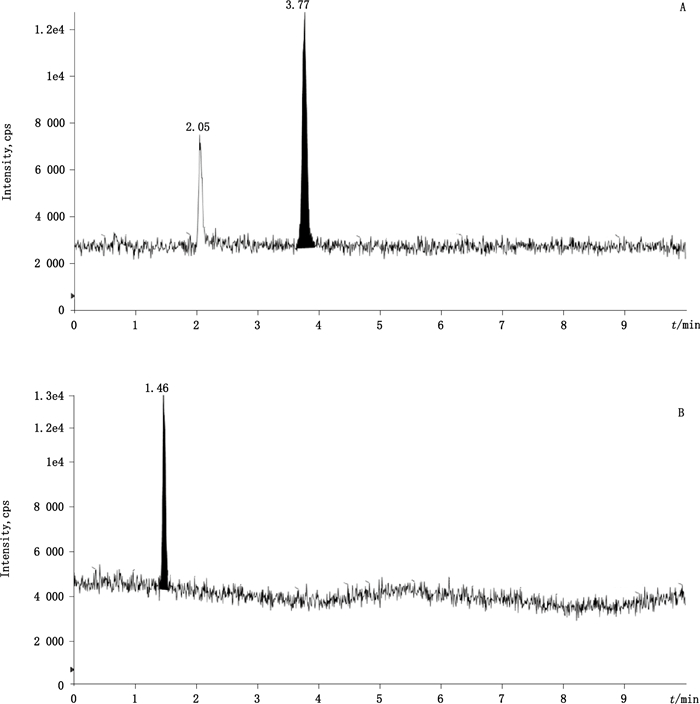
|
A.空白吉非替尼样品中加入1.0 ng·mL-14-氯-3-氟苯胺对照品(spiked Gefitinib sample with 1.0 ng·mL-14-chloro-3-fluoroaniline)B.空白吉非替尼样品中加入1.0 ng·mL-13,4-二氟苯胺对照品(spiked Gefitinib sample with 1.0 ng·mL-13,4-difluoroaniline) 图 2 1.0 ng·mL-1对照品添加到样品中的色谱图 Figure 2 Chromatograms ofspiked sample with 1.0 ng·mL-1 control |
取12 ng·mL-1的3,4-二氟苯胺和4-氯-3-氟苯胺对照品溶液2 μL进样分析,连续进样6针,记录峰面积,计算RSD分别为2.3%和2.0%。
4.5 回收率试验精密称定空白吉非替尼供试品约20 mg共9份,置于10 mL量瓶中,分别加入1 mL 10 ng·mL-1的3,4-二氟苯胺和4-氯-3-氟苯胺的混标溶液(低浓度)、120 ng·mL-1的混标溶液(中浓度)和180 ng·mL-1的混标溶液(高浓度),加入稀释剂定容至刻度,不同浓度同法各配制3份。按上述条件进样分析,结果经计算3,4-二氟苯胺的低、中、高3种浓度的平均回收率(n=3)分别为99.4%、97.0%、105.5%,RSD(n=3)分别为8.2%、5.1%、1.7%。4-氯-3-氟苯胺的低、中、高三种浓度的平均回收率(n=3)分别为102.0%、98.6%、105.7%,RSD(n=3)分别为3.9%、7.9%、2.4%。
4.6 样品检测按“3.2”项下操作配制3批(批号1、批号2、批号3)浓度为2.0 mg·mL-1的吉非替尼供试品溶液各3份,按上述条件进样分析,结果显示,3批吉非替尼供试品中3,4-二氟苯胺均未检出,批号2吉非替尼样品中4-氯-3-氟苯胺有少量检出,但低于样品的定量限( < 0.5 mg·kg-1)。
5 结论本方法经方法学试验验证,能够对吉非替尼中的痕量基因杂质3,4-二氟苯胺和4-氯-3-氟苯胺进行准确测定,方法专属强,灵敏度高,满足杂质定量检测的要求,可作为吉非替尼基因毒性杂质的质量控制方法。
| [1] |
SHEPHERD FA, DANCEY J, RAMLAU R, et al. Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy[J]. J Clin Oncol, 2000, 18(10): 2095. DOI:10.1200/JCO.2000.18.10.2095 |
| [2] |
徐建康, 车大庆, 赵宗敏, 等. 吉非替尼的合成工艺研究[J]. 华西药学杂志, 2012, 27(4): 362. XU JK, CHE DQ, ZHAO ZM, et al. Study on synthesis process of gefitinib[J]. West China J Pharm Sci, 2012, 27(4): 362. |
| [3] |
徐娟芳, 孔雅俊, 刘燕, 等. 抗癌药吉非替尼合成新工艺[J]. 西南科技大学学报, 2016, 31(3): 25. XU JF, KONG YJ, LIU Y, et al. A new synthetic process of Gefitinib-an Anticancer Drug[J]. J Southwest Univ Sci Technol, 2016, 31(3): 25. |
| [4] |
陈昊. 抗肿瘤药物吉非替尼专利技术分析[J]. 中国新药杂志, 2015, 24(12): 1326. CHEN H. Analysis of the patent technology for the anti-tumor drug gefitinib[J]. Chin J New Drugs, 2015, 24(12): 1326. |
| [5] |
戴青, 马荔. 吉非替尼治疗非小细胞肺癌的临床研究进展[J]. 海峡药学, 2014, 26(11): 6. DAI Q, MA L. Progress in clinical studies of the gefitinib uesd in the treatment of non-small-cell lung cancer(NSCLC)[J]. Strait Pharm J, 2014, 26(11): 6. DOI:10.3969/j.issn.1006-3765.2014.11.003 |
| [6] |
徐风华, 郭荣荣, 孙华燕. 吉非替尼治疗晚期非小细胞肺癌的系统评价[J]. 中国循证医学杂志, 2009, 9(2): 218. XUE FH, GUO RR, SUN HY. Systemic evaluation of gefitinib in the treatment of non-small-cell lung cancer[J]. Chin J Evid-based Med, 2009, 9(2): 218. |
| [7] |
齐敬敬, 孙春艳, 褚岩凤, 等. HPLC法测定吉非替尼原料药有关物质[J]. 药物分析杂志, 2016, 36(4): 704. QI JJ, SUN CY, CHU YF, et al. Determination of related substances of gefitinib raw material by HPLC[J]. Chin J Pharm Anal, 2016, 36(4): 704. |
| [8] |
吴学昊, 罗安, 叶连宝, 等. 反相液相色谱法同时测定原料药中吉非替尼及其有关物质的含量[J]. 分析测试学报, 2016, 35(1): 35. WU XH, LUO A, YE LB, et al. Simultaneous determination of gefitinib and its related substances in raw material drugs by reversed-phase high performance liquid chromatography[J]. J Instr Anal, 2016, 35(1): 35. |
| [9] |
梁晓东, 马小涛, 和龙, 等. HPLC法测定吉非替尼原料药的含量和有关物质[J]. 中国药房, 2015, 26(15): 2138. LIANG XD, MA XT, HE L, et al. Determination of the content of gefitinib active pharmaceutical ingredients and related substances by HPLC[J]. Chin Pharm, 2015, 26(15): 2138. DOI:10.6039/j.issn.1001-0408.2015.15.45 |
| [10] |
叶连宝, 杨杰波, 吴杰, 等. HPLC测定吉非替尼中的有关物质[J]. 华西药学杂志, 2016, 31(5): 526. YE LB, YANG JB, WU J, et al. Determination of the related substances in Gefitinib by HPLC[J]. West China J Pharm Sci, 2016, 31(5): 526. |
| [11] |
孙春艳, 齐敬敬, 石莹. HILIC-HPLC法测定吉非替尼原料药的酸降解杂质X的含量[J]. 中南药学, 2017, 15(2): 217. SUN CY, QI JJ, SHI Y. Determination of impurity X in gefitinib raw materials by HPLC with HILIC column[J]. Central South Pharm, 2017, 15(2): 217. DOI:10.7539/j.issn.1672-2981.2017.02.019 |
| [12] |
周浩, 孟繁华, 孙磊, 等. LC-MS/MS法定量检测恩格列净原料药中杂质的含量[J]. 国际药学研究杂志, 2016, 43(4): 753. ZHOU H, MENG FH, SUN L, et al. Related substances in empagliflozin determined by LC-MS/MS[J]. J Int Pharm Res, 2016, 43(4): 753. |
| [13] |
董晓燕, 陶玮彦, 刘孟, 等. 基于LC-MS/MS法的盐酸肼屈嗪片有关物质研究[J]. 药物分析杂志, 2016, 36(1): 155. DONG XY, TAO WY, LIU M, et al. Study on the related substances in hydralazinehydrochloride tablets by LC-MS/MS[J]. Chin J Pharm Anal, 2016, 36(1): 155. |
| [14] |
张云峰, 钱建钦, 王建. HPLC-MS/MS法分析氟胞嘧啶中痕量基因毒性杂质N, N-二甲基苯胺[J]. 药物分析杂志, 2017, 37(2): 265. ZHANG YF, QIAN JQ, WANG J. Determination of trace level of genotoxic impurity N, N-dimethylaniline in flucytosine by HPLC-MS/MS[J]. Chin J Pham Anal, 2017, 37(2): 265. |
| [15] |
阮晓玲, 郑项元, 徐洁, 等. 药物中基因毒性杂质分析方法的研究进展[J]. 中国药科大学学报, 2016, 47(3): 267. RUAN XL, ZHENG XY, XU J, et al. Advances in analytical techniques for the determination of genotoxic impurities in pharmaceuticals[J]. J China Pharm Univ, 2016, 47(3): 267. DOI:10.11665/j.issn.1000-5048.20160303 |
 2017, Vol. 37
2017, Vol. 37 