2. 浙江华义医药有限公司, 义乌 322002
2. Zhejiang Huayi Pharmaceutical Co. Ltd., Yiwu 322002, China
枸橼酸托法替尼,2012年11月6日FDA批准其片剂上市[1]。用于对氨甲喋呤治疗应答不充分或不耐受的中至重度活动性类风湿关节炎成人患者,可用作单药治疗或与氨甲喋呤或其他非生物制品抗风湿药物(DMARDs)联用。其作用机制与当前大多数抗风湿治疗药物主要作用于细胞外靶点不同,托法替尼是一种Janus激酶(Janus kinase,JAK)抑制剂,以细胞内信号转导通路为靶点,作用于细胞因子网络的核心部分,且对Janus激酶3(Janus kinase 3,JAK3)的抑制强度是对Janus激酶2(Janus kinase 2,JAK2)及Janus激酶1(Janus kinase 1,JAK1)的5~100倍,在有效治疗剂量下,托法替尼对JAK1仅部分抑制,对JAK2却无明显抑制作用[2-4]。
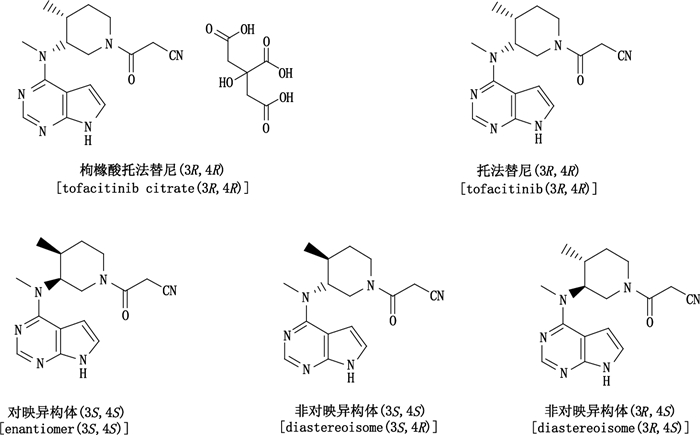
根据国家食品药品监督管理局药物审评中心颁布的《手性药物质量控制研究技术指导原则》要求,对于单一对映体药物,必须制订立体异构体检查项,以控制立体异构体杂质的含量。枸橼酸托法替尼化学名为:3-((3R,4R)-4-甲基-3-(甲基(7H-吡咯并[2,3-d]嘧啶-4-基)氨基)哌啶-1-基)-3-氧代丙腈枸橼酸盐,为单一立体异构体药物,其结构中有2个手性中心,成品中可能存在3种光学异构体杂质,包括1个对映异构体和2个非对映异构体(具体结构见下图 1)。非对映异构体在普通的高效液相色谱上就可分离,对映异构体却需用手性柱分离,另外,对映异构体的检测也是该项目的关键技术之一,更是难点[5-17],目前国内外尚未见到相关报道。本实验选择手性柱Chiralpak AD-H,填料为直链淀粉-三(3,5-二甲苯基氨基甲酸酯),筛选了异丙醇-乙腈、异丙醇-正己烷、异丙醇-正己烷-乙腈、异丙醇-正己烷-甲醇的混合溶剂(0.2%的三乙胺作添加剂)等流动相体系并优化柱温、流速、进样量,开发了一种测定枸橼酸托法替尼原料及片剂中对映异构体杂质含量的正相高效液相色谱方法。方法验证结果显示,该方法准确、简便、灵敏,能用于枸橼酸托法替尼原料及片剂中对映异构体杂质含量的测定。
|
图 1 枸橼酸托法替尼、托法替尼及其光学异构体的化学结构式 Figure 1 Chemical structures of tofacitinib citrate, tofacitinib and its three stereoisomers |
SHIMADZU LC-20高效液相色谱仪(岛津公司,日本,配有高精度二元梯度泵、在线脱气机、自动进样器、柱温箱和VWD检测器);手性色谱柱Daicel Chiralpak AD-H(250 mm×4.6 mm,5 μm),填料为直链淀粉-三(3,5-二甲苯基氨基甲酸酯),日本大赛璐公司;KQ-250DE数控超声仪(昆山市超声仪器有限公司);梅特勒托利多XS-105型精密电子天平,瑞士;0.45 μm微孔滤膜(上海迪清过滤技术有限公司);SHZ-D(Ⅲ)循环水真空泵(巩义市子华仪器有限责任公司)。
1.2 试药正己烷、异丙醇(色谱纯,天津市科密欧化学试剂有限公司);甲醇(色谱纯,Amethyst Chemicals,美国);三乙胺(分析纯,上海凌峰化学试剂有限公司);枸橼酸托法替尼原料及片剂样品、托法替尼对映异构体(本公司提供)。
2 方法与结果 2.1 色谱条件色谱柱:Daicel Chiralpak AD-H手性色谱柱(250 mm×4.6 mm,5 μm);流动相:正己烷-异丙醇-甲醇(71:21:8)-三乙胺(100:0.2)溶液;检测波长:280 nm;流速:0.5 mL·min-1;柱温:30 ℃;进样量:5 μL;分析时长:50 min。
2.2 溶液的制备 2.2.1 供试品溶液精密称取适量枸橼酸托法替尼原料或片的细粉,加0.2%三乙胺甲醇溶液(1 mg枸橼酸托法替尼:0.2%三乙胺甲醇溶液1 mL)溶解后加0.2%三乙胺异丙醇溶液定量稀释制成每1 mL中约含枸橼酸托法替尼0.4 mg的溶液,摇匀,0.45 μm过滤,取续滤液即得。
2.2.2 对映异构体储备溶液精密称取适量对映异构体的细粉,加0.2%三乙胺甲醇溶液(1 mg对映异构体:0.2%三乙胺甲醇溶液1 mL)溶解后,加0.2%三乙胺异丙醇溶液定量稀释制成每1 mL中约含对映异构体0.32 mg的溶液,摇匀,0.45 μm过滤,取续滤液即得。
2.2.3 对映异构体对照品溶液精密量取对映异构体储备溶液适量,加0.2%的三乙胺异丙醇溶液定量稀释至0.8 μg·mL-1,摇匀,即得。相当于供试品溶液浓度的0.2%。
2.2.4 系统适用性溶液精密量取对映异构体储备溶液和供试品溶液各1 mL,混匀,即得。其中对映异构体的浓度约0.16 mg·mL-1,枸橼酸托法替尼的浓度约0.2 mg·mL-1。
2.3 测定法分别精密吸取“2.2.3”项及“2.2.1”项方法制备的对照品溶液和供试品溶液各5 μL注入液相色谱仪,测定样品中对映异构体峰的峰面积,采用外标法计算其含量。
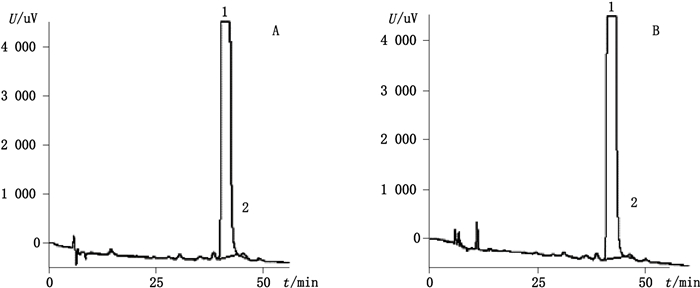
2.4 分析方法的验证 2.4.1 专属性按上述分析方法,分别进样系统适用性溶液、空白溶剂及相当于供试品溶液浓度的空白辅料溶液,结果表明托法替尼、对映异构体与各自相邻峰均可实现基线分离,分离度均大于2.0(图谱见图 2),空白溶剂及辅料不干扰测定,表明本色谱条件适用,专属性良好。
|
1.托法替尼(tofacitinib citrate)2.对映异构体(enantiomer) A.枸橼酸托法替尼原料(tofacitinib citrate bulk API)B.枸橼酸托法替尼片剂(tofacitinib citrate tablets) 图 2 枸橼酸托法替尼原料及片剂对映异构体测定的色谱图 Figure 2 Chromatograms of determination of enantiomer in Tofacitinib Citrate bulk and tablets |
精密移取对映异构体储备液适量,加0.2%的三乙胺异丙醇溶液逐步定量稀释后,按上述方法进样分析,当信噪比(S/N)约为3~5时,对映异构体的浓度为0.08 μg·mL-1,即对映异构体的检出限为0.08 μg·mL-1(相当于供试品浓度的0.02%);当信噪比(S/N)约为10时,对映异构体的浓度为0.16 μg·mL-1(相当于供试品浓度的0.04%),即对映异构体的定量限为0.16 μg·mL-1。
2.4.3 线性范围精密移取对映异构体储备液适量,加0.2%的三乙胺异丙醇溶液逐步定量稀释后制成一系列浓度的溶液,分别精密吸取5 μL,注入液相色谱仪,记录色谱图,以浓度为X轴,峰面积为Y轴,进行线性回归,回归方程为:
Y=1.931×104X-256.1 r=1.000
结果显示,对映异构体浓度在0.16~8.00 μg·mL-1范围内(相当于供试品溶液浓度的0.04%~2%)线性关系良好。
2.4.4 重复性精密称取枸橼酸托法替尼片的细粉适量,共6份,分别按“2.2.1”项方法制备供试品溶液,各精密吸取5 μL在上述色谱条件下进样,结果6份样品中对映异构体杂质的归一含量分别为:0.05%、0.05%、0.05%、0.05%、0.05%、0.05%,变化的RSD为0.0%,说明本法重复性良好。
2.4.5 中间精密度为考察随机变动因素对精密度的影响,在不同的日期,由另一名分析员独立建立系统,重新配制6份枸橼酸托法替尼片的供试品溶液,各精密吸取5 μL于上述色谱条件下进样,结果12份样品(另6份为精密度测试样品)中对映异构体杂质归一含量变化的RSD为5.9%,说明本法中间精密度良好。
2.4.6 准确度-加样回收率按“2.2.2”项下方法制备1.28 μg·mL-1、1.6 μg·mL-1、1.92 μg·mL-1的对映异构体溶液各100 mL;精密称定,取枸橼酸托法替尼片细粉9份,各约500 mg(相当于枸橼酸托法替尼约20 mg),置50 mL量瓶中,各加0.2%三乙胺甲醇溶液20 mL,振摇使充分溶解后,再分别精密加入上述1.28 μg·mL-1、1.6 μg·mL-1、1.92μg·mL-1的对映异构体溶液各25 mL,摇匀,用0.2%的三乙胺异丙醇定容到刻度,每个浓度制备3份,0.45 μm过滤,取续滤液作为供试品溶液。取对映异构体对照品溶液(0.8 μg·mL-1)和各供试品溶液分别在上述“2.1”色谱条件下进样,记录色谱图,按外标法以峰面积计算得测定值,即50 mL供试品溶液中所含对映异构体的量,(测定值-样品中原有量)/加样量×100%即为加样回收率。结果显示加样回收率为91.2%~96.4%,RSD为3.0%,说明本法准确度良好。
2.4.7 溶液稳定性取片的供试品溶液1份,常温下放置,每隔数小时测定,结果34 h内对映异构体杂质归一含量变化的RSD为5.0%,说明该溶液至少在34 h之内稳定。
2.4.8 耐用性分别改变流动相流速、柱温及换用不同批号的色谱柱,进样系统适用性溶液,按上述方法分析,考察测定条件发生细微变动对测定结果的影响。结果显示当流速V=0.45、0.5、0.55 mL·min-1,分离度分别为2.19、2.18、2.17;柱温T=28 ℃、30 ℃、32 ℃,分离度分别为2.15、2.18、2.13,换用2个不同批号的色谱柱时,分离度分别为2.18、2.16,实验结果表明,该方法的耐用性良好。
2.5 样品的测定结果取3批枸橼酸托法替尼原料及片剂的中试样品,按上述“ 2.2.1 ”项下方法配制供试品溶液,用所建立的方法测定枸橼酸托法替尼原料及片剂中对映异构体含量。结果3批原料中试样品中对映异构体含量分别为:0.01%、0.02%、0.04%,3批制剂(片剂)中试样品中对映异构体含量分别为:0.01%、0.02%、0.05%,制剂与原料中对映异构体杂质含量基本一致,符合产品实际。原料及片剂对映异构体杂质含量测定的典型图谱分别见图 2-A及图 2-B。
3 讨论 3.1 检测波长的选择取枸橼酸托法替尼原料及其对映异构体的细粉适量,分别用甲醇溶解并定量稀释到约15 μg·mL-1,于200~ 400 nm波长范围内扫描,紫外吸收图谱显示,两化合物均在205 nm及280 nm附近的吸收较强,基于流动相的截止波长及三乙胺的影响,选择280 nm作为检测波长。
3.2 样品溶剂的选择枸橼酸托法替尼在正己烷中几乎不溶,在异丙醇中极微溶解,在甲醇中微溶,在0.2%三乙胺甲醇溶液中溶解。经试验,供试品溶液制备采用0.2%三乙胺甲醇溶液溶解、0.2%的三乙胺异丙醇溶液稀释定容可满足对映异构体杂质检测对样品浓度的要求。
3.3 色谱柱选择Daicel Chiralpak AD-H空间结构辨识性强,适用范围广,初步选定为实验柱。
3.4 流动相体系的选择进样系统适用性溶液,分别考察了异丙醇-乙腈、异丙醇-正己烷、异丙醇-正己烷-乙腈、异丙醇-正己烷-甲醇的混合溶剂(0.2%的三乙胺作添加剂)体系,优化各种流动相比例,流速0.5 mL·min-1,检测波长280 nm,柱温35℃,结果表明以正己烷-异丙醇-甲醇(71:21:8)-三乙胺(100:0.2)溶液做流动相体系,洗脱时分离度较好,结果详见表 1。
|
|
表 1 流动相体系的选择 Table 1 The selection of mobile phase |
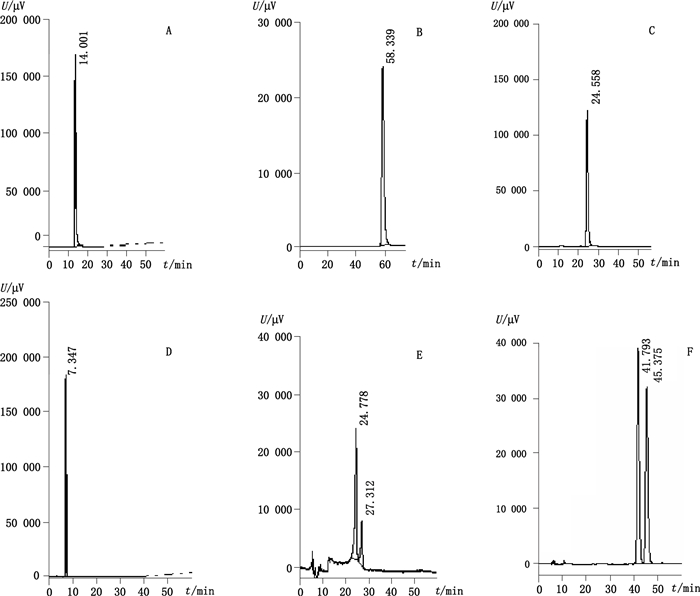
记录图谱表明,以第5种流动相洗脱,托法替尼与其对映异构体峰虽能实现基线分离,但峰形很差。而以第6种流动相洗脱,托法替尼与对映异构体及各自相邻峰均可实现基线分离,而且保留时间适中,理论塔板数/米较大,所以本试验选择第6种流动相洗脱。见图 3。其中图 3-A、B、C、D的主峰为托法替尼与其对映异构体的共出峰。图E中24.778 min为托法替尼,27.312为对映异构体。图 3-F中41.793 min为托法替尼,45.375为对映异构体。
|
A~F.分别代表表 1中第1→6种流动相CS(the eluting results from NO.1 to NO.6 mobile phase in Tab. 1) 图 3 不同流动相洗脱的色谱图 Figure 3 Chromatograms of different mobile phases |
优化流速、柱温、进样量,结果显示流速设置为0.5 mL·min-1、柱温设置为30℃、进样量为5 μL时托法替尼与其对映异构体的分离度、对映异构体与相邻峰的分离度较好。
3.6 非对映异构体出峰的说明在枸橼酸托法替尼原料药及制剂质量标准有关物质检查中已将非对映异构体作为已知杂质控制,其在常规的反相HPLC条件下就能分离,不是本文所关注的目标峰,理论推测在本色谱系统中非对映异构体也不可能与对映异构体出峰重叠,而且实际3批原料和制剂样品中,非对映异构体的残留均明显大于0.05%(此数据为3批原料和制剂中试样品中所测得的对映异构体残留的最大值),间接排除了对映异构体和非对映异构体在本色谱条件下出峰重叠的可能。系统的方法学验证结果更是证明了本法的合理性。
4 结论本文建立的对映异构体残留测定的方法,不仅操作简便,而且经系统的方法学验证表明,该法精密度与灵敏度高、稳定性好、结果准确可靠、专属性符合要求,可用于原料药及片剂中对映异构体残留的检查,具有实用价值。实际产品开发中,已将本法检查对映异构体的残留订入质量标准,作为有关物质检查的补充进一步控制原料药及片剂产品的质量。
| [1] |
张建忠. 2012年11月FDA批准新药概况[J]. 上海医药, 2013, 34(1): 61. ZHANG JZ. New drugs approved by FDA, USA, Nov. 2012[J]. Shanghai Med Pharm, 2013, 34(1): 61. |
| [2] |
Burmester GR, Blanco R, SChoeman CC, et al. Tofacitinib(CP-690, 550) in combination with methotrexate in patients with active rheumatoid arthritis with all inadequate response to tumour necrosis factor inhibitors: a randomized phase 3 trial[J]. Lancet, 2013, 381(9865): 451. DOI:10.1016/S0140-6736(12)61424-X |
| [3] |
Adolfo M, Mario JS, Leonardo SS. Asymmetric total synthesis of Tofacitinib[J]. Tetrahedron Letters, 2013, 54: 5096. DOI:10.1016/j.tetlet.2013.07.042 |
| [4] |
lanagan ME, Blumenkopf TA, Brissette WH, et al. Discovery of CP-690, 550: a potent and selective Janus Kinase(JAK)inhibitor for the treatment of autoimmune diseases and organ transplant rejection[J]. Med Chem, 2010, 53(24): 8468. DOI:10.1021/jm1004286 |
| [5] |
赵方露, 陈国华, 姚世伦, 等. 枸橼酸托法替尼的合成[J]. 中国医药工业杂志, 2014, 45(3): 201. ZHAO FL, CHEN GH, YAO SL, et al. Synthesis of Tofacitinib Citrate[J]. Chin J Pharm, 2014, 45(3): 201. |
| [6] |
张仲奎, 匡春香. Tofacitinib的合成[J]. 中国医药工业杂志, 2013, 44(4): 321. ZHANG ZK, KUANG CX. Synthesis of Tofacitinib[J]. Chin J Pharm, 2013, 44(4): 321. |
| [7] |
于伟, 贾存江. HPLC测定恩替卡韦对映异构体[J]. 食品与药品, 2014, l6(5): 346. YU W, JIA CJ. Determination of enantiomers of Entecavir by HPLC[J]. Food Drug, 2014, l6(5): 346. |
| [8] |
王素琴, 汤玲君, 王艳. 反相高效液相色谱法拆分醋酸棉酚对映异构体[J]. 广东药学院学报, 2012, 28(4): 406. WANG SQ, TANG LJ, WANG Y. RP-HPLC chiral separation of gossypol acetic acid[J]. J Guangdong Pharm Univ, 2012, 28(4): 406. |
| [9] |
高琳雁, 山广志, 刘宗英, 等. 手性固定相高效液相色谱法拆分富马酸替诺福韦二吡呋酯对映异构体[J]. 中国抗生素杂志, 2013, 38(1): 46. GAO LY, SHAN GZ, LIU ZY, et al. Enantiomeric separation of tenofovir DF on a chiral column using high-performance liquid chromatography[J]. Chin J Antibiot, 2013, 38(1): 46. |
| [10] |
王东武, 王西宁, 丰梅君, 等. 手性固定相高效液相色谱法同时测定琥珀酸索利那新原料药中对映异构体和非对映异构体[J]. 分析测试学报, 2014, 33(10): 1123. WANG DW, WANG XN, FENG MJ, et al. Simultaneous determination of enantiome and diastereomers in Solifenacin Succinate bulk drug by high perform ance liquid chromatography with chiral stationary phase[J]. J Instrum Anal, 2014, 33(10): 1123. DOI:10.3969/j.issn.1004-4957.2014.10.06 |
| [11] |
于海云, 宋俊梅, 陈志丛. 利用手性固定相高效液相色谱法对焦谷氨酸对映异构体的分离[J]. 中国现代药物应用, 2011, 5(21): 83. YU HY, SONG JM, CHEN ZC. Enantiomeric separation of Pyroglutamic acid on a chiral column using high-performance liquid chromatography[J]. Chin J Mod Drug App1, 2011, 5(21): 83. DOI:10.3969/j.issn.1673-9523.2011.21.075 |
| [12] |
黄丽丹, 邢亚东, 王玲玲, 等. 2, 4-二硝基氟苯柱前衍生化HPLC法测定保健食品中牛磺酸含量[J]. 药物分析杂志, 2016, 36(1): 171. HUANG LD, XING YD, WANG LL, et al. Determination of taurine in health food by RP-HPLC with pre-column derivatization[J]. Chin J Pharm Anal, 2016, 36(1): 171. |
| [13] |
徐彦, 苏曼, 夏彩霞. HPLC法测定(1R, 2R)-(-)-1, 2-环己二胺中S, S对映异构体[J]. 齐鲁药事, 2012, 31(10): 592. XU Y, SU M, XIA CX. Determination of S, S-enantiomer in(1R, 2R)-(-)-1, 2-cyclohexanediamine by HPLC[J]. Qilu Pharm Aff, 2012, 31(10): 592. |
| [14] |
纪红英, 赵国敏, 杨琪, 等. NP-HPLC分离测定1-[3, 5-双(三氟甲基)苯基]乙醇对映异构体[J]. 食品与药品, 2013, 15(6): 400. JI HY, ZHAO GM, YANG Q, et al. Resolution of 1-[3, 5-Bis(trifluromethy1) phenyl]ethanol enantiomers by NP-HPLC with chiral chromatographic column[J]. Food Drug, 2013, 15(6): 400. |
| [15] |
汤君, 何彩玉, 程杰, 等. 恩曲他滨对映异构体的合成、表征及HPLC分析[J]. 化学研究与应用, 2014, 26(2): 294. TANG J, HE CY, CHENG J, et al. Synthesis, characterization and HPLC analysis of enantiomer of emtricitabine[J]. Chem Res Appl, 2014, 26(2): 294. |
| [16] |
田芹, 任丽萍, 吕春光, 等. 反相色谱条件下三唑类手性农药对映异构体的拆分[J]. 分析化学研究简报, 2010, 38(5): 688. TIAN Q, REN LP, LÜ CG, et al. Chiral resolution of eight triazole pestioioles by high Performance liquid chromatography under reversed phase conditions[J]. Chin J Anal Chem, 2010, 38(5): 688. |
| [17] |
赵梅仙, 张传良, 马佳颖, 等. 氟苯尼考对映异构体手性拆分及其光学纯度的测定[J]. 分析测试学报, 2013, 32(4): 459. ZHAO MX, ZHANG CL, MA JY, et al. separation of florfenicol enantiomer by chiral stationary phase and determination of optical purity[J]. J Instrum Anal, 2013, 32(4): 459. |
 2017, Vol. 37
2017, Vol. 37 
