在药物筛选领域,报告基因技术已经成为一种重要的研究工具,其利用药物处理细胞后报告基因的表达情况来反映药物的活性[1]。报告基因技术是把报告基因的编码序列与特定的顺式调控序列连接形成重组基因,在调控序列控制下进行表达,从而可直观地反应细胞内与基因表达有关的信号级联[2-3]。荧光素酶基因是一种常用的报告基因,其表达产物易检测,且灵敏度高、特异性好,广泛应用于体外监测与细胞的信号转导和基因表达有关的细胞活动等研究中[4-5]。
25-羟基维生素D3-24-羟化酶即CYP24A1,是维生素D代谢过程中的关键酶,可催化25-羟基维生素D3[25(OH)D3]和1,25-双羟基维生素D3[1,25(OH)2D3]转化为24-羟基化产物,从而使活性维生素D分子代谢失活。目前研究已初步证明,CYP24A1与结肠癌细胞、乳腺癌细胞、前列腺癌细胞等的发生与发展有密切联系[6-7]。CYP24A1基因的启动子区包含2个维生素D反应元件(vitamin D responsive elements,VDREs)。与配体结合的维生素D受体(VDR)与类视黄醇X受体(RXR)在细胞核内形成异源二聚体,结合在CYP24A1基因启动子区的VDRE,并激活CYP24A1基因的转录[8]。同时,CYP24A1的表达也受到了多种因素的调节,包括甲状旁腺素(PTH)、成纤维细胞生长因子(FGF-23)和1,25(OH)2D3[9]。在正常组织中,1,25(OH)2D3可高度诱导CYP24A1的表达,而激活的CYP24A1会使1,25(OH)2D3迅速代谢[8]。
因此,依据1,25(OH)2D3能作用于人CYP24A1启动子,从而启动下游基因表达的原理,构建含人CYP24A1启动子的荧光酶报告基因载体,经活性维生素D的药物处理以及荧光酶报告基因检测,分析载体的转染及基因表达效率,建立类维生素D活性药物的筛选模型,为进一步开发新型靶向治疗药物提供实验基础。
1 材料与方法 1.1 材料 1.1.1 实验材料Hela细胞为实验室保存,大肠杆菌DH5α(北京鼎国昌盛生物有限公司),pRP-RFP-luciferase骨架载体(广州赛业生物有限公司)。
1.1.2 试剂胎牛血清、DMEM培养液(Hyclone,1663073),Taq聚合酶、T4连接酶、内切酶Xba Ⅰ和EcoR Ⅰ(NEB),凝胶回收试剂盒(Omega,DP214),双蒸水ddH2O(超纯水灭菌后使用),DNA提取试剂盒(广州东盛生物),质粒DNA试剂盒(AxyGen生物,BSC01M1),TRI Reagent(SIGMA,T9424),NeofectTM DNA transfection reagent(北京生物,TF201201),萤火虫萤光素酶报告基因检测试剂盒(碧云天,RG005)。
1.2 方法 1.2.1 DNA提取及PCR扩增利用DNA提取试剂盒提取人血总DNA。根据GenBank人CYP24A1(NC_000020.11)序列信息设计引物,扩增片段约为1 347 bp。在引物序列中加入限制性内切酶Xba Ⅰ和EcoR Ⅰ位点(划线部位)。上游引物为:5’-GCTCTAGAGCATAGAAAAGTTGTATTGACTGTTGA-3’,下游引物为:5’-CGGAATTCCGGTGGCAGCCTGCTTTTTTGTA-3’,由西安东奥公司合成。以DNA为模板,用上下游引物进行PCR扩增,反应体系25 μL(buffer 2.5 μL,dNTP 2.0 μL,正向/反向引物各0.5 μL,模板DNA0.5 μL,Taq聚合酶0.2 μL,加ddH2O至25 μL)。梯度PCR条件:95 ℃预变性5 min,95 ℃变性30 s,52~62 ℃退火30 s,72 ℃延伸90 s,35个循环,最后72 ℃再延伸10 min。用1%琼脂糖凝胶电泳,参照Omega胶回收试剂盒,回收纯化PCR产物。
1.2.2 酶切、连接及转化将回收产物(1 347 bp)和带有红色荧光蛋白及荧光素酶基因的空表达载体pRP-RFP-luciferase(约为5 300 bp)用限制性内切酶Xba Ⅰ和EcoR Ⅰ进行酶切。双酶切体系:2.0 μLbuffer,1.0 μL载体及目的片段,Xba Ⅰ和EcoR Ⅰ内切酶各0.5 μL,加ddH2O至20 μL。在37 ℃恒温水浴锅酶切3 h。用1%琼脂糖凝胶电泳后,参照Omega胶回收试剂盒回收纯化双酶切产物。将得到的线性载体pRP-RFP-luciferase和目的片段进行连接,连接体系(20 μL):pRP-RFP-luciferase 1 μL,目的片段5 μL,T4连接酶1 μL,ddH2O 13 μL。16 ℃连接过夜后,将产物转化至DH5α感受态,37 ℃恒温培养箱培养15 h。
1.2.3 阳性克隆的筛选及鉴定挑取单克隆菌落置于200 μL无菌ddH2O中,37 ℃、220 r·min-1振摇30 min。取上述1 μL菌液作为模板进行PCR,反应体系(25 μL):buffer 2.5 μL,dNTP 2.0 μL,上下游引物各0.5 μL,菌液1 μL,Taq聚合酶0.2 μL、ddH2O 18.3 μL。扩增反应程序同“1.2.1”所述。经1%琼脂糖凝胶电泳检测与目的片段大小一致的菌落即为阳性克隆。将阳性克隆进行扩大培养,再利用质粒提取试剂盒抽提重组质粒。取重组质粒进行双酶切验证,体系与程序同“1.2.2”所述。经双酶切验证后的质粒送往西安东奥公司进行测序。
1.2.4 重组质粒转染Hela细胞将细胞接种于六孔板中,以转染时细胞密度在60%~80%为宜。按照质粒转染说明书,制备转染复合物;将转染复合物加入细胞培养基中,混匀;培养24 h,换液并观察荧光。
转染分单质粒Luciferase(Luc组)和双质粒VDR-Luc组。Luc组共设15孔,转染36 h后,每孔以含有不同浓度活性1,25(OH)2D3的培养基处理(5个浓度分别为:0、0.01、0.1、1、10 nmol·L-1),每个浓度3个重复。VDR-Luc组的双质粒比例(VDR/Luc)分别为:0:1、1:1、2:1、3:1、4:1,各比例3个重复,两组共30孔。转染36 h后,一组(15孔)加入含有0.1 nmol·L-1活性1,25(OH)2D3的培养基进行处理。另一组(15孔)加入不含有活性1,25(OH)2D3的培养基进行处理。单/双质粒组均在转染48 h后,观察荧光。每孔加入1 mL预冷的PBS,吹打细胞脱落,将细胞悬液移至离心管中。
1.2.5 荧光素酶检测用萤火虫荧光素酶报告基因检测试剂盒进行检测。在各处理的细胞样品内分别加入500 μL细胞裂解液,混匀;充分裂解后,4 ℃、12 000 r·min-1离心5 min,取上清液100 μL置于96孔酶标板内,于BioTek荧光酶标仪中读取数据。
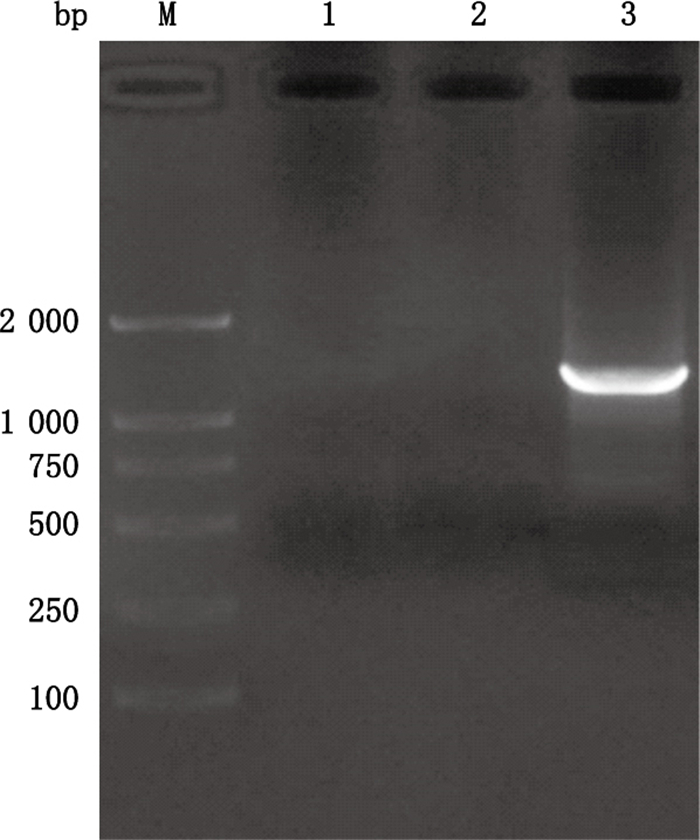
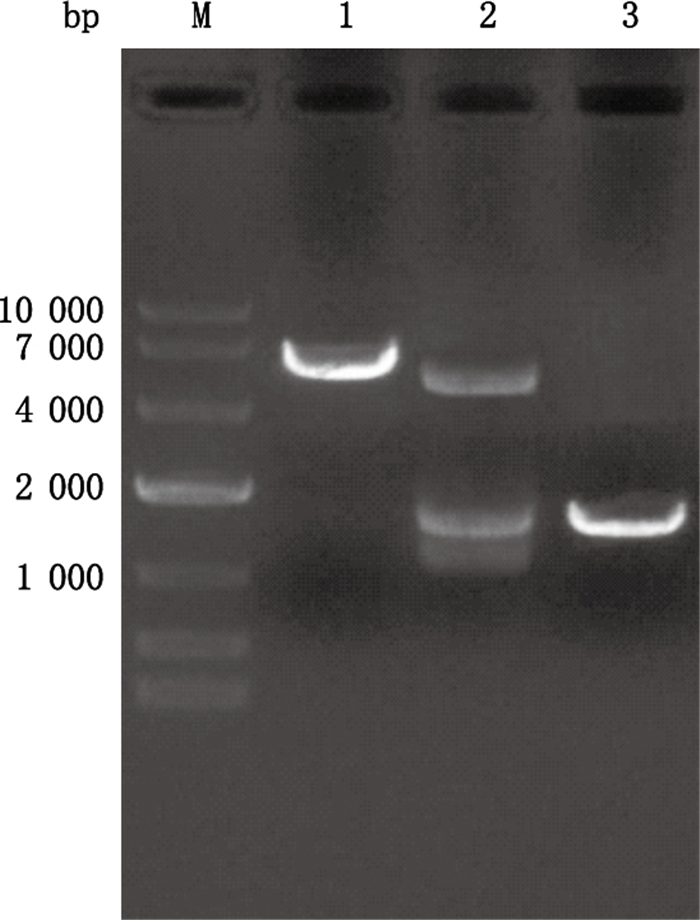
2 结果与分析 2.1 人CYP24A1启动子基因片段的克隆及重组质粒的鉴定以人血液DNA为模板,对人CYP24A1启动子基因片段进行PCR扩增,结果得到目的片段约为1 400 bp大小(图 1),与预期结果一致。人CYP24A1启动子基因片段与pRP-RFP-luciferase载体连接后转化,挑取阳性克隆,进行菌液PCR,对含有目的条带的相应菌液提取质粒。重组质粒经限制性内切酶Xba Ⅰ、EcoR Ⅰ双酶切的结果显示,双酶切产物中含有大小两条片段,其中小片段与目的基因大小相符(1 400 bp),大片段约5 000 bp,与空载体大小相符(图 2)。同时测序结果证明,重组质粒中的插入片段与GeneBank数据库上提供序列一致。
|
M.DNA分子标记(DL2 000 marker)1.无Taq酶(no Taq enzyme)2.无引物(no primer)3.体系完整(system integrity) 图 1 人CYP24A1启动子基因片段的PCR扩增 Figure 1 PCR amplification of human CYP24A1 promoter gene fragment |
|
M.DNA分子标记(DL 10 000 marker)1.单酶切片段(fragment after single enzyme digestion)2.双酶切片段(fragments after double enzyme digestion)3.PCR扩增片段(PCR amplified fragment) 图 2 含人CYP24A1启动子的重组质粒的酶切鉴定 Figure 2 Enzyme digestion of recombinant plasmid containing human CYP24A1 promoter |
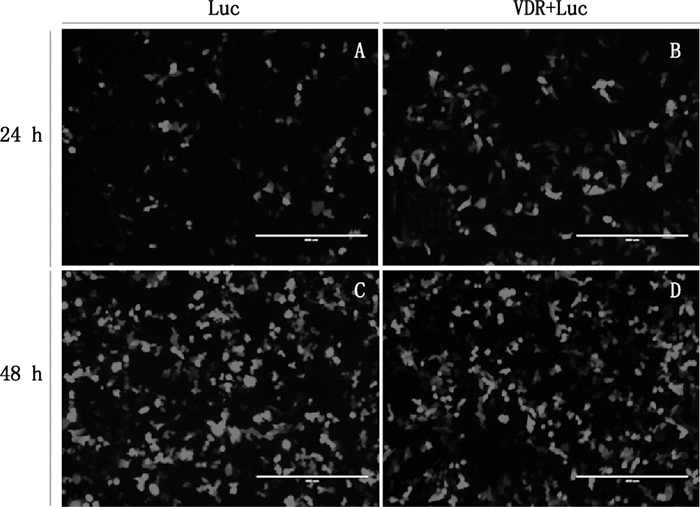
细胞转染过程中共设两个处理组:单质粒(Luc)和双质粒(VDR-Luc)。重组载体转染至Hela细胞,培养24 h后,换液并观察荧光;继续培养12 h进行活性1,25(OH)2D3加药处理;转染48 h后观察荧光并收集细胞。结果如图 3所示,Hela细胞在转染24 h,RFP表达在30%左右(图 3A和B)。而在转染48 h,RFP比例增加至80%左右(图 3C和D)。相应的转染处理组均成功表达了RFP,且表达效率随转染时间增加而增多,一方面说明重组质粒构建成功,另一方面说明转染效率没有受到转染成分的影响。
|
A、C.单质粒组转染后24 h和48 h的荧光表达(the expression of RFP after transfection with Luc in 24 and 48 h,respectively) B、D.双质粒组转染后24 h和48 h的荧光表达(the expression of RFP after transfection with VDR-Luc in 24 and 48 h,respectively) 图 3 重组质粒转染后RFP的表达 Figure 3 Expression of RFP after transfection with recombinant plasmid |
处理后的细胞悬液经荧光酶标仪测定后,读取荧光值并处理数据。结果表明,单质粒和双质粒加药处理后,活性1,25(OH)2D3激活了CYP24A1启动子,从而调控荧光素酶基因的表达,与底物通过化学反应发荧光。
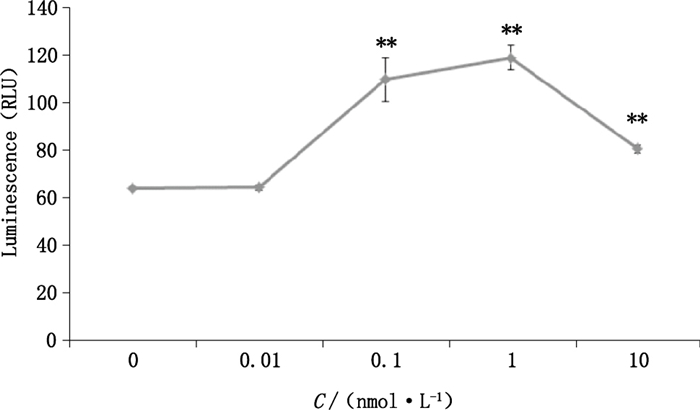
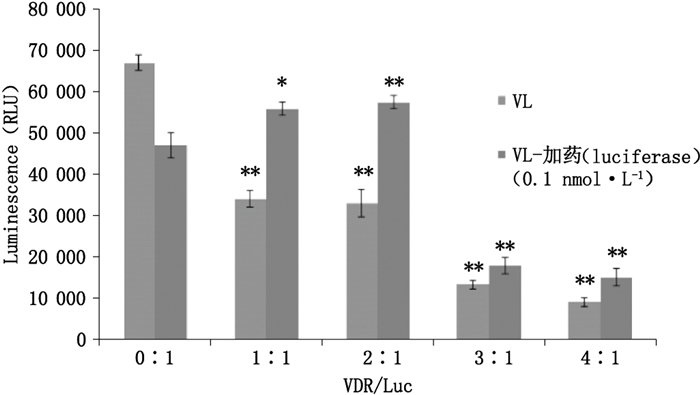
在单质粒加药处理组中,随着药物处理浓度的增加,荧光素酶活性表现出对维生素D药物浓度的依赖性。但当活性1,25(OH)2D3的浓度在0.1 nmol·L-1以上时,荧光素酶活性达到平台期甚至有所下降(图 4)。此外,双质粒加药处理组与双质粒不加药处理组相比,随着VDR所占比例的增加,荧光素酶活性先升高后下降。对于相同质粒比的处理组(如VDR/Luc为2:1),0.1 nmol·L-1的药物处理能增强荧光素酶的表达(图 5),说明活性1,25(OH)2D3可在一定程度上协助增强VDR对CYP24A1启动子的激活作用。而当药物处理浓度一定时,CYP24A1启动子的活性趋于稳定,不会随VDR比例的增加而进一步变强。
|
**:P<0.01表明两组差异极显著(showed significant differences between the two groups) 图 4 单质粒加药组荧光素酶的表达 Figure 4 Expression of single plasmid luciferase dosing group |
|
*:P<0.05表明两组差异显著(showed significant differences between the two groups) **:P<0.01表明两组差异极显著(showed significant differences between the two groups) 图 5 双质粒和双质粒加药组荧光素酶的表达 Figure 5 Expression of double plasmid and double luciferase plasmid treatment groups |
研究表明,维生素D对白血病、结直肠癌、肺癌、鳞状细胞癌、乳腺癌和前列腺癌等细胞系具有一定的抑制作用[10]。因此,维生素D类似物的药物研发主要应用在Ⅰ形佝偻病、骨质疏松、白血病、牛皮癣、肾性骨营养不良、胰腺癌、前列腺癌和乳腺癌等的治疗和研究中,其中许多类似物药物已经进行到临床研究阶段[11-12]。许多类维生素D活性的维生素D衍生物已被批准投入到许多失调症的临床应用中,如抗银屑病药物钙泊三醇和22-奥沙骨化三醇;治疗继发性甲状旁腺机能亢进药物如1α(OH)D3;治疗骨质疏松症药物ED-71等。目前,维生素D及其类似物的体外活性检测方法主要包括高效液相色谱法和液相色谱-串联质谱法(LC-MS)、酶联免疫吸附测定法、化学发光免疫测定法(CIA)等,如O2C3(2-(3-羟丙氧基)-1α,25(OH)2D3)与MART-10(19-去甲基-2-(3-羟丙基)-1,25(OH)2D3)等的活性检测[9, 13-15]。相比较而言,荧光素酶报告基因技术可直观反映化合物生物学活性的功能信息,利用报告分子,很容易从众多维生素D类似物中筛选与信号分子活性维生素D功能相似的化合物,使药物筛选过程简单方便,具有较高的可靠性、可重复性、敏感性和适用性。
研究利用荧光素酶报告基因技术提供了一个体外维生素D活性药物的筛选体系。在单质粒加药处理组中,随着活性1,25(OH)2D3浓度的增加,荧光素酶活性先上升后下降。但在双质粒不加药处理组中,随着VDR比例的增加,荧光值下降。该结果与推测相反,可能是由于实验过程中仅仅保证了转染质粒总量的恒定,即VDR含量呈一定比例增加,而报告基因载体含量降低的原因造成的。这一结果从侧面说明,CYP24A1启动子表达充足是VDR能持续激活其转录活性的前提条件。同时,从双质粒加药处理组的结果可以反映出,VDR与活性1,25(OH)2D3可以协同刺激荧光素酶的表达,说明该系统可以有效的检测维生素D药物的生物活性。另外,为避免由于质粒转入细胞时效率的差异而带来的误差,可以同时转入海肾萤光素酶的报告基因质粒作为内参,进行双荧光素酶报告基因检测[3]。此外,作为维生素D活性药物的筛选模型,还可以利用其他有维生素D活性的药物再次验证该体系或方法的有效性,使该荧光素酶报告基因的检测方法更加完善。
利用荧光素酶报告基因检测维生素D生物活性的方法简单可行,为后续筛选和研发具有维生素D活性的药物奠定了体外筛选的细胞基础。
| [1] |
于雷, 范文红, 王兰, 等. 报告基因法检测促胰岛素分泌肽融合蛋白生物学活性[J]. 药物分析杂志, 2016, 36(03): 426. YU L, FAN WH, WANG L, et al. Reporter gene assay for bioactivity determination of Exendin-4-HSA[J]. Chin J Pharm Anal, 2016, 36(3): 426. |
| [2] |
GILAD AA, WINNARD PTJR, VAN ZIJL PC, et al. Developing MR reporter genes: promises and pitfalls[J]. NMR in Biomed, 2007, 20(3): 275. |
| [3] |
杜彦艳, 单保恩. 报告基因荧光素酶在科研中的应用[J]. 中华肿瘤防治杂志, 2009, 16(09): 715. DU YY, SHAN BE. Reporter gene luciferase in application of scientific research[J]. Chin J Cancer Prev Treat, 2009, 16(09): 715. |
| [4] |
韦忠红, 朱智杰, 刘玉萍, 等. TNF-α 3'-UTR双荧光素酶报告基因系统的构建及丹参酮类药物筛选[J]. 中国药理学通报, 2015, 31(01): 77. WEI ZH, ZHU ZJ, LIU YP, et al. Construction of pGL3-TNF-α 3'UTR luciferase reporter gene and tanshinone compounds screening[J]. Chin Pharmacol Bull, 2015, 31(01): 77. DOI:10.3969/j.issn.1001-1978.2015.01.017 |
| [5] |
张信基, 石小军, 孙鹏宇, 等. Gluc-Fluc双荧光素酶质粒转染MB49细胞后荧光表达特性[J]. 南方医科大学学报, 2011, 31(03): 499. ZHANG XJ, SHI XJ, SUN PY, et al. Expression of Gluc-Fluc dual luciferase plasmid after transfection into MB49 bladder cells[J]. J South Med Univ, 2011, 31(03): 499. |
| [6] |
LUO W, YU WD, MA Y, et al. Inhibition of protein kinase CK2 reduces Cyp24a1 expression and enhances 1, 25-dihydroxyvitamin D(3) antitumor activity in human prostate cancer cells[J]. Cancer Res, 2013, 73(7): 2289. |
| [7] |
KOMAGATA S, NAKAJIMA M, TAKAGI S, et al. Human CYP24 catalyzing the inactivation of calcitriol is post-transcriptionally regulated by miR-125b[J]. Molec Pharmacol, 2009, 76(4): 702. |
| [8] |
SAKAKI T, YASUDA K, KITTAKA A, et al. CYP24A1 as a potential target for cancer therapy[J]. Anti Cancer Agents Med Chem, 2014, 14(1): 97. |
| [9] |
JONES G, PROSSER DE, KAUFMANN M. 25-Hydroxyvitamin D-24-hydroxylase(CYP24A1): its important role in the degradation of vitamin D[J]. Archiv Biochem Biophy, 2012, 523(1): 9. |
| [10] |
曹雨娜, 张虹. 维生素D抗肿瘤作用的研究进展[J]. 中国临床药学杂志, 2014, 23(02): 129. CAO YN, ZHANG H. The research review of anti-tumor of Vitamin D[J]. Chin J Clin Pharm, 2014, 23(02): 129. |
| [11] |
YAMADA S, SHIMIZU M, YAMAMOTO K. Structure-function relationships of vitamin D including ligand recognition by the vitamin D receptor[J]. Med Res Rev, 2003, 23(1): 89. |
| [12] |
MASUDA S, JONES G. Promise of vitamin D analogues in the treatment of hyperproliferative conditions[J]. Mol Cancer Therap, 2006, 5(4): 797. |
| [13] |
姜烈君, 黄华艺. 血清维生素D与肿瘤的关系及其检测方法的研究进展[J]. 中国临床新医学, 2014, 7(10): 986. JIANG LJ, HUANG HY. Association between serum vitamin D level and cancer and its detection methods[J]. Chin J New Clin Med, 2014, 7(10): 986. DOI:10.3969/j.issn.1674-3806.2014.10.33 |
| [14] |
ABE D, SAKAKI T, KUSUDO T, et al. Metabolism of 2 alpha-propoxy-1 alpha, 25-dihydroxyvitamin D3 and 2 alpha-(3-hydroxypropoxy)-1 alpha, 25-dihydroxyvitamin D3 by human CYP27A1 and CYP24A1[J]. Drug Metab Dispos: Biolog Fate Chem, 2005, 33(6): 778. |
| [15] |
CHIELLINI G, RAPPOSELLI S, ZHU J, et al. Synthesis and biological activities of vitamin D-like inhibitors of CYP24 hydroxylase[J]. Steroids, 2012, 77(3): 212. DOI:10.1016/j.steroids.2011.11.007 |
 2017, Vol. 37
2017, Vol. 37 