鱼精蛋白(protamine)是一种富含精氨酸(约70%)的低分子碱性蛋白质,主要在鱼类成熟精子细胞核中作为与DNA结合的核精蛋白存在[1]。目前,我国应用于临床的鱼精蛋白主要提取自鲱鱼和鲑鱼,为硫酸盐的形式。由于其带有的强阳电荷可与肝素分子中维持抗凝活性的负电荷结合,形成稳定复合物,从抗凝血酶-Ⅲ(AT-Ⅲ)置换出肝素,阻碍肝素-AT-Ⅲ复合物的形成,阻止AT-Ⅲ构象发生改变,降低抗Xa因子活性,减弱Xa因子的灭活,促使凝血功能恢复,从而起到拮抗肝素活性的作用,是目前临床上唯一使用的一种抗肝素类药物,自1937年被发现以来,便在外科手术中发挥了不可替代的作用。同时,硫酸鱼精蛋白也是一种弱抗凝剂,具有轻度抗凝血酶原激酶作用,使用过量亦可增加出血风险[2-4]。另外,硫酸鱼精蛋白因带有正电荷,亦实际应用于生物制品长效制剂的制备,如与带负电的胰岛素、促皮质激素等多肽、蛋白质结合形成络合物,以制备长效制剂[5-6]。
硫酸鱼精蛋白及其注射液收录于2015年版中国药典(ChP 2015)二部,为我国国家基本药物,亦是世界卫生组织(World Health Organization,WHO)基本药物[1]。由于硫酸鱼精蛋白是临床手术中不可或缺的必备急救药物,在拮抗肝素抗凝活性的同时亦具有抗凝性,因此,临床用药量必须准确得当。硫酸鱼精蛋白的生物效价是其质量控制的重要内容之一,现行ChP收载的硫酸鱼精蛋白生物测定法为兔全血法和兔/猪血浆法[7],这2种方法分别首次收录于1977年版中国药典和1985年版中国药典增补本,至今已沿用30余年,为硫酸鱼精蛋白的临床用药安全提供了有力保障。但现行方法亦存在缺陷,主要表现为实验终点的全血/血浆凝结判断仅靠肉眼观察,主观因素对实验结果干扰较大;此外,该方法类似于半定量实验,精密度较低,因此,亟待寻求更为客观、精密、简便的替代方法。本文考察的肝素结合力法与原有的血凝测定法相比,实验原理基本一致,将实验终点由肉眼观察转化为仪器测定,增强了实验的客观性;实验方法采用连续滴定,增加实验精密度;弃除动物全血或血浆的使用,使得实验简便易行;实验涉及的主要仪器为紫外分光光度计,是药品检验实验室常用仪器,方法易于推广。本文旨在通过实验及其所获数据进行分析,考查肝素结合力法替代血凝法测定硫酸鱼精蛋白生物效价的可行性。
1 仪器与试药 1.1 仪器TU-1901紫外可见分光光度计(北京普析通用仪器有限责任公司);UV-2600紫外分光光度计(日本Shimadzu);BT 224S电子天平(Sartorius Mechatronics T & H GmbH);DK S26电热恒温水浴锅(上海森信实验仪器有限公司);Millipore超纯水系统;移液器(美国Rainin)。
1.2 试剂及试药肝素钠国家标准品(中国食品药品检定研究院,批号150509-200912,规格:197 IU·mg-1);WHO肝素钠国际标准品(英国国家生物制品检定所,批号07/328,规格:2145 IU·支-1);硫酸鱼精蛋白国家对照品(中国食品药品检定研究院,批号150521-9102,规格:110 IU·mg-1);0.9%氯化钠注射液(石家庄四药有限公司,批号:1501193101规格:100 mL:0.9 g)。
目前,全国共2个生产厂家具有硫酸鱼精蛋白注射液的生产批准文号,选取2个生产厂家硫酸鱼精蛋白注射液及其生产用原料药作为考察供试品。
1.3 实验动物健康新西兰家兔,2.0~2.5 kg,购于中国食品药品检定研究院实验动物资源研究所,动物生产许可证号:SCXK(京)2014-0013。
2 方法与结果 2.1 硫酸鱼精蛋白效价血凝测定法取8支洁净干燥试管,第1管和第8管设为空白对照管,加入0.9%氯化钠溶液0.2 mL,第2~7管为供试品管,每管均加入1 mg·mL-1供试品溶液0.1 mL,再加入不同浓度的肝素标准品溶液0.1 mL(相邻两个浓度每1 mL中所含肝素效价相差5个单位),立即混匀。取新鲜兔全血,分别加入上述8支试管,每管0.8 mL,立即混匀,避免产生气泡,并开始计时,将试管置于37 ℃±0.5 ℃恒温水浴中,记录各管凝血时间。2支对照管的凝结时间相差不得超过1.35倍。供试品管的凝结时间不超过两支对照管平均凝结时间150%的各管中,以肝素浓度最高的一管作为终点管。重复5次,5次试验测得终点管的肝素浓度,相差不得大于10个单位。5次结果的平均值,即为每1 mg硫酸鱼精蛋白中和肝素的效价[7-8]。
2.2 硫酸鱼精蛋白效价肝素结合力法将不同浓度的硫酸鱼精蛋白供试品溶液(0.05、0.10、0.15、0.20 mg·mL-1)2.5 mL加至紫外可见分光光度计比色池中,吸收波长设定在可见光范围内,逐渐加入肝素钠滴定液(50 IU·mL-1),至吸光度陡增时,记录滴定液体积。按照下列公式计算每1 mg硫酸鱼精蛋白中和肝素的效价:硫酸鱼精蛋白效价(IU·mg-1)=(VH×CH)/(VS×CS),其中VH为肝素钠滴定液加入的体积(mL),CH为肝素滴定液的浓度(IU·mL-1),VS为硫酸鱼精蛋白供试品溶液体积(mL),CS为硫酸鱼精蛋白供试品溶液浓度(mg·mL-1)[9-11]。将测定平均值作为最终效价结果。
2.3 肝素结合力法的精密度考察 2.3.1 重复性将硫酸鱼精蛋白用纯化水配制成0.05、0.10、0.15、0.20 mg·mL-1,按照方法与结果“2.2”项下方法进行测定,每个浓度重复测定6次。采用GraphPad Prism软件进行方差分析(one-way ANOVA),结果显示,各浓度间效价测定结果无显著性差异(p > 0.05),RSD均小于2%,结果见表 1。
|
|
表 1 硫酸鱼精蛋白效价肝素结合力法重复性考察(n=6) Table 1 Repeatability of heparin-binding capacity of protamine sulfate |
中间精密度12名实验人员选取同1批硫酸鱼精蛋白,使用相同仪器,采用肝素结合力法测定其效价。共设置4个硫酸鱼精蛋白溶液浓度:0.05、0.10、0.15、0.20 mg·mL-1,每个浓度重复测定3次。每人每天进行2次独立实验,每人共进行2d实验。实验结果表明,肝素结合力法在各浓度硫酸鱼精蛋白水平下的中间精密度均较小( < 2%),详见表 2。
2.4 肝素结合力法的准确度考察采用加样回收试验对方法的准确度进行考察。将效价为110 IU·mg-1的硫酸鱼精蛋白国家对照品加入硫酸鱼精蛋白注射液处方量空白辅料中(含0.25%苯酚的NaCl注射液),制成10 mg·mL-1硫酸鱼精蛋白溶液,再加纯化水稀释成0.05、0.10、0.15 mg·mL-1。按照方法与结果“2.2”项下方法进行测定,每个浓度重复测定2次,共进行3次独立实验。经肝素结合力法测定,硫酸鱼精蛋白国家对照品的效价为108.96 IU·mg-1,回收率为99.1%,RSD为0.93 %。
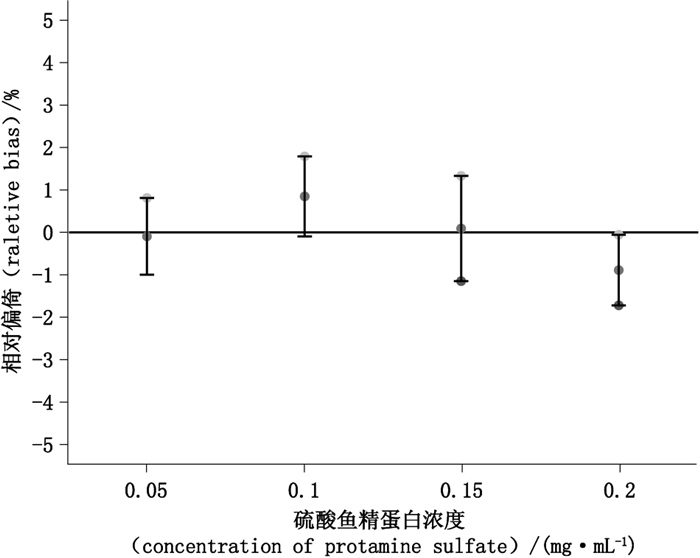
2名实验人员选取同1批硫酸鱼精蛋白,使用相同仪器,采用肝素结合力法测定其效价。共设置4个硫酸鱼精蛋白溶液浓度:0.05、0.10、0.15、0.20 mg·mL-1,每个浓度重复测定3次。每人每天进行2次独立实验,每人共进行2 d实验。将各浓度点,各次实验测定的效价平均值作为本批次硫酸鱼精蛋白的理论值,即138.94 IU·mg-1,用以计算实验相对偏倚,结果详见表 3及图 1。实验结果表明,各浓度下测定的硫酸鱼精蛋白效价的实验相对偏倚均 < 1%,且其90%置信区间均在可接受标准内(+5.00%~-4.76%)。
|
|
表 3 各浓度硫酸鱼精蛋白的测定平均效价数及相对偏倚[10](n=8) Table 3 Average measured potency and relative bias at individual levels of protamine sulfate |
|
图 1 各浓度硫酸鱼精蛋白对应的相对偏倚及其可接受标准(可接受标准下限为100×[(1/1.05)-1]=-4.76%) Figure 1 Plot of 90% confidence intervals for relative bias versus the acceptance criterion at individual levels of protamine sulfate(Note lower acceptance criterion is equal to 100×[(1/1.05)-1]=-4.76%) |
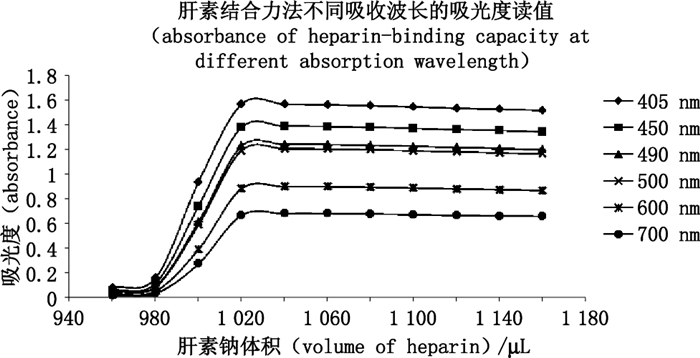
将硫酸鱼精蛋白国家对照品配制成0.05、0.10、0.15 mg·mL-1,按照方法与结果“2.2”项下方法进行测定每个浓度重复测定2次,考察不同波长对肝素结合力法效价测定的影响。共进行3次独立实验。在可见光波长范围内选取405、450、490、500、600、700 nm作为测定波长,同时进行测定。3次实验结果表明,使用不同波长测定的硫酸鱼精蛋白效价均一致,即吸光度发生突变时对应的肝素钠体积相同。但各波长间的吸光度读值具有明显差异,以0.15 mg·mL-1硫酸鱼精蛋白浓度为例,不同吸收波长的测定结果见图 2。
|
图 2 肝素结合力法不同吸收波长测定0.15 mg·mL-1硫酸鱼精蛋白效价的吸光度读值 Figure 2 Absorbance of heparin-binding capacity at different absorption wavelength(concentration of protamine sulfate:0.15 mg·mL-1) |
选取2个生产厂家(用A、B表示)的硫酸鱼精蛋白注射液共计15批次,分别采用血凝法和肝素结合力法测定其效价。结果显示,肝素结合力法测定的硫酸鱼精蛋白效价略低于凝血法,采用GraphPad Prism软件进行配对t检验,两法测定结果无显著性差异(p > 0.05),结果见表 4。采用二元拟合的方法分析两种方法测定结果的相关性,表明两种方法具有显著的相关性(p < 0.000 1),二元拟合函数:
|
|
表 4 硫酸鱼精蛋白效价肝素结合力法与血凝法测定结果汇总 Table 4 Protamine sulfate potency determined by heparin-binding capacity method and blood coagulation method |
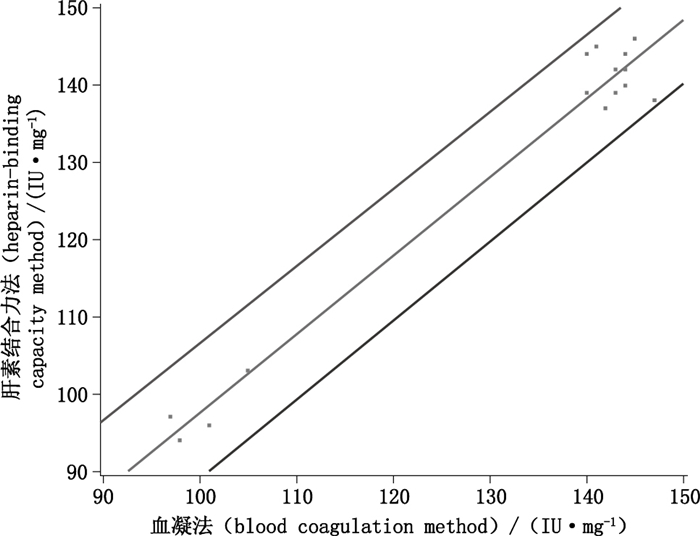
Y(滴定法)=-4.157 6+1.017 4X(兔全血法)R2=0.971 0
详见图 3。函数斜率与1之间无显著性差异(p > 0.05),表明凝血法与肝素结合力法测定硫酸鱼精蛋白效价的结果相当。
|
图 3 凝血法(X)与肝素结合力法(Y)测定硫酸鱼精蛋白效价结果回归关系图(红线为回归直线,两条蓝线为置信区间) Figure 3 Linear regression graph of protamine sulfate potency blood determined by coagulation method(X)and heparin-binding capacity method(Y)(The red line was regression line, blue lines were confidence interval) |
肝素结合力法的实验原理是利用硫酸鱼精蛋白与肝素结合,形成稳定复合物并导致溶液形成乳状浑浊的特性,检测其在可见光波长下吸光度的突变作为实验终点。本研究考察了不同吸收波长对实验结果的影响,结果表明:虽然各波长测定的吸光度读值具有明显差异,即同一试验条件下波长越低,吸光度读值越大,但吸光度突变所对应的肝素体积是相同的,因此,使用不同吸收波长对硫酸鱼精蛋白效价测定无影响。但波长较低时,吸光度较大,在测定高浓度硫酸鱼精蛋白时吸光度接近仪器检测上线,读值变化不灵敏度;而波长过高,吸光度过小,吸光度突变不明显。因此,推荐使用450~500 nm作为测定波长。本实验亦考察了滴定时(即加入肝素)等待时间对实验结果的影响,结果表明等待时间仅对吸光度读值产生影响,对吸光度突变的终点判断,即突变点所对应加入的肝素体积无影响,因此,滴定时间对硫酸鱼精蛋白效价测定结果无影响。
肝素结合力法测定硫酸鱼精蛋白采用连续滴定,各浓度硫酸鱼精蛋白对应的效价间隔均小于血凝法,因此,可一定程度提高实验的精密度和准确度。精密度考察结果显示:各浓度硫酸鱼精蛋白对应的重复性均小于2%,且硫酸鱼精蛋白浓度越高,对应的实验结果重复性越好(0.05 mg·mL-1 < 0.10 mg·mL-1 < 0.15 mg·mL-1 < 0.20 mg·mL-1)。各浓度硫酸鱼精蛋白对应的中间精密度及其平均值亦均小于2%,表明肝素结合力法具有较好的精密度,且远低于血凝测定法的10%。在准确度考察方面,结合我国硫酸鱼精蛋白注射液生产现状,在加样回收实验中加入处方量空白辅料(含0.25%苯酚的NaCl注射液),肝素结合力法的加样回收率可达99%,表明其具有良好的准确度,且苯酚对实验的测定不存在干扰。
目前,国内有2个生产厂家生产硫酸鱼精蛋白注射液,本研究采用肝素结合力法与血凝法测定2个生产厂家的产品,结果表明两种方法的效价测定结果无显著性差异,且通过二元拟合方法分析二者具有非常显著的相关性。但采用肝素结合力法测定的2个生产厂家的硫酸鱼精蛋白效价均略低于血凝法(无显著性),分析其原因可能是由于血凝法通常采用5个单位的效价间隔,远大于肝素结合力,从而导致效价测定结果偏大。因此,推测肝素结合力法的测定结果虽略低于血凝法,但更接近真实值,具有更高的准确度。此外,血凝法实验体系中存在的粘多糖、核酸及纤维蛋白原等物质亦可能与鱼精蛋白相结合,因而,肝素结合力法可避免凝血法中因生物变异引入的实验误差[12]。
综上所述,本文通过实验验证了肝素结合力法可用于我国硫酸鱼精蛋白原料药及制剂的效价测定;与血凝法相比具有实验结果更加客观,精密度和准确度更高,且简便、经济易行等优点;可完全替代现有的法定全血凝结法,从而更好的把控产品质量,保障临床用药安全。
| [1] |
GUCINSKI AC, BOYNE MT, KEIRE DA. Modern analytics for naturally derived complex drug substances: NMR and MS tests for protamine sulfate from chum salmon[J]. Anal Bioanal Chem, 2016, 407(3): 749. |
| [2] |
谢安, 魏蔚. 鱼精蛋白的应用现状及存在的问题[J]. 中国胸心血管外科临床杂志, 2016, 23(1): 78. XIE A, WEI W. Application status and existing problems of protamine[J]. Chin J Clin Thorac Cardiovasc Surg, 2016, 23(1): 78. DOI:10.7507/1007-4848.20150017 |
| [3] |
穆云龙, 余旭亚, 孟庆雄, 等. 鱼精蛋白的研究与开发[J]. 食品与药品, 2006, 8(9): 11. MU YL, YU XY, MENG QX, et al. Research and development of protamine of fish[J]. Food Drug, 2006, 8(9): 11. |
| [4] |
SOKOLOWSKA E, KALASKA B, MIKLOSZ J, et al. The toxicology of heparin reversal with protamine: past, present and future[J]. Expert Opin Drug Metab Toxicol, 2016, 12(8): 897. DOI:10.1080/17425255.2016.1194395 |
| [5] |
朱晨晨, 乔德水, 涂家生. RP-HPLC法测定精蛋白胰岛素注射液中硫酸鱼精蛋白的含量[J]. 药物生物技术, 2008, 15(3): 212. ZHU CC, QIAO DS, TU JS. Determination of protamine sulphate in protamine insulin injection by RP-HPLC[J]. Pharm Biotechnol, 2008, 15(3): 212. |
| [6] |
LAMALLE C, SERVAIS AC, DEMELENNE A, et al. Analysis of protamine peptides in insulin pharmaceutical formulations by capillary electrophoresis[J]. J Sep Sci, 2016, 39(6): 1189. DOI:10.1002/jssc.v39.6 |
| [7] |
中国药典2015年版. 四部[S]. 2015: 170 ChP 2015. Vol Ⅳ [S]. 2015: 170 |
| [8] |
冷炜. 药品的生物检定[M]. 北京: 气象出版社, 1995. LENG W. The Drug Bioassay[M]. Beijing: China Meteorological Press, 1995. |
| [9] |
JP 16[S]. 2008: 1816
|
| [10] |
USP 38[S]. 2016: 5069
|
| [11] |
BP 2015[S]. 2015: 695
|
| [12] |
JAQUES LB. Protamine-antagonist to heparin[J]. Can Med Assoc J, 1973, 108(10): 1291. |
 2017, Vol. 37
2017, Vol. 37 
