白色念珠菌(Candida albicans)是第1个完成全基因组测序的致病性真核生物(2004年6月,白色念珠菌标准株SC5314的全序列测定完成并公布,http://www.candidagenome.org),目前在基因组信息研究、基因功能、转录组、蛋白质组等方面均取得了重要进展。白色念珠菌,又称为白色假丝酵母,是一种重要的人兽共患病病原,也是临床上最主要的侵袭性真菌之一,侵犯皮肤、粘膜,引起内脏或全身感染,早产新生儿、癌症患者、艾滋病患者、免疫抑制个体、器官移植者、导管术者感染后具有较高的致死率[1-7]。因此,选用合适可靠的技术方法,快速检测、精准鉴定白色念珠菌是一个值得重视的问题。在实验室诊断中,尽管分离培养是确诊白色念珠菌感染的可靠方法,但操作烦琐耗时费力,不适合大批标本检测。直接涂片镜检操作简便,但敏感性和特异性不高。血清学方法不适合免疫抑制个体检测,难以做出早期诊断且特异性欠佳[8-10]。电泳核型分析(electrophoretic karyotype)、限制性片段长度多态性(restriction fragment length polymorphism,RFLP)、随机扩增多态性DNA(randomly amplifiled polymorphic DNA,RAPD)和脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)仅囿于菌株分型鉴定[11-13]。对于动物源性食品、药品、生物制品或医疗器械等新兴产品中微量或痕量白色念珠菌的精准检定而言上述方法均不适合。
随着现代分子生物学技术在临床检验诊断学中的应用,疾病诊断已深入到基因水平。聚合酶链式反应(polymerase chain reaction,PCR)、基因测序(gene sequencing)、生物芯片(biochip)、蛋白质组(proteome)、代谢组学(metabonomics)等基因诊断(gene diagnosis,又称为分子诊断molecular diagnosis)技术在感染性疾病、遗传性疾病、肿瘤性疾病等的诊断中发挥着愈发重要的作用。TaqMan探针(TaqMan probe)实时荧光定量PCR(real-time fluorescence quantitative PCR,RTFQ-PCR)是在普通PCR基础上加入荧光标记TaqMan探针,将核酸扩增、杂交及光谱技术有机结合起来,对目的基因进行准确定量检测。与普通PCR相比,Real-time PCR在单管中扩增检测靶DNA,这不仅避免了PCR后操作的时间浪费还减少了潜在的污染,但Real-time PCR检测体系也存在非特异性反应,主要是因为荧光染料(如SYBR green)非特异性结合,而灵敏度高的TaqMan-小沟结合物(TaqMan-minor groove binder probe,TaqMan-MGBprobe)探针能有效避免核苷酸错配,比传统的TaqMan探针更精确稳定结合[14-16]。至今,国内外还未见用TaqMan-MGB探针RTFQ-PCR检测白色念珠菌的研究报道。本研究建立了白色念珠菌TaqMan-MGB探针RTFQ-PCR检测方法,联合真菌培养和基因克隆测序鉴定及抗真菌药物敏感性试验分析,成功应用于临床标本中白色念珠菌的快速定量检定,为白色念珠菌感染的早期诊疗提供病原学依据。
1 材料与方法 1.1 主要试剂和参考株及质粒标准品TaqMan Universal PCR Master Mix(TaqMan通用型RTFQ-PCR预混合溶液)购自美国Life Technologies公司。Nuclease-Free Water(无核酸酶的水)购自美国Progema公司。QIAamp DNA Mini Kit(QIAamp DNA小量提取试剂盒)购自德国Qiagen公司。dNTP Mixture(脱氧核糖核苷三磷酸混合溶液,deoxy-ribonucleoside triphosphate包括dATP、dGTP、dTTP、dCTP,是PCR扩增、荧光定量等反应所需的基本原料)、EX Taq(具有3′→5′ Exonuclease活性的耐热性DNA聚合酶。在普通PCR条件下,与Taq DNA Polymerase相比,具有扩增效率高、错配率低的优良性能)、Agarose(琼脂糖)、DNA Ladder Marker(DAN分子量标准)购自日本TaKaRa公司。白色念珠菌、光滑念珠菌(Candida glabrata)、东方伊萨酵母(Issatchenkia orientalis)、卵形毛孢子菌(Trichosporon ovoides)、泰泽氏菌(Clostridium piliforme)、幽门螺杆菌(Helicobacter pylori)、空肠弯曲杆菌(Campylobacter jejuni)、刚地弓形虫(Toxoplasma gondii)、蓝氏贾第鞭毛虫(Giardia lamblia)、隐匿管状线虫(Syphacia obvelata)、鼠痘病毒(Ectromelia virus)、日本乙型脑炎病毒(Japanese encephalitis virus)、淋巴细胞脉络丛脑膜炎病毒(Lymphocytic choriomeningitis virus)核酸由本实验室保存。含白色念珠菌内转录间隔区(internal transcribed spacer,ITS)和26S核糖体RNA(26S ribosomal RNA,26S rRNA)基因的质粒标准品由本实验室制备,标准质粒DNA浓度定量为5×1010拷贝·μL-1。
1.2 临床标本中白色念珠菌分离和抗真菌药物敏感性试验分析及DNA提取69例临床肝癌肝硬化病人腹水和血清由首都医科大学附属北京佑安医院提供。60只小型猪来自国家实验用小型猪种质资源基地,采血分离血清,采集鼻拭子、颌下淋巴结、气管、心、肺、肝、脾、肾、肠、脑标本。60只野生成年树鼩来自云南、65只长爪沙鼠来自浙江,采血分离血清。60只灰仓鼠(Cricetulus migratorius)来自新疆,采血分离血清,采集毛、气管、肠。112只猴和55只犬,来自北京,采血分离血清,采集毛、新鲜粪便。122只地鼠、160只豚鼠、40只大鼠、382只小鼠来自全国各地,采血分离血清,采集毛、肺、肝、肠,部分为基因修饰小鼠胎儿、脚和尾巴皮肤溃烂者标本。
在负压生物安全柜内,将采集的标本作特定处理后分别接种沙氏琼脂斜面,置35 ℃培养2 d。选取类酵母型菌落进行鉴定,涂片镜检,实时动态显微视屏摄录有卵圆形孢子和假菌丝者,转种沙氏琼脂和皮肤病原真菌鉴别培养基,初步鉴定的菌株经过3次反复分离纯化后,参考文献[17-19]鉴定临床标本中分离的白色念珠菌并进行抗真菌药物敏感性试验。使用QIAamp DNA mini kit提取临床标本和白色念珠菌分离株DNA。
1.3 白色念珠菌TaqMan-MGB探针和RTFQ-PCR引物设计及反应体系优化为了避免TaqMan-MGB探针RTFQ-PCR检测白色念珠菌的假阳性和假阴性结果,特异性引物和探针的选择设计显得非常重要。通过前期大量的文献检索和扫描现行可供参考的基因库数据再经计算机核查比对,本研究针对白色念珠菌ITS和26S rRNA基因设计种特异性探针引物(表 1)。白色念珠菌TaqMan-MGB探针和RTFQ-PCR引物由美国Life technologies公司合成。
|
|
表 1 白色念珠菌TaqMan-MGB探针和RTFQ-PCR引物序列 Table 1 Sequences of TaqMan-MGB probe and RTFQ-PCR primers for Candida albicans |
对白色念珠菌TaqMan-MGB探针RTFQ-PCR反应体系进行优化,采用20 μL的总反应体积,依次加入TaqMan Universal PCR Master Mix 10 μL,探针引物1 μL,模板DNA 1 μL,Nuclease-Free Water 8 μL。TaqMan-MGB探针RTFQ-PCR反应参数:50 ℃ 2 min,1个循环;95 ℃ 10 min,1个循环;95 ℃ 15 s,60 ℃ 1 min,共40个循环。每次试验均以Nuclease-Free Water为阴性对照,白色念珠菌核酸为阳性对照。用ABI 7500 Fast全自动荧光定量PCR仪检测。通过仪器自带SDS软件实时观察PCR荧光扩增曲线并采集数据。
1.4 白色念珠菌TaqMan-MGB探针RTFQ-PCR标准曲线的构建、特异性、灵敏度试验将白色念珠菌标准质粒(5×1010拷贝·μL-1)以Nuclease-Free Water按10倍倍比稀释,各取1 μL系列标准模板(5×1010~5×100拷贝·μL-1)加入反应管中,每个标准浓度平行重复3次试验,按优化后的TaqMan-MGB探针RTFQ-PCR体系进行反应。通过实时检测反应管中的荧光信号,计算出反应过程中荧光信号变化量。当荧光信号增强到某一阈值时,标准模板反应管所用的循环次数(Ct值,C代表Cycle循环数,t代表threshold阈值)就被记录下来。Ct值与标准模板数量的对数值之间有严格的线性关系,利用系列标准模板的Ct值,制成标准曲线,根据待测样品的Ct值,就可在标准曲线中确定待测样品起始的DNA数量。
以白色念珠菌、光滑念珠菌、东方伊萨酵母、卵形毛孢子菌、泰泽氏菌、幽门螺杆菌、空肠弯曲杆菌、刚地弓形虫、蓝氏贾第鞭毛虫、隐匿管状线虫、鼠痘病毒、日本乙型脑炎病毒、淋巴细胞脉络丛脑膜炎病毒的核酸为模板,按优化后的TaqMan-MGB探针RTFQ-PCR体系进行反应,确定该方法的特异性。
将白色念珠菌ATCC 10231标准株菌悬液调整为0.6麦克法兰标准浊度,每毫升5×109个菌落形成单位(Colony-Forming Units,CFU,指单位体积中的活菌个数),以无菌生理盐水进行梯度稀释,分别抽提DNA,各取1 μL作为TaqMan-MGB探针RTFQ-PCR模板,按优化后的体系进行反应,测定检出最低限(LOD,limit of detection),确定该检测方法的灵敏度。
1.5 白色念珠菌TaqMan-MGB探针RTFQ-PCR重复性和稳定性试验将白色念珠菌TaqMan-MGB探针和RTFQ-PCR引物、标准质粒、TaqMan Universal PCR Master Mix、Nuclease-Free Water等配套试剂分别置-70、-20、4 ℃冰箱中存放90、180、360 d,分别取1 μL稀释后的标准质粒(5×106~5×102拷贝·μL-1)作为模板,按优化后的TaqMan-MGB探针RTFQ-PCR体系进行反应。在同一个试验中,每个稀释度标准质粒做3个复孔,用于统计计算组内相对标准偏差(RSD,relative standard deviation)。再以相同标准质粒为模板,连续3 d进行3次独立的重复试验,用以统计计算出组间RSD,确定该方法的重复性和稳定性。
1.6 白色念珠菌TaqMan-MGB探针RTFQ-PCR和普通PCR检测临床标本为了评价本研究建立的TaqMan-MGB探针RTFQ-PCR方法对临床标本中白色念珠菌检测的实用性,分别以上述临床标本和白色念珠菌分离株DNA为模板,按优化后的TaqMan-MGB探针RTFQ-PCR体系进行反应。同时用白色念珠菌普通PCR和基因克隆测序分析方法对白色念珠菌阳性标本进行检定验证。
白色念珠菌普通PCR引物见表 2。优化后的白色念珠菌普通PCR总反应体积为50 μL,具体包括10×Buffer(Mg2+ Plus)5.0 μL,dNTP Mixture 4.0 μL,正、反向引物各0.5 μL,EX Taq 0. 25 μL,模板DNA 3.0 μL,Nuclease-Free Water 37.25 μL。普通PCR反应参数:95 ℃ 1 min,1个循环;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min,1个循环。琼脂糖凝胶电泳检测PCR扩增产物。阳性标本进一步做克隆测序分析鉴定。
|
|
表 2 白色念珠菌普通PCR引物序列 Table 2 Sequences of conventional PCR primers for Candida albicans |
将白色念珠菌不同浓度的标准质粒分别与其Ct值进行回归分析,经对数拟合作图形成标准曲线,回归方程:
Y=-3.299X+38.945 R2=0.986
斜率(slope)为3.299,效率(efficiency)为100.974%,线性范围达11个数量级(1010~100拷贝),标准曲线显示白色念珠菌标准质粒Ct值与其拷贝数的对数具有良好的线性关系。t
TaqMan-MGB探针RTFQ-PCR检测白色念珠菌时出现典型S型扩增曲线,且Ct值小于28,结果判定为阳性;而光滑念珠菌、东方伊萨酵母、卵形毛孢子菌、泰泽氏菌、幽门螺杆菌、空肠弯曲杆菌、刚地弓形虫、蓝氏贾第鞭毛虫、隐匿管状线虫、鼠痘病毒、日本乙型脑炎病毒、淋巴细胞脉络丛脑膜炎病毒均未见典型S型扩增曲线,Ct值一栏显示为“Undetermined”,结果判定为阴性。特异性试验结果表明,本研究建立的TaqMan-MGB探针RTFQ-PCR检测方法专属性强,能准确检出白色念珠菌,而与其他念珠菌属真菌、非念珠菌属真菌、细菌、寄生虫和病毒均未产生交叉反应,特异性为100%。
TaqMan-MGB探针RTFQ-PCR检测5×109~5×100 CFU·mL-1白色念珠菌ATCC10231标准株时,均有特异性光滑荧光扩增曲线出现,且Ct值均小于38。灵敏度试验结果显示,本研究建立的TaqMan-MGB探针RTFQ-PCR方法检测白色念珠菌最低检测限度为5 CFU,灵敏度较高。
白色念珠菌TaqMan-MGB探针RTFQ-PCR标准曲线、特异性、灵敏度试验结果见图 1。
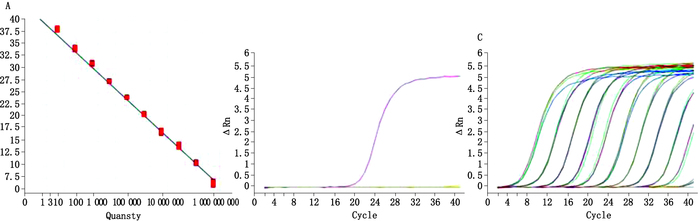
|
图 1 白色念珠菌TaqMan-MGB探针RTFQ-PCR标准曲线、特异性、灵敏度试验 Figure 1 Standard curve, specificity and sensitivity test of TaqMan-MGB probe based RTFQ-PCR for Candida albicans |
将TaqMan-MGB探针RTFQ-PCR配套试剂在不同温度放置近1年均能有效用于白色念珠菌定量检测,由表 3可知,组内RSD在0.09%~0.8%之间,组间RSD在0.03%~1.8%之间,组内和组间RSD均小于2%。在本研究的重复性和稳定性测试中TaqMan-MGB探针RTFQ-PCR相关系数、斜率和效率没有显著变化,表明该方法稳定性好、精密度高。
|
|
表 3 白色念珠菌TaqMan-MGB探针RTFQ-PCR重复性试验 Table 3 Reproducibility test results of TaqMan-MGB probe based RTFQ-PCR for Candida albicans |
本研究建立的TaqMan-MGB探针RTFQ-PCR检测临床标本中白色念珠菌的判定标准:标本Ct≤35且有典型S型扩增曲线者判为阳性;标本Ct>35或无典型S型扩增曲线者判为阴性;每次试验在阴性对照、阳性对照均成立的情况下结果方有效。1 185份临床标本经TaqMan-MGB探针RTFQ-PCR检测,结果显示有94份标本Ct≤35且呈现典型S型扩增曲线判为白色念珠菌阳性(图 2)。定量PCR检测结果表明阳性标本中白色念珠菌核酸载量范围为5×105~5×102 CFU·mL-1。临床病人、小型猪阳性标本白色念珠菌核酸载量较高,猴、灰仓鼠、地鼠、豚鼠、大鼠和小鼠标本中白色念珠菌载量较低。如临床病人12例白色念珠菌阳性Ct值:Y14腹水23.02,血清27.72,Y20腹水24.60,Y27腹水23.83,Y29腹水26.62,Y30腹水26.19,Y31腹水27.68,Y32腹水28.18,Y35腹水21.95,Y38腹水29.30,Y42腹水23.91,Y43腹水30.72,Y44腹水28.88。小型猪31头阳性Ct值:P1血清21.58,肝25.54;P2肝27.39;P3鼻24.80;P4心28.37;P5淋巴结29.43;P6鼻25.69;P7鼻22.13;P8鼻21.78;P9鼻21.41;P11鼻21.09;P12鼻21.26,肝28.15;P13脑29.97;P14鼻19.51;P15鼻21.52;P16血清23.51,鼻23.97,肝30.39;P17鼻22.38,肠25.85;P18鼻21.38;P19鼻23.57;P20淋巴结29.18;P21血清23.49;P23脑30.29;P26血清23.06;P31血清22.39;P36血清21.87;P43血清23.14;P(1)血清29.32,淋巴结29.71,肺27.75,脾29.95,肾29.74,肠30.19,脑28.67;P(2)血清24.39,气管30.57,淋巴结26.86,心28.48,肺29.1,肝25.375,肝28.73,脾30.38,肾26.57,肠28.59,脑27.85;P(3)淋巴结27.96,心24.28,肝29.61,脾28.53,肾26.19,肠25.27,脑29.61;P(4)血清29.11,气管24.99,淋巴结26.48,心25.59,肺25.32,脾27.73,肾27.6,肠28.502,脑28.3;P(5)气管29.39,淋巴结28.72,心27.99,肺27.73,肝29.17,脾28.56,肾25.91,肠24.51,脑26.31。灰仓鼠10只阳性Ct值:HCS8毛30.35,HCS9毛29.03,HCS39毛28.11,HCS47毛30.25,HCS49毛30.92,HCS50毛30.90,HCS52毛30.74,HCS55毛29.98,HCS56毛25.81,HCS57毛28.50。临床病人、猴、小型猪、灰仓鼠、地鼠、豚鼠、大鼠和小鼠标本中的白色念珠菌阳性检出率分别为17.3%(12/69)、4.4%(5/112)、51.6%(31/60)、16.6%(10/60)、5.7%(7/122)、1.25%(2/160)、7.5%(3/40)和6.2%(24/382)(表 4)。同时,应用白色念珠菌普通PCR方法对这94份阳性标本进行验证检测,均能获得ITS(498 bp)和26S rRNA(524 bp)基因特异性目的条带,显示普通PCR检测与TaqMan-MGB探针RTFQ-PCR检测结果相一致。然而,上述94份阳性标本经真菌培养鉴定,仅从猴、灰仓鼠、豚鼠阳性标本中分离获得8株存活的白色念珠菌,菌株编号为GZQCA1、GZQCA2、GZQCA3、GZQCA4、GZQCA5、GZQCA6、GZQCA7、GZQCA8,其菌落特征卵圆形孢子假菌丝形态显微摄录照片见图 3。采用白色念珠菌普通PCR方法均可扩增出这8株白色念珠菌ITS(498 bp)和26S rRNA(524 bp)基因特异性片段,对其ITS和26S rRNA基因分别进行克隆测序,将本研究获得的白色念珠菌基因测序数据,在线提交NCBI(National Center of Biotechnology Information,美国国家生物技术信息中心),通过BLAST(Basic Alignment Search Tool)(http://www.ncbi.nlm.nih.gov/blast/)进行比对分析,结果显示本研究自临床标本中分离获得的白色念珠菌ITS、26S rRNA序列,与国际上已公布的不同国家不同物种来源的白色念珠菌ITS、26S rRNA基因核苷酸同源性高达100%(GenBank accession number:JN882316.1、HQ014713.1、GU319987.1、FN652297.1、GQ376070.1、EU266569.1、KJ624035.1、KF214375.1、KP780462.1、AF156537.1、JX094790.1、FJ627953.1),测序结果证实这8个菌株确为白色念珠菌。本研究将TaqMan-MGB探针RTFQ-PCR成功应用于临床标本中白色念珠菌核酸载量的定量检测,用普通PCR和基因克隆测序进行确证。整个检测过程可在2 h内完成,可以用作定量分析快速诊断方法。
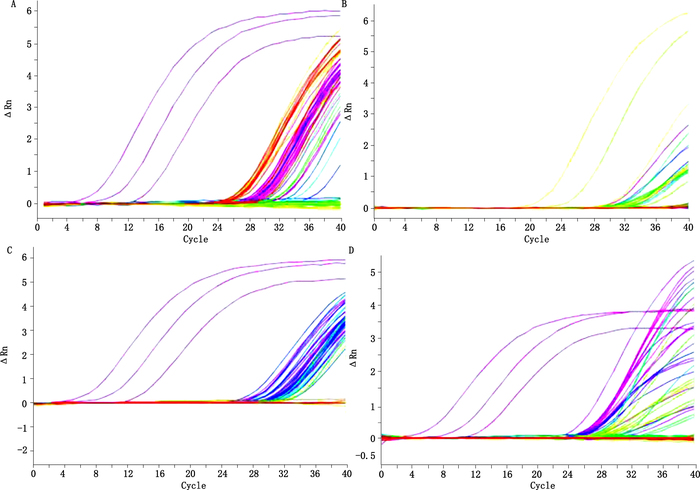
|
图 2 TaqMan-MGB探针RTFQ-PCR检测临床标本中白色念珠菌 Figure 2 Detection of Candida albicans in clinical specimens by TaqMan-MGB probe based RTFQ-PCR assay |
|
|
表 4 TaqMan-MGB探针RTFQ-PCR检定多种临床标本中白色念珠菌阳性 Table 4 Numbers of clinical specimen positive for Candida albicans identified by TaqMan-MGB probe based RTFQ-PCR assay |

|
图 3 白色念珠菌临床分离株培养和形态特征 Figure 3 Cultural characteristics and morphological photos of Candida albicans clinical isolates |
本研究采用Neo-Sensitabs药片(Rosco,丹麦)扩散法进行抗真菌药物敏感性试验分析,在负压生物安全柜内,用无菌生理盐水分别将各白色念珠菌悬液调整为0.5麦克法兰标准浊度,用灭菌棉签蘸取后均匀涂布于4 mm厚的改良Shadomy琼脂板(广州Detgerm微生物科技有限公司产品)表面。分别将10种药片:两性霉素B(amphotericin B;10 μg)、制霉菌素(nystatin;50 μg)、酮康唑(ketoconazole;15 μg)、咪康唑(miconazole;10 μg)、克霉唑(clotrimazole;10 μg)、益康唑(econazole;10 μg)、氟康唑(fluconazole;25 μg)、沃尔康唑(voriconazole;1 μg)、特比萘芬(terbinafine;30 μg)和氟胞嘧啶(fluorocytosine;10 μg)放置在各接种板的表面,经35 ℃培养24 h后,准确记录各个抑菌圈直径的大小。药敏片检测结果参考试剂盒内所提供的标准。根据药片周围白色念珠菌被抑制的范围直径大小来确定抗真菌药物对白色念珠菌的抑制作用。白色念珠菌ATCC 64548为质控菌株。对本研究分离获得白色念珠菌进行抗真菌药物敏感性分析(表 5),结果显示,这些菌株对制霉菌素、咪康唑、克霉唑、益康唑、氟康唑、沃尔康唑均较敏感,但对两性霉素B、酮康唑、特比萘芬、氟胞嘧啶已产生了耐药性。
|
|
表 5 白色念珠菌临床分离株药敏试验 Table 5 Antifugal susceptibility test of Candida albicans clinical isolates |
在本研究中,将新近开发评价的白色念珠菌TaqMan-MGB探针RTFQ-PCR应用于检测,不但灵敏度和特异性大大提高,而且操作简便快捷,尤其适于白色念珠菌感染的早期诊断和临床标本的定量快检鉴定。本研究结果显示,白色念珠菌阳性临床标本主要来源为呼吸道、肠道和血液系统,与相关文献报道[20]一致。通过对白色念珠菌分离株进行抗真菌药物敏感性试验分析发现,这些菌株对制霉菌素、咪康唑、克霉唑、益康唑、氟康唑、沃尔康唑敏感,但对两性霉素、酮康唑、特比萘芬、氟胞嘧已产生耐药性,与相关文献报道[21]不同。
本研究应用TaqMan-MGB探针RTFQ-PCR和基因克隆测序联合真菌培养及抗真菌药物敏感性试验分析方法对白色念珠菌从分子水平、基因分布特点、表型特征、药敏特性等多方面进行分析鉴定。通过TaqMan-MGB探针RTFQ-PCR、基因克隆测序鉴定、真菌分离培养鉴定、抗真菌药物敏感性试验分析方法的比较发现,真菌分离培养鉴定获得存活的白色念珠菌的数量是有限的,在临床标本中其实还存在着一些活的处于不可培养状态的白色念珠菌,分离培养方法难以捕获到这些真菌,这在一定程度上影响了临床上致病真菌检查的敏感性。尽管TaqMan-MGB探针RTFQ-PCR检测临床病人、小型猪阳性标本中白色念珠菌的核酸载量较高,但真菌分离培养鉴定却并未获得存活的菌株。虽然猴、灰仓鼠、豚鼠阳性标本中白色念珠菌的核酸载量并不高,但却从中分离获得了生长状况良好的菌株。究其原因,可能是由于临床抗菌药物的应用,抑制了病人标本中白色念珠菌的发育;小型猪标本中白色念珠菌因受营养条件限制而繁殖受抑制。本研究结果显示实际临床标本中白色念珠菌的核酸定量检测结果并不一定与分离获得完整的存活的可培养的菌株结果相互吻合,因此在实际工作中全面合理分析比对参考甄别选用可信数据就显得非常重要[22]。应用TaqMan-MGB探针RTFQ-PCR在小型猪多个组织脏器中检出白色念珠菌,血、鼻、气管、淋巴结、肺、心、肝、脾、肾、肠、脑中存在不同程度载量的白色念珠菌,这为进一步研究致病真菌对动物活体侵袭感染的动态分布提供了新的思路。今后,要更加科学地将分子快检技术有效地与病原体形态学鉴定方法结合起来应用,做到快速定量精准检定有效防控疫病,筑牢保护人民生命健康,保障人们用药安全的坚固屏障。
日益繁荣的全球贸易加速了外来物种的引入,加剧了病原体的远距离传播。尤其对于一些特殊稀少样品资源(如:基因修饰种子细胞动物、干细胞、植入性医疗器械等)的检验,如何快速准确无痛无创无破坏性定量定性捕获病原体?这对检定工作提出了新的精准时限要求,本研究新建立的TaqMan-MGB探针RTFQ-PCR检测方法,具有快速简便,特异性强,灵敏度高,重复性好的特性,适于动物源性产品中白色念珠菌检测、食品药品生物制品医疗器械安全检查、环境监测和流行病学调查,为临床标本中白色念珠菌的快速定量检测提供了一种特异有效的评价工具,值得推广应用。
| [1] |
ROSSIGNOL T, LECHAT P, CUOMO C, et al. CandidaDB:a multigenome database for Candida species and related Saccharomycotina[J]. Nucleic Acids Res, 2008, 36(Database issue): D557. |
| [2] |
ARENDRUP MC. Candida and candidaemia. Susceptibility and epidemiology[J]. Dan Med J, 2013, 60(11): B4698. |
| [3] |
GUDUCUOGLU H, GULTEPE B, OTLU B, et al. Candida albicans outbreak associated with total parenteral nutrition in the neonatal unit[J]. Indian J Med Microbiol, 2016, 34(2): 202. DOI:10.4103/0255-0857.180303 |
| [4] |
RAMLA S, SHARMA V, PATEL M. Influence of cancer treatment on the Candida albicans isolated from the oral cavities of cancer patients[J]. Support Care Cancer, 2016, 24(6): 2429. DOI:10.1007/s00520-015-3035-8 |
| [5] |
MENEZES TO, GILLET LC, MENEZES SA, et al. Virulence factors of Candida albicans isolates from the oral cavities of HIV-1-positive patients[J]. Curr HIV Res, 2013, 11(4): 304. DOI:10.2174/1570162X113119990042 |
| [6] |
QUERQUES G, MODORATI G, MISEROCCHI E, et al. Bilateral endogenous endophthalmitis caused by Candida albicans after breast implant surgery[J]. JAMA Ophthalmol, 2016, 134(4): 467. DOI:10.1001/jamaophthalmol.2016.0015 |
| [7] |
SELEK MB, KULA ATIK T, BEKTORE B, et al. First report of macroscopic biofilm formation caused by Candida albicans on silver hydrogel-coated urinary catheters[J]. Am J Infect Control, 2016, pii:S0196-6553(16): 30257. |
| [8] |
SHETH CC, JOHNSON E, BAKER ME, et al. Phenotypic identification of Candida albicans by growth on chocolate agar[J]. Med Mycol, 2005, 43(8): 735. DOI:10.1080/13693780500265998 |
| [9] |
DUTTON S, PENN CW. Biological attributes of colony-type variants of Candida albicans[J]. J Gen Microbiol, 1989, 135(12): 3363. |
| [10] |
ISHIGURO A, HOMMA M, TORⅡ S, et al. Identification of Candida albicans antigens reactive with immunoglobulin E antibody of human sera[J]. Infect Immun, 1992, 60(4): 1550. |
| [11] |
BEN ABDELJELIL J, SAGHROUNI F, EMIRA N, et al. Molecular typing of Candida albicans isolates from patients and health care workers in a neonatal intensive care unit[J]. J Appl Microbiol, 2011, 111(5): 1235. DOI:10.1111/jam.2011.111.issue-5 |
| [12] |
ISIK N, WHITE L, BARNES R, et al. A simple PCR/RFLP analysis can differentiate between Candida albicans, Aspergillus niger, and Aspergillus fumigatus[J]. Mol Biotechnol, 2003, 24(3): 229. DOI:10.1385/MB:24:3 |
| [13] |
BIERNASIUK A, KORONA-GLOWNIAK I, GRZEGORCZYK A, et al. Differentiation by random amplified polymorphic DNApolymerase chain reaction(RAPD-PCR)of Candida albicans isolated from upper respiratory tract in patients with non-small cell lung cancer[J]. Acta Biochim Pol, 2014, 61(4): 727. |
| [14] |
NABILI M, ASHRAFI M, JANBABAIE G, et al. Quantification and optimization of Candida albicans DNA in blood samples using realtime PCR[J]. Rep Biochem Mol Biol, 2013, 2(1): 42. |
| [15] |
ARANCIA S, CARATTOLI A, LA VALLE R, et al. Use of 65 kDa mannoprotein gene primers in real time PCR identification of Candida albicans in biological samples[J]. Mol Cell Probes, 2006, 20(5): 263. DOI:10.1016/j.mcp.2006.01.006 |
| [16] |
MAAROUFI Y, HEYMANS C, DE BRUYNE JM, et al. Rapid detection of Candida albicans in clinical blood samples by using a TaqMan-based PCR assay[J]. J Clin Microbiol, 2003, 41(7): 3293. DOI:10.1128/JCM.41.7.3293-3298.2003 |
| [17] |
高正琴, 岳秉飞. 中国新疆灰仓鼠真菌多样性[J]. 中国人兽共患病学报, 2014, 30(7): 709. GAO ZQ, YUE BF. Diversity of fungi derived from the Cricetulus migratorius from the Xinjiang region of China[J]. Chin J Zoonoses, 2014, 30(7): 709. |
| [18] |
ESPINEL-INGROFF A, CANTON E, FOTHERGILL A, et al. Quality control guidelines for amphotericin B, Itraconazole, posaconazole, and voriconazole disk diffusion susceptibility tests with nonsupplemented Mueller-Hinton Agar(CLSI M51-A document) for nondermatophyte filamentous fungi[J]. J Clin Microbiol, 2011, 49(7): 2568. DOI:10.1128/JCM.00393-11 |
| [19] |
National Committee for Clincial Laboratory Standards. Method for antifugal disk diffusion susceptibility testing of yeasts:approved guideline M44-A[S]. Wayne:NCCLS, 2004
|
| [20] |
BOUGNOUX M, DUPONT C, MATEO J, et al. Serum is more suitable than whole blood for diagnosis of systemic candidiasis by nested PCR[J]. J Clin Microbiol, 1999, 37(4): 925. |
| [21] |
KIM K, ZILBERMINTZ L, MARTCHENKO M. Repurposing FDA approved drugs against the human fungal pathogen, Candida albicans[J]. Ann Clin Microbiol Antimicrob, 2015, 14: 32. DOI:10.1186/s12941-015-0090-4 |
| [22] |
高正琴, 邢进, 冯育芳, 等. 应用TaqMan MGB探针实时荧光定量PCR结合分离培养监测分析灰仓鼠细菌多样性[J]. 药物分析杂志, 2014, 34(2): 221. GAO ZQ, XING J, FENG YF, et al. Monitor and analysis bacterial diversity of Cricetulus migratorius by TaqMan MGB probe real-time fluorescence quantitative PCR and bacteria isolation culture[J]. Chin J Pharm Anal, 2014, 34(2): 221. |
 2017, Vol. 37
2017, Vol. 37 
