2. 上海市徐汇区中心医院/复旦大学附属中山医院徐汇医院, 上海 200031;
3. 中国科学院上海临床研究中心, 上海 200031
2. Shanghai Xuhui Central Hospital/Fudan University affiliated ZhongshanXuhui Hospital, Shanghai 200444, China;
3. Shanghai Clinical Research Center, Chinese Academy of Science, Shanghai 200031, China
近20年,人类真菌感染的发生率大幅度升高,其主要是由接受器官移植、免疫抑制疗法以及艾滋病的人群增加所导致的[1-2]。三唑类化合物是应用最多的抗真菌药物,因为这类化合物是广谱抗真菌药物,没有严重的心脏毒性。目前,用于临床的三唑类抗真菌药物有4个,分别是氟康唑、伊曲康唑、伏立康唑和泊沙康唑。虽然抗真菌药物的效用有了很大的进展,但是真菌感染的发病率和死亡率仍然很高。由于三唑类抗真菌药物的药代动力学特征、副作用(毒性)、药物相互作用和药物基因组学差异显著,所以在治疗过程中患者体内血药浓度个体差异很大,比如氟康唑对酵母有很强的抑制效果,而对霉菌的效果较弱。但对于肾功能不全的患者或者中枢神经系统真菌感染的患者,氟康唑的暴露量会大大改变,建议密切监测血药浓度[3-5]。伊曲康唑可以用于很多侵入性真菌感染,有胶囊和口服溶液剂型。伊曲康唑生物利用度差异很大,胶囊和口服液利用度分别为55%和70%,故其吸收难以预测[6]。伏立康唑是抗曲霉菌的一线用药,但是由于其非线性药动学特征,伏立康唑的血药浓度的差异很大。当剂量增加50%时,血清浓度可以增加150%,并且血清半衰期明显延长,这就使剂量和疗效之间的对应关系难以预测,推荐开展治疗药物监测[7]。泊沙康唑是最近FDA批准的三唑类抗真菌药物,该药对大多数念珠菌、曲霉菌种属有强大抗菌活性,同时也改善了对新型接合菌的疗效。相关实验证明,泊沙康唑有明显的药代动力学参数个体差异,在一个异体同种干细胞移植患者的临床研究中,AUC0-24和Cmax等药代参数的个体差异达到68%[8],故药动学和药效学的评价对优化三唑类给药方案尤为重要。综上所述,临床治疗药物监测(TDM)在药物选择和给药方案的制定中具有重要的指导作用[9-10]。
迄今为止的文献报道中,同时测定三唑类抗真菌药物的方法主要有微生物法、HPLC法和LC-MS/MS法[6-10]。由于氟康唑、伏立康唑、伊曲康唑和泊沙康唑近几年在临床上应用广泛,所以本研究旨在建立一种能同时测定4个三唑类药物(氟康唑、伏立康唑、伊曲康唑、泊沙康唑)及1个代谢物(羟基伊曲康唑)的LC-MS/MS方法,该方法操作简单,分析时间较短,且专一性强,灵敏度高,可以用于临床治疗药物监测。
1 仪器与试药 1.1 仪器API 4000串联质谱仪(Applied Biosystems公司),Analyst 1.4.1分析软件(Applied Biosystems公司);液相色谱系统(由LC-20AD输液泵、DGU-20A3在线脱气仪、SIL-HTc自动进样器组成;Shimadzu公司);Waters XSELECTTM CSHTM C18(2.1 mm×100 mm,3.5 μm;填料:十八烷基硅烷键合硅胶,Waters公司)。Vortex-2涡旋混合器(Scientific Industries公司),Mikro 22R冷冻高速离心机(Hettich公司),超声波清洗器(上海必能信超声波仪器厂)。
1.2药品与试剂氟康唑(TRC公司,纯度≥98%,批号22-SSR-67-1);伏立康唑(TRC公司,纯度≥98%,批号18-ANR-82-1);伊曲康唑(TRC公司,纯度≥98%,批号13-GHZ-186-1);羟基伊曲康唑(TRC公司,纯度≥98%,批号24-GHZ-39-1);泊沙康唑(TRC公司,纯度≥98%,批号1-MSW-3-1);氟康唑-D4(TRC公司,同位素丰度98%,批号7-MMH-92-2);伏立康唑-D3(TRC公司,同位素丰度97.92%,批号3-JUZ-110-1);伊曲康唑-D5(TRC公司,同位素丰度98%,批号6-MMH-193-4);羟基伊曲康唑-D5(TRC公司,同位素丰度99.4%,批号3-AXF-99-4);泊沙康唑-D4(TRC公司,同位素丰度97%,批号6-JUZ-55-2);乙酸铵(ACS纯)、甲酸(液相色谱纯)购自Tedia公司,乙腈(液相色谱纯)、甲醇(液相色谱纯)购自Merck KGaA公司,实验用水为本实验室采用Millipore纯水系统自制。
2 LC-MS/MS分析条件 2.1 色谱条件采用Waters XSELECTTM CSHTM C18(2.1 mm×100 mm,3.5 μm)色谱柱,流动相A为0.1%甲酸10 mmol·L-1,流动相B为乙酸铵水溶液-0.1%甲酸乙腈水溶液,梯度洗脱(流动相B起始比例为0%,1.1 min升至70%,3 min降至30%,并维持至5.5 min),流速为0.5 mL·min-1,进样量为5 μL。
2.2 质谱条件采用电喷雾离子源,正离子扫描,离子源电压2 000 V,离子源温度500 ℃,雾化气551.6 kPa,辅助气482.7 kPa,气帘气体137.9 kPa。MRM扫描分析,5个三唑类抗真菌药物定量、定性分析离子对以及分别优化去簇电压(declustering potential,DP)、入口电压(enterance potential,EP)、碰撞能(collision energy,CE)、碰撞室出口电压(cell exit potential,CXP)等质谱参数见表 1。
|
|
表 1 三唑类抗真菌药的优化质谱参数及保留时间 Table 1 Optimization of mass spectrometry parameters and retention time of triazole antifungal agents |
分别精密称取氟康唑、伏立康唑、伊曲康唑、羟基伊曲康唑、泊沙康唑的对照品适量,分别用50%甲醇、50%甲醇、0.5%甲酸80%甲醇、乙酸乙酯、0.5%甲酸甲醇制成950.6、715.4、461.6、490和490 μg·mL-1的标准储备液,置于4 ℃冰箱中储存。内标氟康唑-D4、伏立康唑-D3、伊曲康唑-D5、羟基伊曲康唑-D5、泊沙康唑-D4分别用甲醇、50%甲醇、0.5%甲酸80%甲醇、50%甲醇、0.5%甲酸50%甲醇制成100 μg·mL-1的储备液,置于4 ℃冰箱中储存。
2.4 标准血清样品和质控样品的配制分别精密量取“2.3”项下对照品储备液适量,用甲醇稀释成为40 μg·L-1的混合对照品工作液。取此工作液,加入空白人血清适量,制成20、10、1、0.5、0.1 μg·mL-1标准血清样品和15、5、0.3 μg·mL-1的质控样品。
2.5 血清样品预处理取血清样品50 μL置于1.5 mL塑料离心管中,加入用甲醇配制的5 μg·mL-1混合内标工作液20 μL,加入500 μL乙腈溶液后漩涡振荡30 s,15000 r·min-1离心10 min,取10 μL于进样瓶,再加100 μL甲醇稀释,进样5 μL,记录色谱图中5个化合物和各自内标的峰面积,以内标法进行定量。
3 临床样品收集三唑类药物治疗开始后4~7 d进行监测,在下一次给药前抽取静脉血2 mL,3 000 r·min-1离心10 min,吸取上清液,用LC-MS/MS法检测药物浓度。
4 结果 4.1 方法特异性考察取6份不同来源的空白人血清,加入适量“2.4”项下的混合对照品工作液,配制成0.3、15 μg·mL-1的质控样品,并将空白血清、质控样品按“2.5”项下方法处理后进样。结果表明,不同来源的空白血清在相应色谱峰保留时间内均无干扰峰,5个化合物测定结果一致,RSD均小于14.2%,准确度均在87.4%~111.0%,方法特异性良好,典型的图谱见图 1。
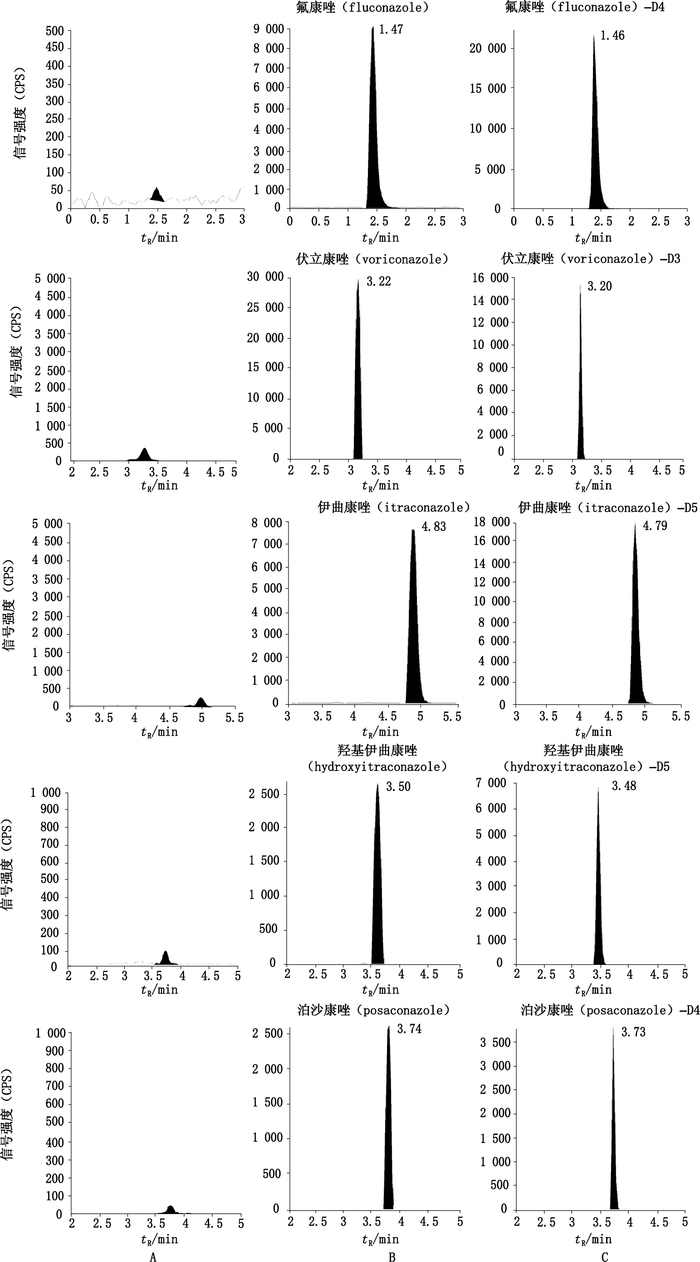
|
A.空白血清(blank serum)B.空白血清添加对照品(blank serumspiked with reference substances)(1 μg·mL-1)C.空白血清添加内标(blank serumspiked with internal standard)(5 μg·mL-1) 图 1 典型MRM色谱图 Figure 1 Typical MRM chromatograms |
在空白人血清中加入按“2.4”项下方法制成的20、10、1、0.5、0.1 μg·mL-1标准血清样品,按“2.5”项下方法处理后进样。以待测物与内标峰面积比值(Y)对浓度(X)作线性回归分析,得标准曲线方程,见表 2。结果表明,标准曲线的线性相关系数r均大于0.99,血清中5个化合物在各自的线性范围内线性关系良好。
|
|
表 2 线性方程、相关系数及线性范围 Table 2 Linear equations, correlation coefficients and linear ranges |
试验按“2.4”项下方法配制成低浓度(0.3 μg·mL-1)、中浓度(5 μg·mL-1)、高浓度(15 μg·mL-1)的质控样品,分别在同一天内和2周内不同的日期按“2.5”项下方法及LC-MS/MS条件进行处理和分析,计算准确度和批内、批间(共4批)精密度,见表 3。结果表明,各分析物的准确度为87.4%~111.0%,批内和批间RSD均小于10.6%,故该测定方法精密准确,重复性好。
|
|
表 3 5种化合物的准确度和精密度。 Table 3 Accuracy and precision of five compounds |
分别配制低浓度(0.3 μg·mL-1)、高浓度(15 μg·mL-1)的质控样品各6份,按“2.5”项下方法及LC-MS/MS条件进行处理和分析,得到峰面积A1;同时取空白血清样品按照“2.5”项下方法进行处理后,再加入混合对照品工作液制备成0.3及15 μg·mL-1的溶液进样分析,得到峰面积A2。根据A1与A2的比值可求算各待测物2种浓度的提取回收率,结果为80.5%~98.4%,RSD < 10.4%。然后用甲醇配制低浓度(0.3 μg·mL-1)、高浓度(15 μg·mL-1)的混合对照品溶液各6份,按“2.5”项下方法及LC-MS/MS条件进行处理和分析,得到峰面积A3,根据A2与A3的比值可求算各待测物2种浓度的基质效应,结果为95.1%~126.2%,RSD < 6.7%。
4.5 稳定性试验考察血清样品处理后在室温下放置的稳定性以及在自动进样器(4 ℃)的稳定性,样品冻融3次的稳定性。取低浓度(0.3 μg·mL-1)、高浓度(15 μg·mL-1)的质控样品,按“2.5”项下方法处理后,分别在0、4、8、24 h进样测定,然后考察样品在自动进样器中的稳定性。样品冻融稳定性是将血清样品置于-20 ℃避光保存,然后在室温下自然解冻,按“2.5”项下方法处理后进样,如此反复3次,以考察样品在3次冻融后的稳定性。通过测得浓度与初始浓度偏差百分比的结果表明血清样品在上述条件下均保持稳定,见表 4。
|
|
表 4 稳定性结果 Table 4 Stability results |
本研究从临床ICU和血液科严重侵袭性真菌病患者中选取20例患者男性12例女性8例,平均年龄(71±19)岁。病原体主要为白色念珠菌和热带念珠菌。20例患者用药伏立康唑和氟康唑不同剂量(除15号患者用药氟康唑外,均用药伏立康唑),给药间隔均为12 h。治疗开始后4~7 d谷浓度时进行监测,在下一次给药前抽取静脉血2 mL,3 000 r·min-1离心10 min,吸取上清液。测得伏立康唑给药前谷浓度范围为0.24~4.06 μg·mL-1(氟康唑参考有效浓度范围 > 20 μg·mL-1,伏立康唑参考有效浓度范围2~6 μg·mL-1[6])结果见表 5。从检测结果可以看出,伏立康唑个体药代动力学差异较大,需密切监测血药浓度。
|
|
表 5 患者病情、给药情况以及谷浓度测定结果 Table 5 Patient condition, drug administration, and results of trough concentration measurement |
目前已报道的检测三唑类抗真菌药物的方法中有微生物方法和HPLC方法,且两者检测结果大致相同,但是都有不足。对于微生物方法而言,由于伊曲康唑代谢物羟基伊曲康唑会大大增强微生物活性,所以伊曲康唑微生物检测结果要比HPLC方法高出2~3倍[16],使得结果准确度降低。对于HPLC方法而言分析时间较长,也不适合用于治疗药物监测(TDM)[6]。TDM主要针对治疗指数低、个体差异大的药物,其核心是以血药浓度为指标,个体化调整用药方案,变经验用药为科学用药,实现安全、有效、经济合理的治疗目的。并且LC-MS/MS技术在靶向定量分析独具优势,早期在药物生物分析领域得到成熟应用。
本文采用的LC-MS/MS法可以同时检测5种临床常用的三唑类抗真菌药物。本方法样本使用量少,仅需50 μL,并且每个样品分析时间仅为5.5 min,达到高通量的要求。通过对方法特异性、线性关系、回收率等方面的验证,该方法可确保血清中5种三唑类抗真菌药物浓度的准确检测,适用于临床药物浓度监测。
本研究对20名接受伏立康唑和氟康唑治疗的患者进行了血药浓度监测,其中用药伏立康唑的患者有19名,从监测结果可以看出伏立康唑个体药代动力学差异较大,目前有研究表明伏立康唑疗效和患者血药浓度的明显相关性,浓度低于0.5 μg·mL-1时很有可能导致治疗失败,而浓度高于4.8 μg·mL-1时,很大程度上会发生不良反应[17]。因此严重侵袭性真菌病患者用伏立康唑治疗过程中监测血药浓度有助于增加安全性和有效性。
| [1] |
TUITE NL, LACEY K. Overview of invasive fungal infections[J]. Methods MolBiol, 2013, 968(1): 1. |
| [2] |
CASTON-OSORIO JJ, RIVRO A, TORRE-CISNEROS J. Epidemiology of invasive fungal infection[J]. Int J Antimicrob Agents, 2008, 32(s2): S103. |
| [3] |
ODDS FC, BROWN AJ, GOW NA. Antifungal agents:mechanisms of action[J]. Trends Microbiol, 2003, 11(6): 272. DOI:10.1016/S0966-842X(03)00117-3 |
| [4] |
BERL T, WILNER KD, GARDER M, et al. Pharmacokinetics of fluconazole in renal failure[J]. J Am Soc Nephrol, 1995, 6(2): 242. |
| [5] |
YAGASAKI K, DECOSTERD LA, MATSUDA N, et al. Pharmacokinetics and the most suitable dosing regimen of fluconazole in critically ill patients receiving continuous hemodiafiltration[J]. Intensive Care Med, 2003, 29(10): 1844. DOI:10.1007/s00134-003-1980-z |
| [6] |
STEVENS DA. Itraconazole in cyclodextrinsolution[J]. Pharmacotherapy, 1999, 19(5): 603. DOI:10.1592/phco.19.8.603.31529 |
| [7] |
PASCUAL A, CALANDRA T, BOLAY S, et al. Voriconazole therapeutic drug monitoring in patients with invasive mycoses improves efficacy and safety outcomes[J]. Clin Infect Dis, 2008, 46(2): 201. DOI:10.1086/524669 |
| [8] |
GUBBINS PO, KRISHNA G, SANSONE-PARSONS A, et al. Pharmacokinetics and safety of oral posaconazole in neutropenic stem cell transplant recipients[J]. Antimicrob Agents Chemother, 2006, 50(6): 1993. DOI:10.1128/AAC.00157-06 |
| [9] |
GOODWIN ML, DREW RH. Antifungal serum concentration monitoring:an update[J]. J Antimicrob Chemother, 2008, 61(1): 17. |
| [10] |
ZONIOS DI, BENNETT JE. Update on azole antifungals[J]. Semin Respir Crit Care Med, 2008, 29(2): 198. DOI:10.1055/s-2008-1063858 |
| [11] |
ANDES D, PASCUAL A, MARCHETTI O. Antifungal therapeutic drug monitoring:established and emerging indications[J]. Antimicrob Agents Chemother, 2009, 53(1): 24. DOI:10.1128/AAC.00705-08 |
| [12] |
ALFFENAAR JW, WESSELS AM, van HATEREN K, et al. Method for therapeutic drug monitoring of azole antifungal drugs in human serum using LC/MS/MS[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2010, 878(1): 39. DOI:10.1016/j.jchromb.2009.11.017 |
| [13] |
DECOSTERD LA, ROCHAT B, PESSE B, et al. Multiplex ultraperformance liquid chromatography-tandem mass spectrometry method for simultaneous quantification in human plasma of fluconazole, itraconazole, hydroxyitraconazole, posaconzole, voriconazole, voriconazole-N-oxide, anidulafungin, and caspofungin[J]. Antimicrob Agents Chemother, 2010, 54(12): 5303. DOI:10.1128/AAC.00404-10 |
| [14] |
BESTE KY, BURKHARDT O, KAEVER V. Rapid HPLC-MS/MS method for simultaneous quantitation of four routinely administered triazole antifungals in human plasma[J]. Clin Chim Acta, 2012, 413(1-2): 240. DOI:10.1016/j.cca.2011.09.042 |
| [15] |
FAROWSKI F, CORNELY OA, VEHRESCHILD JJ, et al. Quantitation of azoles and echinocandins in compartments of peripheral blood by liquid chromatography-tandem mass spectrometry[J]. Antimicrob Agents Chemother, 2010, 54(5): 1815. DOI:10.1128/AAC.01276-09 |
| [16] |
PENNICK GJ, CLARK M, SUTTON DA, et al. Development and validation of a high-performance liquid chromatography assay for voriconazole[J]. Antimicrob Agents Chemother, 2003, 47(7): 2348. DOI:10.1128/AAC.47.7.2348-2350.2003 |
| [17] |
TRIFILIO S, ORTIZR, PENNICKG, et al. Voriconazole therapeutic drug monitoring in allogeneic hematopoietic stem cell transplant recipients[J]. Bone Marrow Transplant, 2005, 35(5): 509. DOI:10.1038/sj.bmt.1704828 |
 2017, Vol. 37
2017, Vol. 37 