2. 江苏省食品药品监督检验研究院, 南京 210008;
3. 乔治城大学, 华盛顿特区 20057
2. Jiangsu Institute of Food and Drug Control, Nanjing 210008, China;
3. Georgetown University, Washington D. C 20057, USA
环维黄杨星D(cyclovirobuxine D)是从黄杨科植物小叶黄杨(Buxus microphylla Sieb.et Zucc. var. sinica Rehd.et Wils.)及其同属植物中经酸性醇提、碱化、有机溶剂萃取、粗品重结晶而得到的生物碱[1-2],具有改善血液流变学及抗心肌缺血、增强心肌收缩率、增强耐缺氧等作用[3-5]。以环维黄杨星D为原料所开发研制的黄杨宁片在治疗冠心病及心绞痛方面具有良好疗效[6-8]。
根据张正行等[9]深入研究分析,目前工艺生产的黄杨宁片原料中除含有主成分环维黄杨星D外,还包含环黄杨碱D、环常绿黄杨碱C等多个黄杨有关生物碱成分[10]。环维黄杨星D及有关生物碱均具有孕甾烷生物碱骨架结构[11],分子结构中无共轭生色团,有的生物碱如环维黄杨星D仅具有紫外末端吸收,有的不具任何吸收[10]。黄杨宁片原料中主成分测定方法分别被2000年版至2015年版中国药典收载[12-15],均采用非水溶液滴定法,所测数据反映的是总生物碱含量。随着HPLC法的普及应用,十多年来不断有学者采用HPLC法发现并报道黄杨宁片原料纯度较低问题,迄今为止,已有8种HPLC方法被报道[16-23]。这些HPLC方法中,第1类是主成分能良好分离从而较准确定量的方法,如反相离子对色谱末端检测法[16-17],但由于某些杂质无末端吸收,这类末端检测方法因而不能得到全面的杂质色谱信息。第2类正好相反,可较全面地反映杂质信息,但主成分却不能达到良好分离,如正相和反相色谱ELSD检测法[18-20],这类ELSD检测法由于流动相受限制,一般难以通过变换色谱柱将黄杨生物碱彼此良好分离,往往主成分包含微小杂质而使定量结果偏高,但优点是分开的杂质均能被检测到。第3类方法是检测到的杂质信息不够全面,主成分定量结果也不准确,如正相色谱氨基柱末端出末端无吸收的杂质,后者不能检出无仲胺结构的杂质,因为异氰酸苯酯仅与仲胺发生衍生化反应。由于黄杨宁片原料中环维黄杨星D及有关生物碱分子结构非常接近且分子量相差较小[10],给色谱分离造成难度;而如上所述有关生物碱在紫外末端吸收表现各异,又给检测造成难度。因此已报道的方法在主成分良好分离检测法[21]和异氰酸苯酯柱前衍生反相色谱紫外检测法[22-23];这2种方法均不能将主成分与微小杂质彻底分开,在杂质检出方面也均存在局限性,其差别是前者不能检和能全面反映有关生物碱色谱信息这2个方面总是不能很好兼顾。
因此,目前尚无能兼顾良好分离和全面反映杂质信息的黄杨生物碱检测方法。本文从这2个方面出发,新建立了柱前衍生化反相色谱紫外检测法,选择可使环维黄杨星D主成分和杂质发生反应且易于操作的衍生化试剂,通过衍生化反应条件的考察和筛选,实现主成分的良好分离和全面体现杂质色谱信息,为同时准确测定原料中主成分含量和杂质检查提供可靠方法。
1 仪器与试药 1.1 仪器岛津公司LC-20AB高效液相色谱仪(LC-20AB泵,SIL-20AC自动进样器,CTO-20AC柱温箱,SPD-M20A二极管阵列DAD检测器、Lab-solution工作站),Agilent 1290高效液相色谱仪与Bruker Maxis impact Ⅰ四极杆飞行时间质谱仪联用系统;Waters公司Xterra C8色谱柱(4.6 mm×250 mm,5 μm;填料:辛烷基硅烷键合硅胶杂化颗粒硅胶),岛津公司Inertsil C8-3 (4.6 mm×250 mm,5 μm;填料:辛烷基硅烷键合硅胶),安捷伦公司ZORBAX SB-C8(4.6 mm×250 mm,5 μm;填料:辛烷基硅烷键合硅胶)。昆山禾创超声仪器有限公司KH-700TDB型超声仪(功率700 W,频率80 kHz),Sartorius公司CPA224S型万分之一电子天平,Sartorius公司BS21S型十万分之一电子天平,Mettler Toledo公司MX5型百万分之一电子天平),美国Millipore公司MiliQ超纯水制备系统,长沙湘仪离心机仪器有限公司TG16-WS台式高速离心机,梅特勒-托利多仪器(上海)有限公司DELTA 320型pH计。
1.2 试药环维黄杨星D对照品,批号110888-200503,纯度供含量测定用,购自中国食品药品检定研究院。
样品共10批,分别由南京小营制药有限公司、江苏健佳药业有限公司,河南龙都药业有限公司、安徽新陇海药业有限公司提供。
衍生化试剂对甲苯磺酰氯,纯度≥99%,Sigma-Aldrich公司;乙腈、甲酸、甲醇均为色谱纯、三乙胺(TEA)为分析纯,水为纯化水,其他试剂为分析纯。
2 实验方法 2.1 溶液配制 2.1.1 衍生化试剂溶液取对甲苯磺酰氯适量,精密称定,加乙腈制成每1 mL含2.0 mg的溶液,摇匀,即得。
2.1.2 三乙胺溶液取三乙胺适量,称定,加乙腈制成每1 mL含1.5 mg的溶液,摇匀,即得。
2.1.3 对照品溶液取环维黄杨星D对照品适量,精密称定,加乙腈制成每1 mL含0.2 mg的溶液,必要时进行超声(功率700 W,频率80 kHz)溶解,摇匀;精密吸取5 mL,置10 mL量瓶中,精密加入三乙胺溶液和衍生化试剂溶液各1 mL,摇匀,置60 ℃水浴中反应15 min,取出,放冷,用乙腈定容至刻度,摇匀,即得。
2.1.4 供试品溶液取原料样品适量,精密称定,加乙腈制成每1 mL含0.2 mg的溶液必要时进行超声(功率700 W,频率80 kHz)溶解,摇匀;精密吸取5 mL,置10 mL量瓶中,精密加入三乙胺溶液和衍生化试剂溶液各1 mL,摇匀,置60 ℃水浴中反应15 min,取出,放冷,用乙腈定容至刻度,摇匀,即得。
2.1.5 阴性溶液精密吸取乙腈5 mL,置10 mL量瓶中,精密加入三乙胺溶液和衍生化试剂溶液各1 mL,摇匀,置60℃水浴中反应15 min,取出,放冷,用乙腈定容至刻度,摇匀,即得。
2.2 分析条件 2.2.1 色谱条件采用Waters Xterra C8 (4.6 mm×250 mm,5 μm)色谱柱,流动相为乙腈-0.01%甲酸水溶液(71:29),流速1 mL·min–1,检测波长230 nm,柱温25 ℃,进样量10 μL
2.2.2 定性分析质谱条件离子源为电喷雾电离(ESI)离子源,分析模式为正离子模式,质量扫描范围m/z 100~2000,毛细管电压为4.5 kV,雾化器电压为150 kPa,干燥器温度为180 ℃,干燥气流速为6.0 L·min–1。
2.3 方法学考察 2.3.1 精密度精密吸取“2.1.3”项下对照品溶液,连续进样测定6次,结果显示峰面积的RSD为0.1%(n=6),表明仪器精密度良好。
2.3.2 专属性取对照品溶液、供试品溶液、阴性溶液,进样测定。结果阴性溶液未出现与环维黄杨星D对照品保留时间相一致的色谱峰。表明阴性对主成分和杂质均无干扰,见图 1。
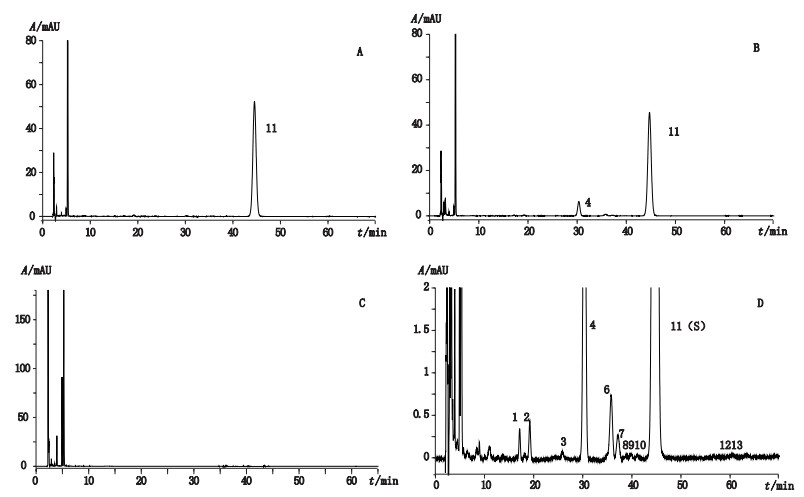
|
11(S).环维黄杨星D衍生产物(cyclovirobuxine D derivative) 1,2,4~10,12,13.杂质衍生产物(impurities derivatives) A.对照品溶液(reference substance solution) B.供试品溶液(sample solution) C.阴性溶液(negative sample solution) D.供试品溶液放大图(the magnified chromatogram of sample solution) 图 1 专属性试验高效液相色谱图 Figure 1 HPLC chromatograms of specificity tests |
精密吸取环维黄杨星D对照品溶液(质量浓度为0.10 mg·mL–1)1、5、10、15、20、25、30 μL,分别注入液相色谱仪,测定峰面积,以进样量(μg)为横坐标,以峰面积为纵坐标,计算得回归方程:
Y=2.563 53×106X-1.092 45×104 r=1.000 0
结果表明,环维黄杨星D进样量在0.10~3.06 μg范围内呈良好线性关系。
2.3.4 稳定性精密吸取供试品溶液(样品批号080907),分别在0、2、4、6、8、10、12、16、18、20、24、28、32、36、42、48、54、60、66、72 h进样10 μL,记录峰面积,计算RSD为1.0%(n=20),表明供试品溶液在72 h内稳定。
2.3.5 重复性称取同一批号样品(批号080907)6份,按供试品溶液制备方法平行制备6份溶液,测定含量;结果平均含量为83.75%,RSD为1.8%(n=6),表明本法重复性良好。
2.3.6 加样回收率称取已测知含量的样品(批号080907) 适量共6份,精密加入质量浓度为0.2432 mg·mL–1的环维黄杨星D对照品溶液5 mL,依法制备供试溶液并测定,计算回收率,结果见表 1。
|
|
表 1 回收率试验考察结果(n=6) Table 1 Results of recovery |
取对照品溶液,用乙腈逐级稀释至信噪比约为3和10时浓度的溶液,连续进样5次。结果检测限为0.36 ng(RSD=2.2%,n=5),定量限为1.36 ng(RSD=4.6%,n=5)。
2.3.8 耐用性取原料样品(批号20070503),按供试品溶液制备法制备1份溶液,采用不同品牌的色谱柱(Waters公司Xterra C8色谱柱(4.6 mm×250 mm,5 μm;填料:辛烷基硅烷键合硅胶杂化颗粒硅胶),岛津公司Inertsil C8-3 (4.6 mm×250 mm,5 μm;填料:辛烷基硅烷键合硅胶),安捷伦公司ZORBAX SB-C8(4.6 mm×250 mm,5 μm;填料:辛烷基硅烷键合硅胶))进行测定,结果含量的RSD为0.9%(n=3),平均含量为85.55%,具体见图 2;在不同品牌仪器(岛津公司LC-20AB高效液相色谱仪,安捷伦公司1260系列高效液相色谱仪,DIONEX UltiMate3000系列高效液相色谱仪)上测定,结果含量的RSD为0.7%(n=3),平均含量为85.66%。
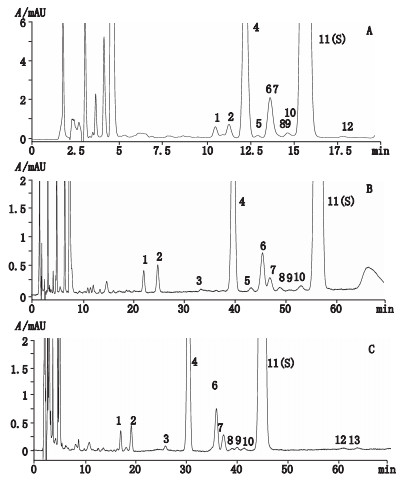
|
11(S).环维黄杨星D衍生产物(cyclovirobuxine D derivative) 1,2,4-10,12,13.杂质衍生产物(impurities derivatives) A. Waters Xterra C8 B. Shimadzu Inertsil C8-3 C. Agilent ZORBAX SB-C8 图 2 耐用性试验高效液相色谱图 Figure 2 HPLC chromatograms of API with columns of different brands |
取样品按供试品溶液制备方法制备溶液,每批制备2份,每份测定2次,主成分按外标一点法计算,结果来自4个厂家的10批样品中环维黄杨星D含量在78.28%~85.48%;主成分按面积归一化法计算,结果环维黄杨星D含量在84.21%~89.84%,具体见表 2。杂质按峰面积归一化法计算,结果杂质含量在10.14%~15.57%,且不同厂家间产品在杂质总量上有区别但在杂质个数上几乎没有区别。此外,每批样品中主成分含量按外标一点法计算结果与面积归一化法计算结果基本吻合,2种方法的结果相对偏差在4.1%以内,因此在杂质没有对照品的情况下可用峰面积归一化法控制其杂质含量。
|
|
表 2 黄杨宁片原料中环维黄杨星D的含量测定结果(n=4) Table 2 Determination results of cyclovirobuxine D in the API |
本法可检出除环维黄杨星D以外的12个杂质峰,具有其他已报道的HPLC方法所不及的优势,体现在流动相可进质谱以及总离子流图可呈现与紫外检测色谱图相同的色谱峰。因此HPLC紫外检测和串联质谱就可很好地应用于原料的杂质定性分析。本文研究中10批样品全部进质谱按“2.2.2”项下的质谱条件进行定性分析。结合有关物质衍生化产物一级质谱、二级质谱的裂解特征,并与环维黄杨星D衍生物相应的裂解特征进行对比分析,即可推断有关物质中TSCL衍生化基团的结合数目及其取代的特征,根据测得的HPLC和LC-MS结果,推测环维黄杨星D有关物质见表 4,2个主要杂质一级质谱、二级质谱见图 3。结果,总共检出除环维黄杨星D12个有关生物碱峰,其中2个为含量较高的主要杂质环黄杨碱D(图 1中4号峰)和环黄杨碱D双键加氢或环维黄杨星C(图 1中6号峰),其余10个微小杂质中推测了4个化合物身份(1、7、8、12,见表 4)及5个化合物的分子式(2、5、9、10、13号峰,见表 4。有7个微小杂质(1、2、5、7、8、9、10号峰,见图 3-A)由于含量在0.1%以上而参与定量,因此连同2个主要杂质共9个杂质峰参与了定量,见表 3。
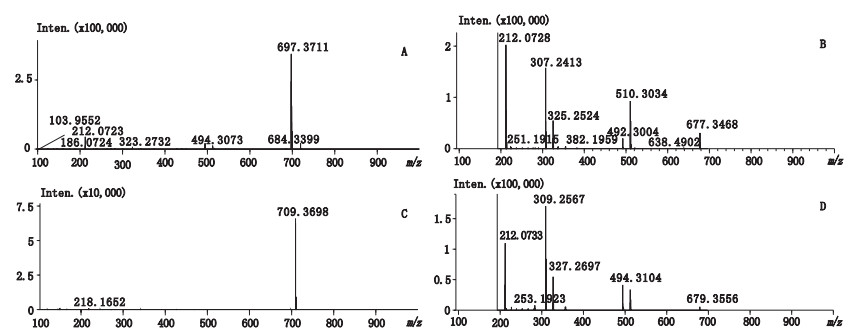
|
图 3 正离子模式下杂质峰4的一级质谱(A)、二级质谱(B)及杂质峰6的一级质谱(C)、二级质谱(D) Figure 3 MS1(A) and MS2(A) spectra of peak 4, and MS1(C) and MS2(D) spectra of peak 6 under positive mode |
|
|
表 3 黄杨宁片原料中杂质含量测定结果(n=4) Table 3 Determination results of the impurities in the API |
|
|
表 4 杂质衍生物质谱特征 Table 4 The structures and MS characteristics of the derivatives of the impurities |
比较了甲醇、乙腈、三氯甲烷、正己烷,最后选择乙腈作为提取溶剂,可确保原料的完全溶解和溶剂自身不参与衍生化反应。
3.2 衍生化反应条件考察以环维黄杨星D衍生产物及杂质衍生产物的峰面积与其相应样品量的比值为衍生效率指标,对反应温度、反应时间、衍生化试剂用量、三乙胺用量及相对应的反应时溶液pH进行了考察,以获得最佳的衍生化反应条件。
3.2.1 衍生化反应温度按上述供试品溶液制备方法,取6份样品,分别设置衍生化反应温度为20、30、40、50、60、70 ℃进行操作和测定,结果表明反应温度与衍生效率密切相关,在20 ~60 ℃的范围内衍生效率随温度的升高而升高,60 ℃时峰面积达到最高,随后衍生效率随温度的进一步升高而呈下降趋势。因此选择60 ℃为反应温度。
3.2.2 衍生化反应时间同上法步骤,取5份样品,分别设置衍生化反应时间为5、15、25、35、45 min进行操作和测定,结果表明反应15 min衍生化效率最高。因此选择15 min为反应时间。
3.2.3 衍生化试剂的用量同上法步骤,取15份样品,按表 5中加入量分别精密加入不同体积的衍生化试剂溶液进行操作和测定。结果当用量为2.00 mg时,衍生效率达最高,此时衍生化试剂与环维黄杨星D摩尔比为4.2:1,达到饱和,继续增加用量其衍生效率则不再增高。因此选择加入2.00 mg·mL–1衍生化试剂溶液1 mL为反应用量。
|
|
表 5 衍生化试剂用量考察结果 Table 5 Effects of the amount of derivatization reagent on derivatization yield |
同上法步骤,取7份样品,按表 6中加入量分别精密加入不同体积的三乙胺溶液进行操作和测定,同时,记录加入不同三乙胺用量时反应溶液的pH。结果三乙胺用量达1.5 mg时,衍生效率达最高,继续增加用量其衍生效率不再增高,此时,反应溶液的pH为10.42。因此选择加入1.5 mg·mL–1三乙胺溶液1 mL为反应用量。
|
|
表 6 三乙胺用量考察结果 Table 6 Effects of the amount of TEA on the yield of derivatization |
本法在保证主成分良好分离的前提下,选择的衍生化试剂可将有关生物碱杂质衍生化并被紫外检测器检测,将主成分定量与杂质检测一步到位,弥补了之前的HPLC法只能两者取一的不足,解决了黄杨宁片原料在分析上的历史疑难问题。此外,相比较生物碱所能采用的其他衍生化方法,本法简单易行,成本低廉,易于在普通实验室操作。
本法还可直接应用于黄杨宁片的含量测定和含量均匀度检查中,且片剂样品前处理步骤同样简单,可实现原料与片剂含量测定方法以及片剂含量测定和含量均匀度检查方法的全部统一。本法具备的另一优点是可直接采用LC-MS分析,相较于其他LC-MS法[24-26],本法方法可进一步进行杂质各色谱峰的定性研究。
本法测定结果与反相离子对色谱法[14]相比基本一致,因此进一步证明了本法对主成分定量的准确性。关键是本法对于杂质的定性定量分析有巨大突破,可对9个同系物杂质进行定性定量分析,而之前报道的各种HPLC法可检出的杂质峰一般在2~8个,仅反相离子对方法可检出最多达14个峰但未定性[21],但各杂质间未良好分离,这也进一步证明了本法检测出杂质的全面性。
本法检测到的杂质在不同品牌C8柱上的分离效果不同,但主成分在不同品牌柱子上均能很好分离,小杂质的分离不彻底并不影响峰面积归一化法计算的杂质总量结果。是否能通过流动相的摸索来解决杂质的分离差异,还有待进一步研究考证。此外杂质衍生化后由于不同化合物结合的衍生化基团个数不同,从而紫外响应值不同,在采用峰面积归一化法计算时,每个杂质的绝对含量存在不准确性,但主成分面积归一化法含量结果与外标一点法含量结果还是相吻合的,因此可采用此法控制杂质总量。
本研究所建立的方法可为黄杨宁片及其原料的含量测定以及杂质检查标准修订提供参考。
| [1] |
胡国强, 许启泰, 张保国, 等. 环维黄杨星D分离方法改进[J]. 中国天然药物, 2004, 2(3): 155. HU GQ, XU QT, ZHANG BG, et al. An improved separation method of cyclovirobuxine D from the total alkaloids of Buxus[J]. Chin J Nat Med, 2004, 2(3): 155. |
| [2] |
梁秉文, 邓晨安, 王学斌, 等. 黄杨木生物碱Ⅰ、Ⅱ、Ⅲ、Ⅳ的分离与结构研究[J]. 药学通报, 1981, 16(4): 3. LIANG BW, DENG CA, WANG XB, et al. Isolation and structural elucidationofBuxus alkaloids Ⅰ, Ⅱ, Ⅲ, Ⅳ[J]. Chin Pharm Bull, 1981, 16(4): 3. |
| [3] |
于民权, 许立, 方泰惠, 等. 环维黄杨星D的药理及毒理研究概况[J]. 安徽医药, 2008, 12(10): 885. YU MQ, XU L, FANG TH, et al. Pharmacology and toxicology over view of cyclovirobuxine D[J]. Anhui Med Pharm J, 2008, 12(10): 885. DOI:10.3969/j.issn.1009-6469.2008.10.001 |
| [4] |
周玖瑶. 环维黄杨星D药理研究概况[J]. 广州中医药大学学报, 2005, 22(1): 70. ZHOU JY. Pharmacologia over view of cyclovirobuxine D[J]. J Guangzhou UnivTradit Chin Med, 2005, 22(1): 70. |
| [5] |
吴捷, 毛幼桦. 黄杨宁心血管药理作用[J]. 心脏杂志, 2003, 15(2): 169. WU J, MAO YH. Cardiovascular pharmacological effects of Huangyangning[J]. Chin Heart J, 2003, 15(2): 169. |
| [6] |
HU D, LIU XY, WANG YY, et al. Cyclovirobuxine D amelioates acute myocardial ischemia by K(ATP)channel opening, nitric oxide release and anti-thrombosis[J]. Eur J Pharmacol, 2007, 569(1-2): 103. DOI:10.1016/j.ejphar.2007.04.038 |
| [7] |
YU B, FANG TH, LV GH, et al. Beneficial effect of cyclovirobuxine D on heart failure rats following myocardial infarction[J]. Fitoterapia, 2011, 82(6): 868. DOI:10.1016/j.fitote.2011.04.016 |
| [8] |
NERI M, CERRETANI D, FIASCHI AI, et al. Correlation between cardiac oxidative stress and myocardial pathology due to acute and chronic norepinephrine administration in rats[J]. J Cell Mol Med, 2007, 11(1): 156. DOI:10.1111/jcmm.2007.11.issue-1 |
| [9] |
刘洁, 杭太俊, 张正行. HPLC法测定黄杨宁中环维黄杨星D和有关生物碱检查[J]. 药物分析杂志, 2006, 26(4): 446. LIU J, HANG TJ, ZHANG ZX. HPLC determination of cyclovirobuxine D and its related alkaloids in Huangyangning[J]. Chin J Pharm Anal, 2006, 26(4): 446. |
| [10] |
梁秉文, 张正行, 方泰惠, 等. 黄杨碱与心脑血管疾病[M]. 北京: 化学工业出版社, 2011. LIANG BW, ZHANG ZX, FANG TH, et al. Buxus Alkaloids and Cardiovascular Disease[M]. Beijing: Chemical Industry Press, 2011. |
| [11] |
邱明华, 聂瑞麟. 黄杨生物碱及其植物资源[J]. 天然产物研究与开发, 1992, 4(4): 41. QIU MH, NIE RL. Buxus alkaloids and its plant resources[J]. Nat Product Res Dev, 1992, 4(4): 41. |
| [12] |
中国药典2000年版. 一部[S]. 2000: 153 ChP 2000. Vol Ⅰ[S]. 2000:153 |
| [13] |
中国药典2005年版. 一部[S]. 2005: 276 ChP2005. Vol Ⅰ[S]. 2005:276 |
| [14] |
中国药典2010年版. 一部[S]. 2010: 575 ChP2010. Vol Ⅰ[S]. 2010:575 |
| [15] |
中国药典2015年版. 一部[S]. 2015: 406 ChP2015. Vol Ⅰ[S]. 2015:406 |
| [16] |
谢昀, 于治国, 徐新盛, 等. 反相离子对色谱法测定环维黄杨星D含量[J]. 药物分析杂志, 2006, 26(7): 888. XIE Y, YU ZG, XU XS, et al. Determination of cyclovirobuxine D by ion pair RP-HPLC[J]. Chin J Pharm Anal, 2006, 26(7): 888. |
| [17] |
郭青, 吕霞, 孙姗, 等. 黄杨宁原料及片中环维黄杨星D含量及含量均匀度测定[J]. 药物分析杂志, 2009, 29(10): 1651. GUO Q, LÜ X, SUN S, et al. Determination and uniformity examination of cyclovirobuxine D in Huangyangning materials and its tablets[J]. Chin J Pharm Anal, 2009, 29(10): 1651. |
| [18] |
陈勇, 樊雪君, 龚青. HPLC梯度洗脱法测定黄杨宁片中环维黄杨星D的含量[J]. 中国中药杂志, 2006, 31(14): 1155. CHEN Y, FAN XJ, GONG Q. Determination of cyclovirobuxine-D in Huangyangning tablets by RP-HPLC with gradient elution[J]. China J Chin Mater Med, 2006, 31(14): 1155. DOI:10.3321/j.issn:1001-5302.2006.14.006 |
| [19] |
吕霞, 胡明通, 杨春, 等. HPLC-ELSD法测定黄杨宁片中环维黄杨星D的含量[J]. 现代中药研究与实践, 2014, 28(3): 52. LÜ X, HU MT, YANG C, et al. Determination of cyclovirobuxine D in Huangyangningtablets by HPLC-ELSD[J]. Chin Med J Res Pract, 2014, 28(3): 52. |
| [20] |
郭青, 吕霞, 伍乃英, 等. 黄杨宁片及原料中环维黄杨星D含量测定的3种HPLC方法评价[J]. 中国现代应用药学杂志, 2009, 26(11): 929. GUO Q, LÜ X, WU NY, et al. Evaluation on three HPLC methods on the determination of cyclovirobuxine D in Huangyangning tablets and raw materials[J]. Chin J Mod Appl Pharm, 2009, 26(11): 929. |
| [21] |
徐新军, 张正行, 盛龙生, 等. 柱前荧光衍生化RP-HPLC测定环维黄杨D含量[J]. 药学学报, 2002, 37(5): 359. XU XJ, ZHANG ZX, SHENG LS, et al. Determination of cyclovirobuxine D by RP-HPLC with precolumn fluorescenced dervatization[J]. Acta Pharm Sin, 2002, 37(5): 359. |
| [22] |
黄勤安, 黄海燕, 鲁静, 等. 高效液相色谱法测定黄杨宁片中环维黄杨星D的含量和含量均匀度[J]. 药物分析杂志, 2007, 27(2): 264. HUANG QA, HUANG HY, LU J, et al. HPLC determination of content and uniformity of cyclovirobuxine D in Huangyangning tablets[J]. Chin J Pharm Anal, 2007, 27(2): 264. |
| [23] |
李欣, 沈敏雅, 杨倩, 等. 对甲基苯磺酰氯柱前衍生法测定水中哌嗪[J]. 分析试验室, 2012, 31(12): 48. LI X, SHEN MY, YANG Q, et al. Determination of piperazine in water using pre-column derivatization with p-tosyl chloride[J]. Chin J Anal Lab, 2012, 31(12): 48. |
| [24] |
DING L, HU JJ, JIANG M, et al. Sensitive HPLC-APCI-MS method for the determination of cyclovirobuxine D in human plasma[J]. J Chromatogr B, 2006, 843(1): 78. DOI:10.1016/j.jchromb.2006.05.040 |
| [25] |
YU P, ZOU LM, LIU WY, et al. High performance liquid chromatography-tandem mass spectrometric determination of cyclovirobuxine D in human plasma[J]. J Pharm Biomed Anal, 2006, 42(4): 488. DOI:10.1016/j.jpba.2006.04.025 |
| [26] |
MU LL, YU P, HE LH. Determination of cyclovirobuxine D in human plasma by liquid chromatography tandem mass spectrometry and application in a pharmacokinetic study[J]. Acta Pharm Sin B, 2011, 1(3): 184. DOI:10.1016/j.apsb.2011.06.012 |
 2017, Vol. 37
2017, Vol. 37 
