抗骨增生丸为国家基本医疗保险药品目录收载品种,是由熟地黄、淫羊藿、骨碎补等9味中药制成的蜜丸,临床广泛用于增生性脊椎炎、颈椎综合症、骨刺等骨质增生症[1]。熟地黄、淫羊藿、骨碎补均为该复方制剂的主要药味,其主要活性成分毛蕊花糖苷为苯乙醇苷类化合物,淫羊藿苷和柚皮苷为黄酮类,功能主治与该制剂功能主治相一致。该制剂现行标准[2]仅对淫羊藿苷进行含量测定,未能全面控制其质量,且国内尚未见对抗骨增生丸中毛蕊花糖苷、柚皮苷和淫羊藿苷3种有效成分含量同时进行质量控制的报道及文献。笔者参考相关文献[2-7],采用HPLC法同时测定抗骨增生丸中3种成分,有利于产品质量控制和临床用药的安全有效。
1 仪器与试药安捷伦公司Agilent 1260高效液相色谱仪(VWD检测器),安捷伦公司LC solution工作站,安捷伦公司Agilent ZORBAX SB-C18(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶)色谱柱,梅特勒-托利多仪器有限公司AG-135电子分析天平,山东济宁恒通超声电子设备有限公司HT-300BQ超声仪,岛津公司Shimadzu UV-2450紫外分光光度计。
对照品毛蕊花糖苷(批号111530-201512,含量96.7%)、柚皮苷(批号110722-201312,含量94.7%)、淫羊藿苷(批号110737-201516,含量94.2%)均购自中国食品药品检定研究院。
抗骨增生丸(大蜜丸,每丸重3 g)为吉林龙泰制药股份有限公司产品,批号150804、151102、151104。
甲醇、乙腈为色谱纯,水为超纯水,其他试剂为分析纯。
2 方法与结果 2.1 色谱条件采用Agilent C18(250 mm×4.6 mm,5 μm)色谱柱,流动相A为水,流动相B为甲醇,流动相C为乙腈,按表 1程序进行线性梯度洗脱,流速1.0 mL·min-1,检测波长270 nm,柱温30 ℃,进样量10 μL。
|
|
表 1 梯度洗脱程序 Table 1 Gradient elution program |
分别取毛蕊花糖苷、柚皮苷、淫羊藿苷的对照品适量,精密称定,用50%甲醇水溶液溶解并定量稀释制成质量浓度分别为0.508、0.756、0.513 mg·mL-1的混合溶液,作为混合对照品储备溶液;精密量取混合对照品储备溶液2 mL置20 mL量瓶中,加50%甲醇水溶液稀释至刻度,即得混合对照品溶液。
2.2.2 供试品溶液样品剪碎,取约2 g,精密称定,置具塞锥形瓶中,精密加入50%乙醇水溶液50 mL,称量,超声处理(功率300 W,频率40 kHz)45 min,放冷,用50%乙醇水溶液补足减失的量,摇匀,滤过,续滤液作为供试品溶液。
2.2.3 阴性样品溶液按处方量制备缺熟地黄、淫羊藿和骨碎补的样品,同供试品溶液制备方法制备阴性样品溶液。
2.3 系统适用性试验精密量取混合对照品溶液、供试品溶液和阴性样品溶液各10 μL,分别注入色谱仪,记录色谱图,见图 1。结果理论塔板数按毛蕊花糖苷、柚皮苷和淫羊藿苷计算均不低于3 000,3种成分色谱峰与相邻峰之间分离度均大于1.5,对称因子在0.95~1.05内,样品中其他成分不干扰待测成分的测定。
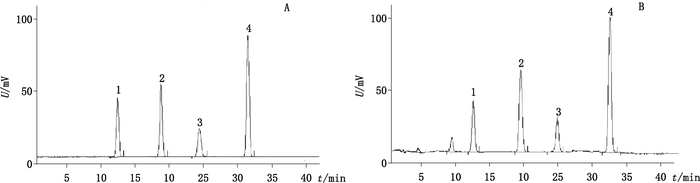
|
1.毛蕊花糖苷(verbascoside)2.柚皮苷(naringin)3.淫羊藿苷(icariin) 图 1 混合对照品(A)、样品(B)和阴性样品(C)的HPLC图谱 Figure 1 HPLC Chromatograms of mixed reference substances(A), sample(B), and negative sample without Rehmanniae Radix Praeparata, Epimedii Folium and Drynariae Rhizoma(C) |
精密量取“2.2.1”项下混合对照品储备溶液0.25、0.50、1.00、2.00、3.00、5.00 mL,分别置25 mL量瓶中,加50%甲醇稀释至刻度,即得系列混合对照品溶液;照上述色谱条件进样测定,记录色谱图;以峰面积Y对质量浓度X(μg·mL-1)进行线性回归,得到3种待测物的回归方程、相关系数,结果见表 2。
|
|
表 2 3种成分的回归方程及线性范围 Table 2 Regression equations and linear ranges of three constituents |
以“2.4.1”项下浓度最低的混合对照品溶液逐级稀释,依法进行测定,当信噪比为3:1时,计算毛蕊花糖苷、柚皮苷和淫羊藿苷检测限分别为0.21、0.31和0.14 ng。
2.5 精密度试验和重复性试验取样品批号为150804的供试品溶液连续进样6次,记录色谱图,毛蕊花糖苷、柚皮苷和淫羊藿苷峰面积的RSD(n=6)分别为0.54%、0.69%和0.96%,表明本法精密度良好。取样品(批号150804),制备供试品溶液6份,进样分析,以外标法计算含量,毛蕊花糖苷、柚皮苷和淫羊藿苷平均含量分别为1.18、1.82和1.41 mg·丸-1,RSD分别为1.0%、0.8%和0.6%
2.6 稳定性试验取样品(批号150804),依法制成供试品溶液,每隔4 h进样1次,共7次,记录色谱图,毛蕊花糖苷、柚皮苷和淫羊藿苷峰面积的RSD(n=6)分别为0.78%、0.55%和0.81%,表明供试品溶液在24 h内稳定。
2.7 加样回收率取用本法已测知含量的样品(批号150804)剪碎,取约2.0 g共9份,精密称定;每3份为一组,分别精密加入混合对照品储备溶液4、5、6 mL,按供试品溶液制备方法处理,按上述色谱条件测定,计算回收率。结果见表 3,表明本方法准确度良好。
|
|
表 3 回收试验结果 Table 3 Results of recovery test |
取3批样品(批号150804,151102,151104)各3份,按照本文方法制备供试品溶液并测定,以外标法计算含量,结果见表 4。
|
|
表 4 3种成分的含量测定结果(mg·丸-1,n=3) Table 4 Determination results of three components(mg per pill, n=3) |
由于各成分性质差异较大,为了使毛蕊花糖苷、柚皮苷和淫羊藿苷3个成分都达到良好的分离,笔者分别考察了不同比例的乙腈-水、乙腈-0.1%醋酸水溶液等流动相系统[8-11],结果分离效果均不甚理想。如以乙腈-水(20:80)两相系统为流动相时,毛蕊花糖苷、柚皮苷出峰好,但淫羊藿苷保留时间过长,而且杂质分离效果差,峰形较差;经过进一步的对比研究,最终选择甲醇-乙腈-水三相系统为流动相梯度洗脱,可消除杂质对被测成分的干扰,各成分的色谱峰峰形对称,理论塔板数高,分离度好,缩短了多成分检测的分析时间。
3.2 检测波长选择取毛蕊花糖苷、柚皮苷、淫羊藿苷对照品溶液,以初始比例流动相为空白,在200~400 nm进行紫外扫描,兼顾多种成分的最大吸收,重点考察334、283、270 nm波长。实验发现,在283 nm波长处,毛蕊花糖苷吸收较低,334 nm波长处,柚皮苷吸收较低,而在270 nm波长处,3种成分都有较强吸收,因此,选择淫羊藿苷的最大吸收波长270 nm作为检测波长,可同时得到较好的色谱峰,并能满足定量测定的要求。
3.3 提取方法的选择笔者分别对回流提取法、冷浸法、超声法进行了考察[12-14]。结果显示,回流提取1 h基本提取完全,但提取温度较高,可能对其活性成分产生较大的影响,活性成分含量均有不同程度的降低[15];而冷浸法提取时,为获得较好的效果,需不定期振摇,且浸泡时间长,提取效率较低;超声法可在30 min内基本提取完全,具有提取时间短,提取温度低,提取率高等特点。综合提取方法及各检测成分的特点,最终选用超声提取法提取。对超声处理时间15、30、45、60 min进行考察,结果表明,超声处理30 min后各成分含量不再增加,考虑到样品的差异性,选择超声处理45 min。在提取溶剂方面,分别考察了乙醇、50%甲醇水溶液、50%甲醇水溶液、甲醇,结果表明50%甲醇水溶液和50%乙醇水溶液超声提取完全且杂质干扰峰较少,结果差异不大,但甲醇毒性较乙醇大,且从经济实用的角度,故提取溶剂选择50%乙醇水溶液。
3.4 小结本实验通过HPLC法梯度洗脱,能快速、准确地对抗骨增生丸中毛蕊花糖苷、柚皮苷和淫羊藿苷同时进行定量测定,可为抗骨增生丸质量标准进一步完善提供参考。
| [1] |
陈英红, 黄恩喜, 高阳, 等. 抗骨增生丸定性定量方法研究[J]. 中国实验方剂学杂志, 2006, 12(7): 20. CHEN YH, HUANG EX, GAO Y, et al. Studies on qualitative and quantitative methods for the analysis of Kangguzengsheng pills[J]. Chin J Exp Tradit Med Form, 2006, 12(7): 20. |
| [2] |
中国药典2015年版. 一部[S]. 2015: 777, 256, 124. ChP 2015. Vol Ⅰ[S]. 2015:777, 256, 124 |
| [3] |
韩丽萍, 陈行愉, 刘志刚. HPLC法同时测定抗骨质疏松中成药中柚皮苷及淫羊藿苷的含量[J]. 中国药房, 2010, 21(43): 4083. HAN LP, CHEN HY, LIU ZG. Simultaneous determination of naringin and icariin in anti osteoporosis Chinese patent medicine by HPLC[J]. China Pharm, 2010, 21(43): 4083. |
| [4] |
韩丽萍, 陈行愉, 邓伟民. HPLC法同时测定补肾壮骨颗粒中淫羊藿苷及柚皮苷含量[J]. 中成药, 2011, 33(1): 184. HAN LP, CHEN HY, DENG WM. Simultaneous determination of naringin and icariin in kidney and bone granules by HPLC[J]. Chin Tradit Pat Med, 2011, 33(1): 184. |
| [5] |
薛标强, 袁洁丽. HPLC法测定抗骨增生片中柚皮苷的含量[J]. 轻工科技, 2014, 1(1): 105. XUE BQ, YUAN JL. Determination of naringin in Kangguzengsheng tablets by HPLC[J]. Light Ind Sci Technol, 2014, 1(1): 105. |
| [6] |
徐灿辉, 何维为, 何云飞. HPLC法测定六味地黄胶囊中的毛蕊花糖苷、马钱苷、芍药苷和丹皮酚[J]. 药物评价研究, 2014, 37(3): 257. XU CH, HE WW, HE YF. Simultaneous determination of four constituents in Liuwei Dihuang capsule by HPLC[J]. Drug Eval Res, 2014, 37(3): 257. |
| [7] |
张智军, 崔华, 马久太. HPLC法测定抗骨增生片中柚皮苷含量[J]. 世界中医药, 2012, 7(4): 360. ZHANG ZJ, CUI H, MA JT. Content determination of naringin in Kanggu Zengsheng tablets by HPLC[J]. World Chin Med, 2012, 7(4): 360. |
| [8] |
何培根, 刘菁, 李志浩. 补益地黄丸中毛蕊花糖苷的含量分析[J]. 现代中药研究与实践, 2015, 29(3): 56. HE PG, LIU J, LI ZH. Determination of verbascosidin in Buyi Dihuang Wan[J]. Res Pract Chin Med, 2015, 29(3): 56. |
| [9] |
李文斌. HPLC法测定麦味地黄丸中毛蕊花糖苷的含量[J]. 中国药房, 2014, 25(28): 2665. LI WB. Content determination of verbascoside in Maiwei Dihuang pills by HPLC[J]. China Pharm, 2014, 25(28): 2665. DOI:10.6039/j.issn.1001-0408.2014.28.25 |
| [10] |
任春萍, 王鸽, 赵怀清, 等. HPLC法同时测定抗骨增生片中麦角甾苷﹑柚皮苷和淫羊藿苷的含量[J]. 沈阳药科大学学报, 2011, 28(3): 211. REN CP, WANG G, ZHAO HQ, et al. Simultaneous determination of acteoside, naringin and icariine in Kangguzengsheng tablets by HPLC[J]. J Shenyang Pharm Univ, 2011, 28(3): 211. |
| [11] |
朱静, 杨青青. 抗骨增生胶囊中柚皮苷的HPLC法测定[J]. 中国医药工业杂志, 2013, 44(8): 795. ZHU J, YANG QQ. Determination of naringin in Kanggu Zengsheng capsules by HPLC[J]. Chin J Pharm, 2013, 44(8): 795. |
| [12] |
欧阳露, 夏勇, 夏鹏, 等. 高效液相色谱法同时测定补肾化瘀浸膏中淫羊藿苷及柚皮苷含量[J]. 医药导报, 2014, 33(9): 1224. OUYANG L, XIA Y, XIA P, et al. Simultaneous determination of icariin and naringin in Bushen Huayu extract by HPLC[J]. Her Med, 2014, 33(9): 1224. |
| [13] |
陈天朝, 翟来超. HPLC同时测定地黄中梓醇与毛蕊花糖苷的含量[J]. 中国实验方剂学杂志, 2011, 17(5): 105. CHEN TC, ZHAI LC. Simultaneous content determination of catalpol and verbascoside in Rehmannia by HPLC[J]. Chin J Exp Tradit Med Form, 2011, 17(5): 105. |
| [14] |
刘淑妦, 张妮瑜, 辛秀, 等. 抗骨增生片定性定量方法研究[J]. 中南药学, 2014, 12(6): 574. LIU SF, ZHANG NY, XIN XQ, et al. Qualitative and quantitative method for the analysis of Kanggu Zengsheng tablet[J]. Cent South Pharm, 2014, 12(6): 574. DOI:10.7539/j.issn.1672-2981.2014.06.020 |
| [15] |
王亮, 张巧艳, 年华, 等. 用HPLC法测定地黄叶中毛蕊花糖苷的含量[J]. 药学服务与研究, 2015, 15(1): 26. WANG L, ZHANG QY, NIAN H, et al. Content determination of verbascoside in Rehmannia leaf by HPLC[J]. Pharm Care Res, 2015, 15(1): 26. |
 2017, Vol. 37
2017, Vol. 37 