2. 河南省安阳市人民医院药剂科, 安阳 455000
2. The Pharmacy Department of Henan Anyang People Hospital, Anyang 455000, China
甘油果糖氯化钠注射液是临床上用于治疗急慢性颅内压增离、脑水肿等病症的常用药,由于其颅内降压作用强,降压效果持久,无“反跳”现象以及几乎无副作用等优点,临床上使用量日益增多,已渐渐超过另一种颅内脱水剂甘露醇。甘油果糖氯化钠注射液处方中甘油、果糖、氯化钠3种成分均是高渗透性脱水剂,处方比例为甘油100 mg·mL-1,果糖50 mg·mL-1,氯化钠9 mg·mL-1。目前甘油果糖氯化钠注射液的质量标准收载于中国药典2015年版二部[1],标准中氯化钠、果糖、甘油的含量测定采用HPLC-UV法,以磺酸型聚苯乙烯与二乙烯基苯共聚体阳离子交换树脂H型(简称H型阳离子柱)为填充物,以0.04 mol·L-1磷酸为流动相,在200 nm波长处进行测定,出峰顺序为氯化钠、果糖、甘油。该法虽然能同时测定3个组分,但存在以下几个缺点:1)H型阳离子柱价格昂贵,使用寿命短,且适用面窄,2015年版中国药典中仅利巴韦林[1]、人血制品中糖及糖醇[2]等几个品种推荐使用该型号色谱柱,基本上为专用柱,因此非生产型企业一般不具备;2)检测波长200 nm接近末端吸收,重现性较差[3];3)甘油在处方中的比例最大,但由于甘油的紫外吸收很微弱,在UV检测器上色谱响应小,相对峰面积仅10%左右,稍微一点误差即造成结果的差异很大,重现性差,对仪器的精密度要求很高。
果糖广泛存在于蜂蜜、果葡糖浆、蜜饯等食品及药用辅料中,文献报道中多采用HPLC-RID法测定果糖的含量[4-5],该方法已经比较成熟。甘油是一种常见的渗透压调节剂,也是用途很广的药用辅料,文献报道中关于甘油含量测定的方法有很多,如高碘酸钠氧化酸碱滴定法[6]、气相色谱法[7]、HPLC-ELSD法[8]、HPLC-RID法[9-10]等。但同时测定甘油和果糖含量的方法暂未见报道。
本文针对甘油果糖氯化钠注射液现行质量标准中关于含量测定的不足,探索了一种新的含量测定方法,现报道如下。
1 仪器与试药 1.1 仪器Agilent 1260高效液相色谱仪[四元泵系统,示差折光检测器(RID),二极管阵列检测器(DAD);安捷伦公司];Phenomenex Luna 5u氨基柱(250 mm×4.6 mm,5 μm;填料:氨丙硅烷基键合硅胶;Phenomenex公司),BIO-RAD Aminex HPX-87H型阳离子柱(磺酸型聚苯乙烯与二乙烯基苯共聚体阳离子交换树脂H型;BIO-RAD公司),梅特勒-托利多电子分析天平(梅特勒公司)。
1.2 试药对照品甘油(批号190057-201301,含量99.5%)、果糖(批号100231-201305,含量99.4%)、氯化钠(批号100376-201202,含量99.8%)均购自中国食品药品检定研究院;10批次样品均来自四川科伦制药有限公司;AgNO3滴定液(C=0.102 1 mol·L-1),安阳市人民医院药剂科自制并标定;乙腈为色谱纯,水为超纯水。
2 方法与结果 2.1 氯化钠的含量测定[3] 2.1.1 样品测定精密量取甘油果糖氯化钠注射液10 mL,置250 mL锥形瓶中,加新沸水50 mL稀释,加入糊精溶液(1→50)5 mL、碳酸钙0.1 g以及荧光黄指示液5滴,用AgNO3滴定液滴定至溶液由黄绿色转变成微红色,记录消耗的AgNO3滴定液体积,同时做空白试验。每1 mL的AgNO3滴定液(0.1 mol·L-1)相当于氯化钠5.844 mg。
| $氯化钠的含量=\frac{\left( V-{{V}_{0}} \right)\times 5.844\times C}{10}$ |
式中:V、V0分别为样品和空白消耗的AgNO3滴定液体积,C为AgNO3滴定液的浓度。
2.1.2 专属性试验按处方比例配制不含氯化钠的空白溶液,按“2.1.1”项方法滴定,记录空白溶液消耗AgNO3滴定液的体积。空白试验消耗AgNO3滴定液的体积几乎为0,表明处方中的其他成分对氯化钠的含量测定无干扰。
2.1.3 加样回收率试验精密称取氯化钠对照品0.8770 g,置100 mL量瓶中,加水溶解并稀释至刻度,摇匀,即得质量浓度为8.77 mg·mL-1的氯化钠对照品溶液。取批号T16010807的甘油果糖氯化钠注射液共9份,每份5 mL,置250 mL锥形瓶中,平均分成3组,各组分别加入氯化钠对照品溶液4、5、6 mL,按“2.1.1”项方法进行滴定,计算平均加样回收率,结果见表 1。
|
|
表 1 待测组分回收率考察结果 Table 1 Recovery test results of the investigated compounds |
精密称取甘油对照品以及经70 ℃减压干燥4 h的果糖对照品适量,置50 mL量瓶中,加水定容,制成甘油质量浓度为4.44 mg·mL-1及果糖质量浓度为2.44 mg·mL-1的混合溶液,即得。
2.2.1.2 供试品溶液精密量取甘油果糖氯化钠注射液5 mL,置200 mL量瓶中,加水稀释至刻度,摇匀,用0.45μm微孔滤膜过滤,即得。
2.2.1.3 阴性样品的制备按处方比例称取除甘油或果糖外的其他成分适量,置100 mL量瓶中,用水稀释至刻度,摇匀;精密量取5 mL,按“2.2.1.2”项方法制成甘油阴性样品和果糖阴性样品。
2.2.2 色谱条件[4-5]色谱柱:Phenomenex Luna 5u氨基柱(250 mm×4.6 mm,5μm);流动相:乙腈-水(75:25);检测器:Agilent 1260示差折光检测器;柱温:35 ℃;流通池温度:35 ℃;进样量:10 μL。
2.2.3 方法学考察 2.2.3.1 专属性试验精密吸取供试品溶液、混合对照品溶液及各阴性样品溶液各10 μL,注入高效液相色谱仪,各溶液色谱图见图 1。从图 1可以看出,在甘油和果糖的保留时间处无其他干扰,说明处方中的氯化钠和其他辅料对甘油和果糖的测定无影响。
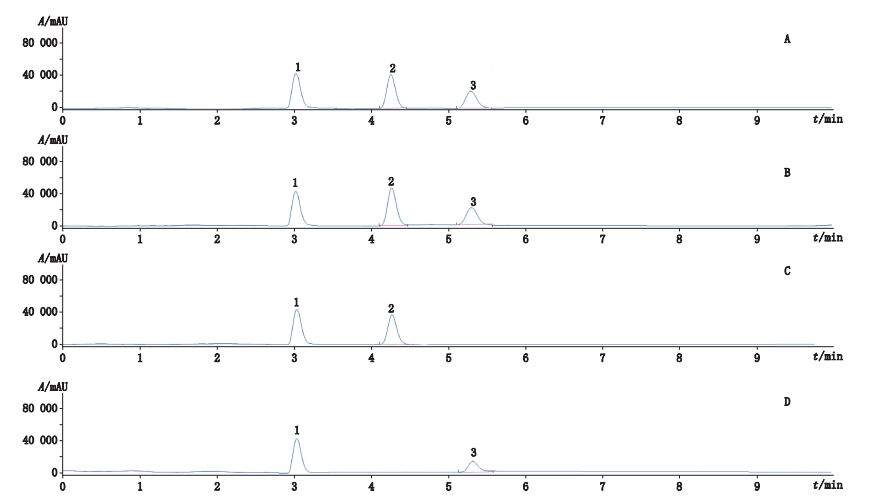
|
1.水(water)2.甘油(glycerol)3.果糖(fructose) 图 1 混合对照品(A)、样品(B)、果糖阴性样品(C)和甘油阴性样品(D)的色谱图 Figure 1 HPLC chromatograms of mixed reference substances(A), sample(B), fructose negative sample(C)and glycerol negative sample(D) |
精密量取“2.2.1.1”项下的混合对照品储备液2、4、6、8、10 mL,分别置10 mL量瓶中,加水稀释至刻度,制成甘油质量浓度为0.888~4.44 mg·mL-1及果糖质量浓度为0.488~2.44 mg·mL-1的梯度对照品溶液。精密吸取各梯度对照品溶液各10 μL,注入高效液相色谱仪,记录各色谱峰面积。以对照品的质量浓度X(mg·mL-1)为横坐标,峰面积Y(nRIU×s)为纵坐标,进行回归分析,甘油和果糖的回归方程及线性范围见表 2。
|
|
表 2 甘油和果糖的线性范围、回归方程、检测限及定量限 Table 2 The linear range, regression equation, LOD and LOQ of glycerol and fructose |
将“2.2.3.2”项下的最低浓度对照品溶液逐级稀释,按“2.2.2”项色谱条件平行进样测定6次,以S/N=3计算甘油和果糖的方法检测限;以S/N=10计算方法的定量限,结果见表 1。
2.2.3.4 精密度试验精密吸取同一混合对照品溶液10 μL,连续进样5次,测得甘油和果糖的峰面积,计算RSD分别为0.69%和0.68%。
2.2.3.5 耐用性试验采用Phenomenex Luna 5u(250 mm×4.6 mm,5 μm;填料:氨丙硅烷基键合硅胶)、Agilent ZORBAX(250 mm×4.6 mm,5μm;填料:氨丙硅烷基键合硅胶)、Kromasil 100-5-NH2(250 mm×4.6 mm,5μm;填料:氨丙硅烷基键合硅胶)3种品牌的色谱柱,在不同柱温和流通池温度下各连续进样6次,记录色谱峰面积,计算甘油和果糖色谱峰面积的RSD。从表 3可以看出,在不同色谱柱以及不同柱温和流通池温度下,待测组分峰面积RSD(n=6)均小于1.0%,表明本文所用高效液相色谱仪具有良好的热屏蔽系统及在线脱气功能,仪器精密度和方法耐用性良好,满足测量要求。
|
|
表 3 耐用性试验考察结果 Table 3 Results of durability test |
将同一供试品溶液(样品批号T16010807)分别在室温放置0、4、8、12、16、20、24 h后进样,记录色谱峰面积,得甘油色谱峰面积的RSD(n=7)为0.79%,果糖色谱峰面积的RSD(n=7)为0.92%,表明供试品溶液在室温条件下24 h内基本稳定。
2.2.3.7 加样回收率试验取批号T16010807的甘油果糖氯化钠注射液9份,每份2.5 mL,平均分成3组,在各组样品中分别加入高、中、低浓度的甘油、果糖对照品溶液适量,按“2.2.1.2”项方法制备成供试溶液。按“2.2.2”项下色谱条件进样分析,计算各供试品溶液的回收率,结果见表 1。
2.3 样品测定取甘油果糖氯化钠注射液10批,分别按“2.1”项下方法测定氯化钠的含量,按“2.2”项方法测定甘油和果糖的含量,结果用相对于标示量的百分数表示。并将本法测定结果与中国药典方法测定结果比较,结果见表 4。表 4数据表明,本法测定结果与药典方法测定结果基本一致,相对偏差小于1.0%。
|
|
表 4 2种方法测定甘油果糖氯化钠注射液中3种成分含量的比较(%) Table 4 Content comparison of 3 components in glycerol fructose and sodium chloride injection detected by two methods |
氨基柱是一种既可以用于正相色谱也可以用于反相色谱的常用色谱柱,广泛应用于分析食品中的糖类如乳糖、果糖、葡萄糖、麦芽糖等,对多羟基碳水化合物也有较好的分离效果。本文选取Phenomenex Luna 5u氨基柱为液相色谱分析柱,结果表明,样品中的甘油和果糖在该柱上色谱行为良好,理论塔板数均在5 000以上,分离度在2.0以上。与甘油果糖氯化钠注射液现行质量标准(中国药典2015年版二部)推荐使用的H型阳离子柱相比,氨基柱具有价格便宜易得,使用寿命长,适用面广的优点。
3.2 检测器的选择[14-15]中国药典方法采用紫外检测器测定3个组分的含量,由于待测组分的紫外吸收200 nm接近末端吸收,且吸收很弱,甘油峰峰形较差,相对峰面积小,重复性差。甘油和果糖的含量测定,在实验初期考察了2种通用型检测器:蒸发光散射检测器ELSD以及示差折光检测器RID。考察结果表明,甘油和果糖在ELSD上色谱行为良好,并且在一定浓度范围内,峰面积的自然对数与浓度的自然对数呈良好的线性关系。相比RID,ELSD具有灵敏度高,支持梯度洗脱,受环境温度变化影响小等优点。但ELSD价格昂贵,需要用到高压氮气或空气,使用不便,且供试品中含有的不挥发盐氯化钠会污染ELSD检测器。
RID的色谱响应取决于供试品溶液的浓度,与是否有紫外吸收无关。从图 1可以看出,甘油和果糖在RID上均有良好的响应,两组分峰面积比例适中。且本实验并非痕量检测,样品中甘油含量达100 mg·mL-1,果糖含量达50 mg·mL-1,RID的灵敏度已经完全满足要求。精密度及耐用性考察结果表明,本文所用高效液相色谱仪具有良好的温度控制以及在线脱气系统,使RID免受环境温度变化及流动相气体含量变化的影响,实现基线平稳,测量精度RSD(n=6)小于1.0%。综合考虑,本文选取RID进行甘油和果糖的含量测定。
| [1] |
中国药典2015年版. 二部[S]. 2015: 118, 486, 1268. ChP 2015.Vol Ⅱ[S]. 2015:118, 486, 1268 |
| [2] |
中国药典2015年版. 三部[S]. 2015: 通则60. ChP 2015.Vol Ⅲ[S]. 2015:General Rules 60 |
| [3] |
杜敏, 周华英, 李惠军. 甘油果糖注射液中氯化钠的含量测定研究[J]. 实用中西医结合临床, 2005, 5(2): 69. DU M, ZHOU HY, LI HJ. Research for the determination of sodium chloride in glycerol and fructose injection[J]. Pract Clin J Integr Tradit Chin West Med, 2005, 5(2): 69. |
| [4] |
周立春, 纪宏. 乳果糖口服液含量的HPLC测定法研究[J]. 药物分析杂志, 2000, 20(3): 174. ZHOU LC, JI H. Development of HPLC method for lactulose oral solution assay[J]. Chin J Pharm Anal, 2000, 20(3): 174. |
| [5] |
张小丽. HPLC测定混合糖电解质注射液中果糖、葡萄糖和木糖醇的含量[J]. 中国现代应用药学, 2011, 28(7): 676. ZHANG XL. Determination of fructose, glucose and xylitolum in carbohydrate and electrolyte injection by HPLC[J]. Chin J Mod Appl Pharm, 2011, 28(7): 676. |
| [6] |
中国药典2015年版. 四部[S]. 2015: 490. ChP 2015.Vol Ⅳ[S]. 2015:490 |
| [7] |
李丹, 周明辉, 刘莹峰, 等. 气相色谱法测定粗甘油中的游离甘油含量[J]. 分析测试学报, 2011, 30(9): 1055. LI D, ZHOU MH, LIU YF, et al. Determination of free glycerol in crude glycerin by gas chromatography[J]. J Instrum Anal, 2011, 30(9): 1055. |
| [8] |
张瑶. HPLC-ELSD法测定甘油含量的研究及硫酸钾的回收工艺[D]. 昆明: 昆明理工大学, 2011. ZHANG Y. Determination of Glycerol Content by HPLC-ELSD and the Technology of Potassium Sulfate Recycling[D]. Kunming:Kunming University of Science and Technology, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10674-1012263115.htm |
| [9] |
孙敦伟, 吴晓红, 张琳. 高效液相色谱法在甘油含量测定应用中的研究[J]. 化学世界, 2007(11): 646. SUN DW, WU XH, ZHANG L. Application of HPLC method in determining content of glycerol[J]. Chem World, 2007(11): 646. DOI:10.3969/j.issn.0367-6358.2007.11.002 |
| [10] |
黎艳刚, 骆利平, 杨武亮, 等. HPLC-RID测定布洛芬口服溶液中甘油含量[J]. 中国实验方剂学杂志, 2013, 19(12): 61. LI YG, LUO LP, YANG WL, et al. Determination of glycerin in ibuprofen oral solution by HPLC-RID[J]. Chin J Exp Tradit Med Form, 2013, 19(12): 61. |
| [11] |
张书芬, 史萍萍, 王全林, 等. 液相色谱示差折光法测定蜂蜜中的果糖、葡萄糖、蔗糖和麦芽糖[J]. 食品科学, 2008, 29(6): 280. ZHANG SF, SHI PP, WANG QL, et al. Determination of fructose, glucose, sucrose and maltose in honey by liquid chromatography refractive index detector[J]. Food Sci, 2008, 29(6): 280. |
| [12] |
姚红艳. HPLC法测定"新泪然"滴眼液中的甘油含量[J]. 黑龙江科技信息, 2013(1): 87. YAO HY. Content determination of glycerol in "Xinleiran" eye drops[J]. Heilongjiang Sci Technol Inf, 2013(1): 87. |
| [13] |
李先端, 钟银燕, 顾雪竹, 等. 中药炮制辅料蜂蜜中葡萄糖、果糖、蔗糖的含量测定[J]. 中成药, 2008, 30(6): 885. LI XD, ZHONG YY, GU XZ, et al. Determination of glucose, fructose and sucrose in honey used for Chinese medicinal herbs preparation[J]. Chin Tradit Pat Med, 2008, 30(6): 885. |
| [14] |
王志斌, 陈有根, 李慧. HPLC-ELSD法测定麦冬药材及其提取物中果糖的含量[J]. 中国中医药信息杂志, 2007, 14(2): 47. WANG ZB, CHEN YG, LI H. Determination of fructose in radix ophiopogonis and extracts of radix ophiopogonis by HPLC-ELSD[J]. Chin J Inf Tradit Chin Med, 2007, 14(2): 47. |
| [15] |
张英, 石雪萍, 张卫明. HPLC-ELSD法与HPLC-RID法检测蜂蜜中糖分的比较[J]. 中国野生植物资源, 2009, 28(1): 43. ZHANG Y, SHI XP, ZHANG WM. Comparison of HPLC-ELSD and HPLC-RID methods in detecting the sugar of honey[J]. Chin Wild Plant Resour, 2009, 28(1): 43. |
 2017, Vol. 37
2017, Vol. 37 