2. 山东中医药大学, 济南 250355
2. Shandong University of Traditional Chinese Medicine, Jinan 250355, China
祛湿止痒洗剂原名妇科洗剂,为山东省立医院的院内中药制剂,由苦参、黄柏、荆芥、防风、蛇床子、白鲜皮6味中药组成,具有清热燥湿、祛风、杀虫止痒之功效,临床用于妇科外阴瘙痒和阴道炎症。为了有效地控制该制剂的质量,保证临床药效,对祛湿止痒洗剂的定性定量方法进行研究。用薄层色谱法对方中苦参、黄柏、荆芥、防风、蛇床子进行定性鉴别,同时,用高效液相色谱法对祛湿止痒洗剂中黄柏的成分黄柏碱和小檗碱进行含量测定。本方法准确易行,可作为该制剂的质量控制方法。
1 仪器与试药 1.1 仪器Waters公司高效液相色谱仪(Waters 600主控器,Waters 600 pump,Waters 2487紫外检测器,Empower工作站);Agilent公司Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶);青岛海洋化工厂硅胶H薄层板、硅胶G薄层板;赛多利斯科学仪器有限公司BS224S分析天平;昆山市超声仪器有限公司KQ-600DB型超声波清洗器(输出功率600 W,工作频率40 kHz);北京市长风仪器仪表公司电热恒温水浴锅。
1.2 试药对照品盐酸小檗碱(批号110713-201212,纯度86.7%)、盐酸黄柏碱(批号111895-201303,纯度95.8%)、槐定碱(批号110784-200804,纯度99.6%)、升麻素苷(批号111522-201310,纯度96.4%)、5-O-甲基维斯阿米醇苷(批号111523-201208,纯度96.4%)、蛇床子素(批号110822-201308,纯度100%)及对照药材荆芥(批号120911-201110)、蛇床子(批号121030-200405)均购自中国食品药品检定研究院;样品祛湿止痒洗剂(批号20151125、20151202、20151209)由山东省立医院制剂室提供;甲醇、乙腈、磷酸均为色谱纯,水为双蒸水,其他试剂均为分析纯。
2 定性分析 2.1 苦参的鉴别取样品5 mL,加三氯甲烷15 mL,浓氨试液0.3 mL,摇匀,静置过夜,分取三氯甲烷层,滤过,滤液蒸干,残渣加三氯甲烷0.5 mL使溶解,即得供试品溶液[1]202;另取槐定碱对照品适量,加甲醇制成每1 mL含0.2 mg的溶液,作为对照品溶液;按处方比例称取缺苦参的其他药材,按制备工艺制备阴性样品,同法制备缺苦参的阴性对照溶液。照薄层色谱法(中国药典2015年版四部通则0502)试验[2],吸取上述3种溶液各4 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-丙酮-甲醇-氨水(8:3:0.5:0.2)为展开剂,展开,取出,晾干,喷以碘化铋钾试液。样品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点,苦参阴性对照无干扰。见图 1。

|
1~3.样品(samples)4.槐定碱对照品(reference substance of sophoridine)5.缺苦参阴性样品(negative sample without Sophorae FlavescentisRadix) 图 1 苦参TLC图 Figure 1 TLC chromatogram of Sophorae Flavescentis Radix |
取本品20 mL,蒸干,加甲醇10 mL,超声(600 W,40 kHz)处理15 min,滤过,滤液作为供试品溶液[3];另取盐酸小檗碱对照品适量,加乙醇制成每1 mL含0.5 mg的溶液,作为对照品溶液;按处方比例称取缺黄柏的其他药材,按制备工艺制备阴性样品,同法制备缺黄柏的阴性对照溶液。照薄层色谱法(中国药典2015年版四部通则0502)试验[2],吸取供试品溶液、阴性对照溶液各2 μL,对照品溶液1 μL,分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(7:1:2)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。样品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点,黄柏阴性对照无影响。见图 2。
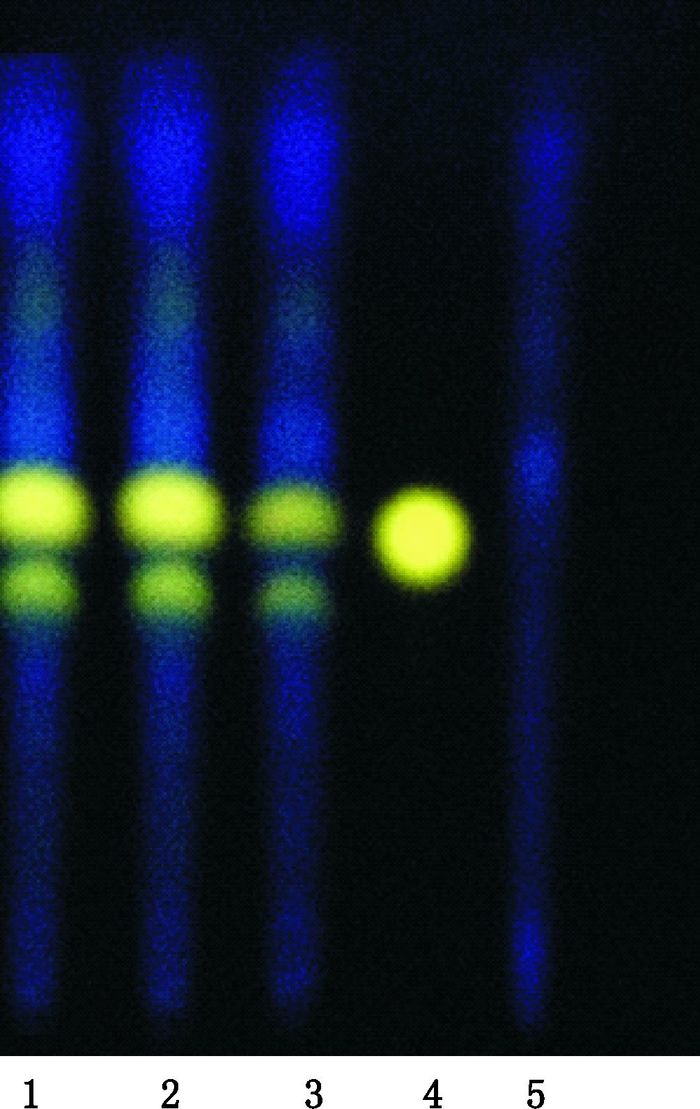
|
1~3.样品(samples)4.盐酸小檗碱对照品(reference substance of berberine hydrochloride)5.缺黄柏阴性样品(negative sample without Phellodendri Chinensis Cortex) 图 2 黄柏TLC图 Figure 2 TLC chromatogram of Phellodendri Chinensis Cortex |
取样品20 mL,加石油醚(60~90 ℃)30 mL,时时振摇,放置过夜。分取石油醚层,滤过,滤液挥至1 mL,作为供试品溶液[1]232;另取荆芥对照药材0.8 g,同法制成荆芥对照药材溶液;按处方比例称取缺荆芥的其他药材,按制备工艺制备阴性样品,同法制备缺荆芥的阴性对照溶液。照薄层色谱法(中国药典2015年版四部通则0502)试验[2],吸取上述3种溶液各10 μL,分别点于同一硅胶H薄层板上,以环己烷-乙酸乙酯(17:3)为展开剂,展开,取出,晾干,喷以5%香草醛的5%硫酸乙醇溶液,在105 ℃加热至斑点显色清晰。样品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点,荆芥阴性对照无影响。见图 3。

|
1~3.样品(samples)4.荆芥对照药材(reference crude drug of Schizonepetae Herba)5.缺荆芥阴性样品(negative sample without Schizonepetae Herba) 图 3 鉴别荆芥的TLC图 Figure 3 TLC chromatogram of Schizonepetae Herba |
取样品15 mL,置蒸发皿中蒸干后加甲醇30 mL,超声(600 W,40 kHz)30 min,滤过,滤液蒸干,残渣加水10 mL溶解,用水饱和的正丁醇萃取2次,每次15 mL,合并正丁醇液,正丁醇液蒸干,残渣加甲醇1 mL,使溶解,即得供试品溶液[4-5];按处方比例称取缺防风的其他药材,按制备工艺制备阴性样品,同法制备缺防风的阴性对照溶液;另取升麻素苷、5-O-甲基维斯阿米醇苷的对照品适量,分别加乙醇制成每1 mL含1 mg的溶液,作为对照品溶液。照薄层色谱法(中国药典2015年版四部通则0502)试验[2],吸取上述4种溶液各10 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇(4:1)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,晾干,置紫外光灯(365 nm)下检视[6]。样品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点,防风阴性对照无影响。见图 4。
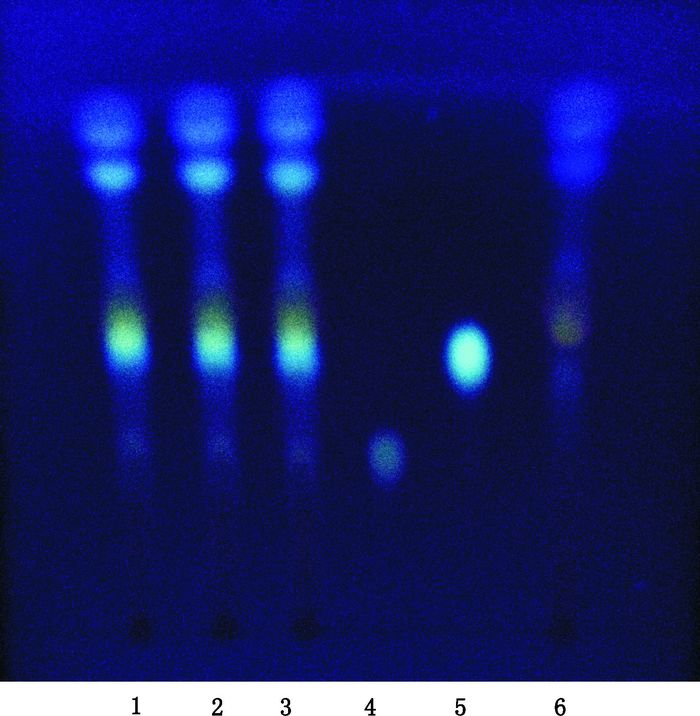
|
1~3.样品(samples)4. 5-O-甲基维斯阿米醇苷对照品(reference substance of 4’-O-beta-glucopyranosyl-5-O-methylvisamminol)5.升麻素苷对照品(reference substance of cimifugin)6.缺防风阴性样品(negative sample without Saposhnikoviae Radix) 图 4 鉴别防风的TLC图 Figure 4 TLC chromatogram of Saposhnikoviae Radix |
取样品10 mL,用乙醚萃取3次,每次20 mL,合并乙醚液,置蒸发皿中挥干,残渣加甲醇1 mL溶解,即得供试品溶液[7];按处方比例称取缺蛇床子的其他药材,按制备工艺制备阴性样品,同法制备缺蛇床子的阴性对照溶液;另取蛇床子对照药材0.3 g,加乙醇5 mL,超声(600 W,40 kHz)处理5 min,放置,取上清液作为对照药材溶液;再取蛇床子素对照品,加乙醇制成每1 mL含1 mg的对照品溶液。按照薄层色谱法(中国药典2015年版四部通则0502)试验[2],吸取上述4种溶液各10 μL,分别点于同一硅胶G薄层板上,以甲苯-乙酸乙酯-环己烷(3:3:2)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。样品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点,蛇床子阴性对照无影响。见图 5。
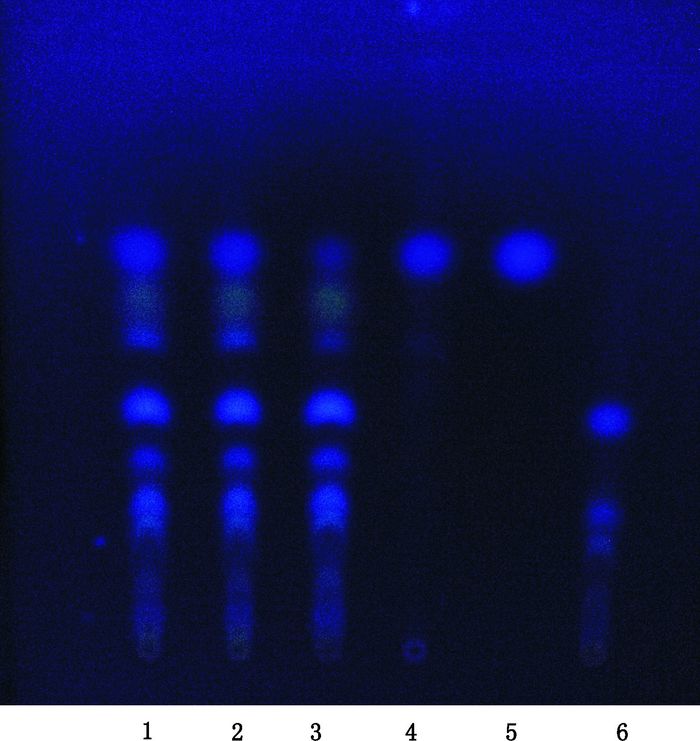
|
1~3.样品(samples)4.蛇床子对照药材(reference crude drug of Cnidii Fructus)5.蛇床子素对照品(reference substance of osthol)6.缺蛇床子阴性样品(negative sample without Cnidii Fructus) 图 5 鉴别蛇床子的TLC图 Figure 5 TLC chromatogram of Cnidii Fructus |
精密称取盐酸小檗碱对照品24.00 mg,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,得质量浓度为960 μg·mL-1的盐酸小檗碱对照品储备液;精密称取盐酸黄柏碱对照品8.25 mg,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,得质量浓度为330 μg·mL-1的盐酸黄柏碱对照品储备液。将上述盐酸黄柏碱对照品溶液与盐酸小檗碱对照品溶液混合于50 mL锥形瓶中,加甲醇稀释至刻度,摇匀,作为混合对照品溶液(含盐酸黄柏碱480 μg·mL-1,含盐酸小檗碱165 μg·mL-1),备用。
3.2 供试品溶液的制备精密量取祛湿止痒洗剂10 mL,加盐酸-甲醇[1]647,[8](1:100)25 mL,称量,60 ℃水浴回流30 min,取出,超声[9-10](600 W,40 kHz)30 min,放冷,再称量,补足减失的量,滤过,取续滤液,0.45 μm微孔滤膜过滤,即得。
3.3 阴性对照溶液的制备按祛湿止痒洗剂的制备方法制备不含黄柏的阴性样品,按照“3.2”项下方法制得阴性对照溶液。
3.4 色谱条件色谱柱:Agilent Eclipse XDB-C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱(0~12 min,12%A→20%A;12~15 min,20%A→25%A;15~28 min,25%A→35%A;28~30 min,35%A→12%A;30~40 min,12%A);检测波长:284 nm(盐酸黄柏碱,出峰时间为9 min),265 nm(盐酸小檗碱,出峰时间为34.5 min);流速:1.0 mL·min-1;柱温:30 ℃;进样量:20 μL。
3.5 方法学考察 3.5.1 专属性考察精密吸取混合对照品溶液、供试品溶液和阴性对照溶液各20 μL,分别注入高效液相色谱仪,得到色谱图,见图 6。结果显示:在样品色谱中,呈现与对照品色谱峰保留时间一致的色谱峰,且阴性对照色谱图中在待测成分保留时间处无干扰峰出现。表明本方法专属性良好。

|
1.盐酸黄柏碱(phellodendrine hydrochloride)2.盐酸小檗碱(berberine hydrochloride) A.混合对照品(mixed reference substances)B.样品(sample)C.缺黄柏阴性样品(negative sample without Phellodendri Chinensis Cortex) 图 6 祛湿止痒洗剂的HPLC色谱图 Figure 6 HPLC chromatograms of Qushizhiyang lotion |
精密吸取已配制的混合对照品溶液(盐酸黄柏碱480 μg·mL-1,盐酸小檗碱165 μg·mL-1)1、2、3、4、5 mL,加甲醇稀释制得盐酸黄柏碱的质量浓度为80、160、240、320、400 μg·mL-1,盐酸小檗碱的质量浓度为27.5、55、82.5、110、137.5 μg·mL-1的系列混合对照品溶液;取各混合对照品溶液依次进样20 μL。记录盐酸黄柏碱和盐酸小檗碱的峰面积,并分别以峰面积(A)对溶液质量浓度(C)进行回归,得盐酸黄柏碱、盐酸小檗碱回归方程:
A=7.20×103C+1.09×105 r=0.999 9
A=4.40×104C+1×106 r=0.999 8
结果表明盐酸黄柏碱质量浓度在80~480 μg·mL-1,盐酸小檗碱质量浓度在27.5~165 μg·mL-1范围内线性关系良好。
3.5.3 精密度试验精密吸取混合对照品溶液20 μL,按“3.4”项下色谱条件,连续进样6次,分别测定盐酸黄柏碱和盐酸小檗碱的峰面积。结果盐酸黄柏碱平均峰面积为3 561 463,RSD=0.85%;盐酸小檗碱平均峰面积为8 532 064,RSD=0.46%。表明仪器的精密度良好。
3.5.4 重复性试验精密吸取同一批号的样品6份,分别按“3.2”项下方法平行制备供试品溶液,按“3.4”项下色谱条件,进样测定盐酸黄柏碱和盐酸小檗碱的峰面积。结果盐酸黄柏碱的含量平均值为1.37 mg·mL-1,RSD为0.79%;盐酸小檗碱的含量平均值为0.18 mg·mL-1,RSD为0.96%。表明本法重复性良好。
3.5.5 稳定性试验精密吸取同一供试品溶液,按“3.4”项下色谱条件,分别于0、2、4、6、8、12 h进样,测定盐酸黄柏碱和盐酸小檗碱的峰面积。结果盐酸黄柏碱峰面积平均值为3 387 569,RSD为0.58%;盐酸小檗碱峰面积平均值为3 123 918,RSD为0.60%。表明供试品溶液在12 h内稳定。
3.5.6 加样回收率试验分别精密量取已知含量的祛湿止痒洗剂(含盐酸黄柏碱282.66 μg·mL-1,盐酸小檗碱48.12 μg·mL-1)9份,分别精密加入质量浓度约为80%、100%、120%的混合对照品溶液,按“3.2”项下方法制备供试溶液,按“3.4”项下色谱条件分别进样,测定峰面积,计算平均加样回收率和RSD,结果见表 1。结果表明,本法准确度好,符合要求。
|
|
表 1 加样回收率试验(n=3) Table 1 Rusult of recovery tests |
分别按“3.1”及“3.2”项下方法制备混合对照品溶液和供试品溶液;精密量取上述溶液各20 μL,分别按“3.4”项下色谱条件进样测定,记录峰面积,计算含量,结果见表 2。3批样品中盐酸小檗碱的含量均高于0.1 mg·mL-1,盐酸黄柏碱的含量均高于1.0 mg·mL-1;本品每1 mL含黄柏以盐酸小檗碱(C20H23NO4·HCl)计,不得少于0.1 mg·mL-1,以盐酸黄柏碱(C20H23NO4·HCl)计,不得少于1.0 mg·mL-1。
|
|
表 2 样品含量测定结果(mg·mL-1,n=3) Table 2 Determination Results of samples |
荆芥的薄层鉴别,由于对照药材的点迹不清晰,显色剂分别考察了5%香草醛的10%硫酸乙醇溶液、1%香草醛的10%硫酸乙醇溶液、5%香草醛的5%硫酸乙醇溶液,发现喷5%香草醛的10%硫酸乙醇溶液和1%香草醛的10%硫酸乙醇溶液后,加热过程中硅胶板颜色变深,斑点不易观察,遂减少硫酸比例,改用5%香草醛的5%硫酸乙醇溶液或5%香草醛的1%硫酸乙醇溶液,5%香草醛的1%硫酸乙醇溶液斑点颜色过浅,不易观察,5%香草醛的5%硫酸乙醇溶液斑点清晰,易于观察。
4.1.2 防风薄层鉴别方法考察防风薄层鉴别,曾参考2015年版中国药典(一部)防风项下的薄层鉴别方法,供试品溶液斑点不清,通过查阅文献,并进行方法改进,采用“2.4”项下提取方法,在365 nm下斑点清晰,分离效果较好。
4.1.3 蛇床子薄层鉴别方法考察蛇床子薄层鉴别,曾参考2015年版中国药典(一部)蛇床子项下的薄层鉴别方法,效果不好,蛇床子素为简单香豆素类化合物,遂将提取溶剂改为乙醚,紫外灯365 nm下观察,效果较好。
4.2 含量测定方法考察 4.2.1 测定波长的选择分别将盐酸黄柏碱和盐酸小檗碱在200~600 nm波长下进行紫外扫描,结果盐酸黄柏碱在284 nm下有最大吸收,盐酸小檗碱在265 nm下有最大吸收,故选择284 nm作为盐酸黄柏碱检测波长,盐酸黄柏碱出峰后,在15 min时切换至265 nm作为盐酸小檗碱的检测波长进行测定。
4.2.2 样品的处理含量测定中样品的处理,曾参考中国药典方法[1]305考察取祛湿止痒洗剂10 mL加流动相处理,但干扰峰太多;考察祛湿止痒洗剂加盐酸-甲醇(1:100)先加热回流再超声(600 W,40 kHz)处理,干扰峰减少。
4.2.3 流动相的考察流动相考察了乙腈-水、乙腈-0.1%磷酸溶液[11]、乙腈-0.1%磷酸溶液(每100 mL加入十二烷基磺酸钠0.1 g)[12-13],发现加入十二烷基磺酸钠的流动相泡沫较多,产生噪音大,加入后只是使出峰时间延后,没有更好的效果;以乙腈-0.05 mol·L-1磷酸二氢钠(pH 4.0)(48:52)为流动相[9],发现加入磷酸二氢钠后,峰形没有改变;通过调节流动相乙腈-0.1%磷酸溶液的比例使出峰时间延后[14],和其他杂质峰分离,因此本文采用乙腈-0.1%磷酸水溶液进行梯度洗脱,使盐酸小檗碱和盐酸黄柏碱得到较好的分离。
5 结论本研究对祛湿止痒洗剂中的苦参、黄柏、荆芥、防风、蛇床子进行了薄层鉴别,并建立同时测定该洗剂中盐酸黄柏碱和盐酸小檗碱含量的高效液相色谱法,方法简便易行,结果准确,可作为祛湿止痒洗剂的质量控制方法。
| [1] |
中国药典2015年版. 一部[S]. 2015: 202, 232, 647, 305. ChP 2015. Vol Ⅰ[S]. 2015:202, 232, 647, 305 |
| [2] |
中国药典2015年版. 四部[S]. 2015: 57. ChP 2015. Vol Ⅳ[S]. 2015:57 |
| [3] |
陈东鸿. 前列舒通片质控标准的研究[J]. 中国药品标准, 2010, 11(4): 268. CHEN DH. Study on quality standard of Qianlieshutong tablets[J]. Drug Stand China, 2010, 11(4): 268. |
| [4] |
刘艳霞, 潘彦荣, 徐金玲. 洁阴洗剂的薄层色谱研究[J]. 中国当代医药, 2011, 18(28): 28. LIU YX, PAN YR, XU JL. Study on the identification of TLC for Jieyin lotion[J]. China Mod Med, 2011, 18(18): 28. |
| [5] |
张秋玲, 黄志豪, 伍柏坚, 等. 消炎解毒丸质量标准的研究[J]. 广东药学院学报, 2014, 30(5): 599. ZHANG QL, HUANG ZH, WU BJ, et al. Study on the quality standard of Xiaoyan Jiedu pill[J]. J Guangdong Pharm Univ, 2014, 30(5): 599. |
| [6] |
黄兰芷, 王曙宾. 连防感冒颗粒中防风薄层鉴别方法改进[J]. 中南药学, 2007, 5(2): 149. HUANG LZ, WANG SB. Improvement in TLC identification of Radix Saposhnikoviae in Lianfang Ganmao granules[J]. Cent South Pharm, 2007, 5(2): 149. |
| [7] |
罗美兰, 廖银根, 王文, 等. 复方苦蛇黄洗剂质量标准[J]. 中国实验方剂学杂志, 2013, 19(13): 131. LUO ML, LIAO YG, WANG W, et al. Quality standard of Fukang Kushehuang lition[J]. Chin J Exp Tradit Med Form, 2013, 19(13): 131. |
| [8] |
丘振文, 钟瑜. HPLC法测定腹达康微丸中盐酸小檗碱的含量[J]. 中药新药与临床药理, 2013, 24(06): 616. QIU ZW, ZHONG Y. Determination of berberine hydrochloride in Fudakang pellets by HPLC[J]. Tradit Chin Drug Res Clin Pharmacol, 2013, 24(06): 616. |
| [9] |
郤庆, 杨骏, 李国文. HPLC法测定安心颗粒中盐酸小檗碱的含量[J]. 中国药师, 2014, 17(3): 512. XI Q, YANG J, LI GW. Quantitative determination of berberine hydrochloride in Anxin granules by HPLC[J]. China Pharm, 2014, 17(3): 512. |
| [10] |
李红玲, 莫炫永. HPLC法同时测定川黄柏中盐酸黄柏碱和盐酸小檗碱的含量[J]. 中国药房, 2014, 25(27): 2562. LI HL, MO XY. Content determination of berberine hydrochloride and hydrochloride phellodendrine in Phellodendron chinense by HPLC[J]. China Pharm, 2014, 25(27): 2562. DOI:10.6039/j.issn.1001-0408.2014.27.22 |
| [11] |
刘杰, 葛亮, 孙芸, 等. RRLC测定关黄柏中盐酸小檗碱的含量[J]. 光谱实验室, 2012, 29(2): 801. LIU J, GE L, SUN Y, et al. Determination of berberine hydrochloride in Phellodendron amurense Rupr. by RRLC[J]. Chin J Spectrosc Lab, 2012, 29(2): 801. |
| [12] |
朱志明, 赖潇潇, 苏慕霞. 不同产地黄柏及关黄柏有效成分的含量测定[J]. 临床医学工程, 2011, 18(1): 106. ZHU ZM, LAI XX, SU MX. Determinations of active components in Cortox Phellodendri Chinensis and Cortex Phellodendri Amurensis from different areas by HPLC[J]. Clin Med Eng, 2011, 18(1): 106. |
| [13] |
许月芳, 刘皈阳, 马建丽, 等. HPLC法测定黄柏青叶口服液中盐酸小檗碱的含量[J]. 实用药物与临床, 2014, 17(2): 203. XU YF, LIU GY, MA JL, et al. Determination of berberine hydrochloride in Huangbo Qingye oral solution by HPLC[J]. Pract Pharm Clin Rem, 2014, 17(02): 203. |
| [14] |
祝晨蔯, 林朝展, 莫建霞. HPLC法测定黄柏药材中小檗碱与黄柏碱的含量[J]. 中药新药与临床药理, 2004, 15(4): 262. ZHU CC, LIN CZ, MO JX. Determination of berberine and phellodendrine in Cortex Phellodendri by HPLC[J]. Tradit Chin Drug Res Clin Pharmacol, 2004, 15(4): 262. |
 2017, Vol. 37
2017, Vol. 37 
