葫芦科(Cucurbitaceae)隶属于葫芦目(Cucurbitales)[1],迄今为止,在地球上共发现约125个属,960个种[2]。葫芦科植物主要分布在热带及亚热带,在温带地区也有少数分布,它不仅具有观赏和食用价值,而且具有很好的药用价值。该科植物具有抗肿瘤、抗肝癌、抗胃癌、保肝及提高机体免疫力等多种生物活性,研究表明[3-6],其主要活性成分是一种高度氧化的葫芦素型四环三萜类化合物,其中葫芦素B和葫芦素E分布最为广泛,关注度高。葫芦科植物甜瓜蒂、南瓜蒂、栝楼、雪胆和木鳖子分布广泛,均含有丰富的葫芦素型化合物[7]。
为消除病虫、微生物等危害,中草药入药前常常需要灭菌处理,目前常用的灭菌方法有湿热灭菌、微波灭菌和60Co-γ射线灭菌等多种方式,但中药成分大多不稳定,易受温度、湿度及压力等因素影响,导致药品质量下降,从而使药效降低。60Co-γ射线灭菌方法是20世纪兴起的一种灭菌及保鲜技术[8],具有穿透力强,无损伤,经济实用等诸多优势[9],近年来在中药领域得到广泛的应用[10-12]。
60Co-γ射线灭菌能有效消除中草药中微生物危害,同时此方法也存在较多安全隐患[13],若使用不当,会降解或消除药材内在生物活性,降低药物医用价值。葫芦科植物具有很好药用价值,近年来相关研究较多,而对利用60Co-γ射线灭菌该类药物所造成生物活性的影响方面研究至今尚未见报道。
甜瓜蒂、南瓜蒂、栝楼、雪胆和木鳖子5种葫芦科植物受生长环境的影响较小,分布广泛,且葫芦素类含量丰富,有很高的药用价值。本实验拟采用60Co-γ射线对这5种葫芦科植物进行辐射灭菌处理,建立葫芦素B和E的含量测定方法,分别考察2、5、10 kGy 3种辐照剂量对葫芦素B和E含量的影响,并确定最佳有效辐照强度条件,为葫芦科植物实际生产灭菌提供参考依据。
1 仪器和材料Agilent 1260 infinity高效液相色谱仪(安捷伦公司);Agilent TC-C18(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶;安捷伦公司);辐照源为60Co-γ射线辐照设备(上海束能辐照技术有限公司);Secura5102-1CN型电子天平(赛多利斯公司);30 B型中草药粉碎机(常州市皖苏干燥设备有限公司);P70H专家型超声波清洗器(Elma公司,总功率820 W);Milli-QAcademic超纯水系统(默克密理博公司)。
对照品葫芦素B(批号111945-201301,含量96.9%,中国食品药品检定研究院),葫芦素E(批号MUST-11092803,含量≥98%,成都曼斯特生物科技有限公司);乙腈为色谱纯,水为超纯水,其余试剂均为分析纯。
甜瓜蒂(T1)、南瓜蒂(T2)、栝楼(T3)、雪胆(T4)和木鳖子(T5)均购自安徽省亳州药材市场,经鉴定,甜瓜蒂为葫芦科植物甜瓜(Cucumis melo L.)的果柄,南瓜蒂为葫芦科植物南瓜(Cucurbita moschata Duch.)的瓜蒂,栝楼为葫芦科植物栝楼(Trichosanthes kirilowii Maxim.)的果实,雪胆为葫芦科植物雪胆(Hemsleya amabilis Diels)块茎,木鳖子为葫芦科植物木鳖子(Momordica cochinchinensis(Lour.)Spreng.)的种子。世界卫生组织规定辐射灭菌物品剂量不得超过10 kGy,本研究取T1~T5号药材分别以2、5、10 kGy剂量辐照处理。
2 方法与结果 2.1 灭菌效果检查分别取经辐照处理前后药材适量,粉碎,过筛(4号筛),称取细粉10 g,置250 mL锥形瓶中,加pH 7.0无菌氯化钠-蛋白胨缓冲液100 mL,超声(250 W,40 kHz)使溶解完全,制成1:10的供试液,继续取上清液按10倍稀释法制得1:100和1:1 000的供试液。取上述制备好的供试液各l mL,置无菌平皿(直径90 mm)中,分别注入熔化的胰酪大豆胨琼脂或沙氏葡萄糖琼脂培养基(不超过45 ℃)15~20 mL,混匀,待凝固,置培养箱中按规定培养,检查辐射前后5种葫芦科药材需氧菌总数、霉菌和酵母菌总数。结果见表 1。
|
|
表 1 辐照前后样品含菌量测定结果 Table 1 Results of bacteria level in samples before and after irradiation |
精密称取葫芦素B对照品18.26 mg和葫芦素E对照品13.55 mg,置同一100 mL量瓶中,加甲醇20 mL,超声(功率600 W,频率40 kHz)溶解30 min(冰浴),用甲醇稀释至刻度,摇匀,制成每1 mL中分别含葫芦素B 0.183 mg和葫芦素E 0.136 mg的混合对照品溶液,滤过(0.22 μm微孔滤膜),取续滤液,即得。
2.2.2 供试品溶液分别取T1~T5号经不同辐射剂量处理的药材适量,粉碎过筛(4号筛),称取药材细粉2.0 g,精密称定,分别置250 mL具塞锥形瓶中,加甲醇100 mL,超声(功率600 W,频率40 kHz)溶解60 min(冰浴)后,浸渍过夜,取浸渍液适量,滤过(0.22 μm微孔滤膜),即得。
2.3 色谱条件色谱柱:Agilent TC-C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.1 %冰醋酸水溶液(B),梯度洗脱(0~8 min,10%A→20%A;8~15 min,20%A;15~25 min,20%A→30%A);流速:1.0 mL·min-1;检测波长:234 nm;柱温:30 ℃;进样量:20 μL。
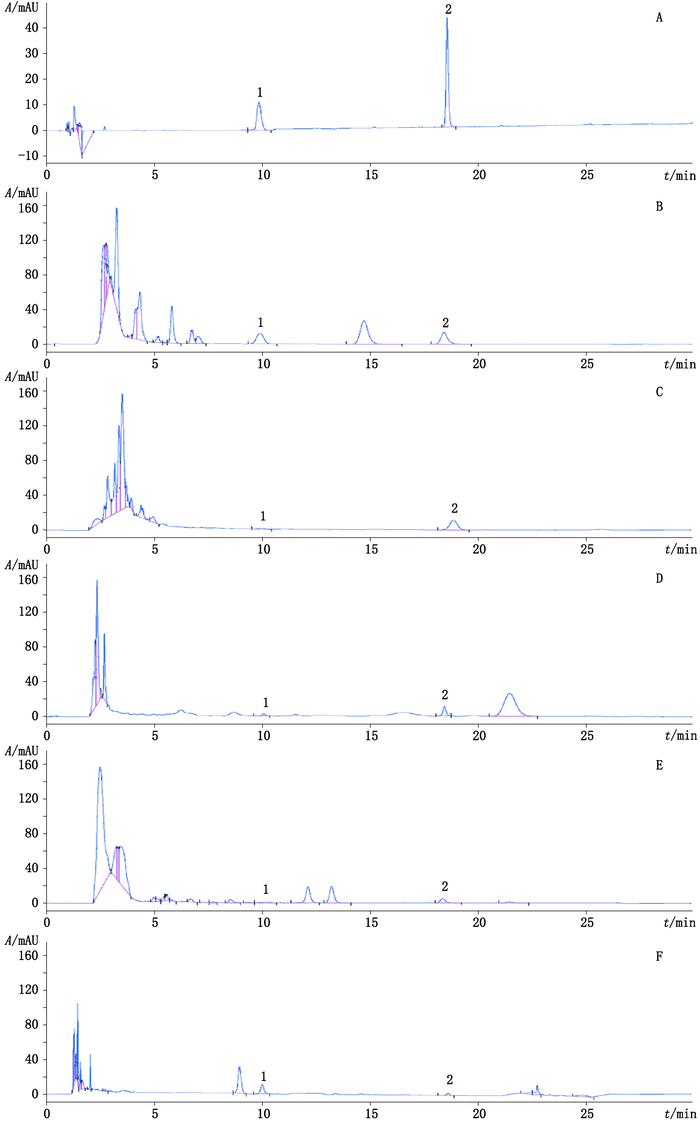
取混合对照溶液及各供试品溶液各20 μL注入液相色谱仪,测定结果见图 1,色谱峰分离完全,杂质峰对主峰无干扰,葫芦素B和E峰理论板数均计大于3 000。
|
1.葫芦素B(cucurbitacin B)2.葫芦素E(cucurbitacin E) 图 1 对照品(A)、甜瓜蒂(B)、南瓜蒂(C)、栝楼(D)、雪胆(E)及木鳖子(F)HPLC图 Figure 1 HPLC chromatograms of reference substances (A), Pedicellus melo (B), Cucurbita moschata (C), Trichosanthes kirilowii (D), Hemsleya amabilis (E)and Momordica cochinchinensis(F) |
分别精密吸取混合对照品溶液3、6、12、18、36、48 μL注入液相色谱仪,记录色谱图。以化合物峰面积的积分值(Y)对进样质量(X)进行线性回归,求各组分线性范围及相关系数。以10倍稀释法将混合对照品溶液稀释制成系列浓度溶液,分别进行测定,记录色谱图,取峰面积信噪比为10(S/N=10)时浓度为定量限(LOQ)。结果见表 2。
|
|
表 2 线性关系和定量限 Table 2 Linearity and LOQ |
取混合对照品溶液,按“2.3”项色谱条件连续进样5次,记录色谱图,测得葫芦素B和E峰面积的RSD(n=5)分别为0.12%和0.46%,表明仪器精密度良好。
2.4.3 重复性试验取T1~T5号供试品(0 kGy)各适量,粉碎,过筛(4号筛),分别按“2.2.2”项方法平行制备6份供试品溶液,按“2.3”项色谱条件进行分析,记录色谱图,以外标法计算组分含量。结果葫芦素B和E平均含量分别为8.180、6.373、3.951、4.591、2.284 mg·g-1和3.192、2.730、3.964、0.344、1.718 mg·g-1,RSD(n=6)均小于0.8%,表明方法重复性较好。
2.4.4 稳定性试验取T1~T5号药材的供试品溶液(0 kGy),分别于0、5、8、12、15、20、24 h按“2.3”项色谱条件测定,记录色谱图。结果葫芦素B和E峰面积的RSD(n=5)均小于1.1%,表明供试品溶液在24 h内稳定。
2.4.5 加样回收率试验取T1~T5号药材的供试品(0 kGy)各6份,粉碎,过筛(4号筛),精密称取药材细粉1.0 g,置250 mL具塞锥形瓶中,分别加入葫芦素B和E的对照品各适量,按“2.2.2”项方法制备供试溶液,在“2.3”项色谱条件下进行测定,记录色谱图,计算回收率,结果见表 3,表明加样回收率较好,符合含量测定要求。
|
|
表 3 加样回收试验结果(n=6) Table 3 Results of Recovery test |
取T1~T5号药材样品在不同辐射剂量下处理的药材供试品各适量,分别按“2.2.2”项方法制备供试品溶液,每种药材平行制备3份溶液,按“2.3”项色谱条件进行测定,记录色谱图,按外标法计算各组分含量,结果见表 4。经配对t检验,辐照前与辐照后(2、5和10 kGy)葫芦素E的含量差异无统计学意义(p>0.05);在2、5 kGy剂量下辐照时,辐照前后无统计学意义(p>0.05),而当剂量增加到10 kGy时,葫芦素B的含量存在显著性差异(p<0.05)。可以看出,60Co-γ射线灭菌法对葫芦素B含量有一定影响,经5、10 kGy辐照后,甜瓜蒂、南瓜蒂、栝楼、雪胆和木鳖子中葫芦素E含量分别降低14.67%、65.08%、35.16%、30.40%和43.52%;而对葫芦素E含量影响不大。
|
|
表 4 样品的测定结果(mg·g-1,n=3) Table 4 The determination results of the samples |
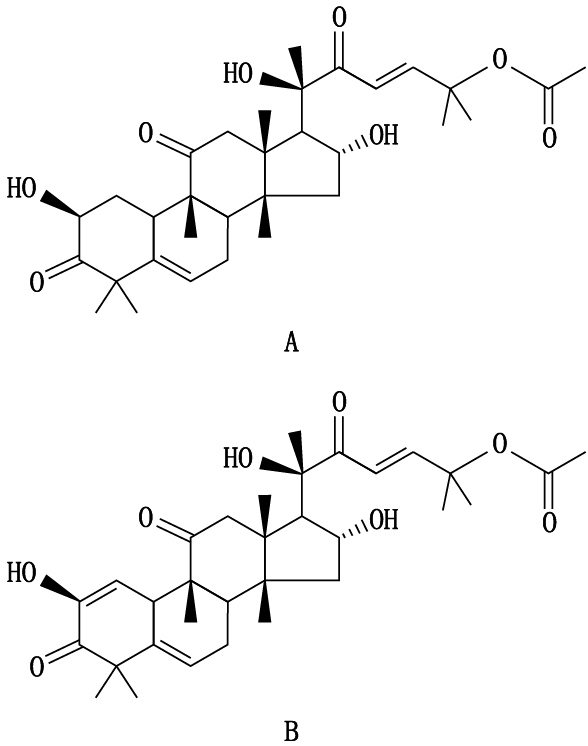
葫芦科植物在大自然中分布很广泛,甜瓜蒂、南瓜蒂、栝楼、雪胆和木鳖子是几种常见葫芦科植物,它们都含有葫芦素型四环三萜类活性成分,在体内外均具有较强抗癌、抗肿瘤、保肝、抗炎、提高机体免疫力等生物活性[14],尤其在抗癌方面的应用已成为研究的热点。葫芦素B具有α、β酮醇结构,在加热或光照情况下有自动氧化的倾向,而葫芦素E性质较稳定[15]。化学结构式见图 2。
|
图 2 葫芦素B(A)和E(B)化学结构图 Figure 2 Structures of cucurbitacins B (A)and E(B) |
葫芦素B结构不稳定性也进一步验证了实验结果,在60Co-γ射线辐照下,5种葫芦科植物中葫芦素B含量都有一定程度下降。所以为了保证药品质量,葫芦科药材应在凉暗处保存。
3.2 辐照剂量的选择从表 1可以看出,60Co-γ射线辐照可以杀死药材中绝大多数微生物,起到很好的灭菌作用,但过大剂量会降低葫芦素B含量,所有辐照剂量的选择十分关键。
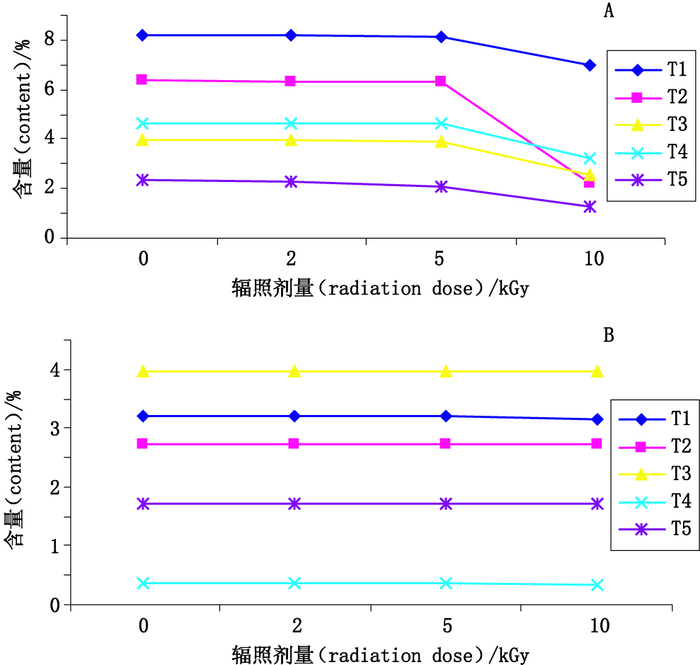
实验过程中,同时取5种葫芦科药材,分别以剂量0、2、5、10 kGy辐照处理后,按“2.2.2”项下方法制备供试品溶液,按“2.3”项色谱条件进行测定,分别计算葫芦素B和E的含量,并绘制含量随剂量变化折线图,结果见图 3。
|
A.葫芦素B(cucurbitacin B)B.葫芦素E(cucurbitacin E) 图 3 不同剂量60Co辐照对葫芦科植物中有效成分的影响 Figure 3 Contents of active ingredients in cucurbitaceous plants irradiated at different doses |
从图 3可以看出,葫芦素E折线基本为一条直线,辐照灭菌对其含量影响不明显;葫芦素B折线则在5 kGy处出现明显向下趋势,表示当剂量增加到5 kGy以上时,葫芦素B含量呈下降趋势,这也与“2.5”项下对含量数据进行的成组配对t-检验结果一致,为防止有效成分降解,影响药品质量,故建议60Co-γ射线辐照不宜高于5 kGy。
本实验采用HPLC法考察60Co-γ射线辐照对甜瓜蒂、南瓜蒂、栝楼、雪胆和木鳖子5种葫芦科植物四环三萜类有效成分的影响,发现辐照剂量控制在5 kGy时,能有效对药材消毒灭菌,同时不影响药材质量,可为今后该类药物采用60Co-γ射线辐照灭菌提供参考。
| [1] |
路安民, 陈书坤. 中国植物志.第73卷[M]. 北京: 科学出版社, 1986, 84. LU AM, CHEN SK. Flora Reipublicae Popularis Sinicae.Vol 73[M]. Beijing: Science Press, 1986, 84. |
| [2] |
幺焕开, 刘鲁, 王菊, 等. 葫芦素的研究概况[J]. 齐鲁药事, 2005, 24(12): 737. YAO HK, LIU L, WANG J, et al. General research situation of cucurbitacins[J]. Qilu PharmAff, 2005, 24(12): 737. |
| [3] |
蓝天, 刘卫国, 王晓稼. 葫芦素B抗肿瘤作用的研究进展[J]. 中华中医药学刊, 2013, 31(12): 2801. LAN T, LIU WG, WANG XJ. Research progress on anti-tumor effect of cucurbitacin B[J]. Chin Arch Tradit Chin Med, 2013, 31(12): 2801. |
| [4] |
李洪阳, 李玫, 沈志纲. 葫芦素E抗肿瘤作用的研究进展[J]. 中国执业药师, 2015, 12(11): 39. LI HY, LI M, SHEN ZG. Study progress on anti-tumor effects of cucurbitacin E[J]. China Licensed Pharm, 2015, 12(11): 39. DOI:10.3969/j.issn.1672-5433.2015.11.009 |
| [5] |
杨姣, 周雪莹, 历文, 等. 葫芦素B对肝癌细胞内阿霉素浓度的影响[J]. 实用药物与临床, 2012, 15(6): 347. YANG J, ZHOU XY, LI W, et al. Effect of cucurbitacin B on concentration of doxorubicin in hepatocellular carcino-ma cells[J]. Pract Pharm Clin Rem, 2012, 15(6): 347. |
| [6] |
张萌, 边志刚, 何平. 葫芦素B对人胃癌BGC-823细胞增殖及凋亡的影响[J]. 实用药物与临床, 2016, 19(5): 548. ZHANG M, BIAN ZG, HE P, et al. Effect of cucurbitacin B on concentration of doxorubicin in hepatocellular carcino-ma cells[J]. Pract Pharm Clin Rem, 2016, 19(5): 548. |
| [7] |
郭梦鸿, 孙玉琦, 刘影, 等. 葫芦科植物药材中葫芦素类成分的含量差异[J]. 中国医院药学杂志, 2015, 35(17): 1554. GUO MH, SUI YQ, LIU Y, et al. Contents difference of cucurbitacins in cucurbitaceae plants[J]. Chin J Hosp Pharm, 2015, 35(17): 1554. |
| [8] |
钟海洛, 董昱, 董玉宁, 等. 应用60Co-γ射线辐照保存川产道地中药材的研究[J]. 中国药学杂志, 1998, 3(9): 520. ZHONG HL, DONG Y, DONG YN, et al. Protecting the native Sichuan crude drugs from mildewing and moth-eating by 60Co-γ ray radiation[J]. Chin Pharm J, 1998, 3(9): 520. |
| [9] |
李艳萍, 曾煦欣, 张荣波, 等. 60Co辐照对抱龙丸中4种成分的影响[J]. 中成药, 2016, 38(10): 2184. LI YP, ZENG XX, ZHANG RB, et al. Effects of 60Co irradiation on four constituents in Baolong pills[J]. Chin Tradit Pat Med, 2016, 38(10): 2184. |
| [10] |
黄赵刚, 陈泳伍, 程钢, 等. 不同剂量钴-60辐照对制痂酊中儿茶素和表儿茶素含量的影响[J]. 中国药师, 2011, 14(10): 1463. HUANG ZG, CHEN YW, CHENG G, et al. Effects of different dose of 60Co irradiation on the contents of catechin and epicatechin in Zhijia Tincture[J]. China Pharm, 2011, 14(10): 1463. DOI:10.3969/j.issn.1008-049X.2011.10.021 |
| [11] |
张立雯, 林玲, 林彤, 等. 龙胆和秦艽钴60辐照前后指纹图谱变化的研究[J]. 药物分析杂志, 2015, 35(12): 2173. ZHANG LW, LIN L, LIN T, et al. Study on the HPLC fingerprints of Gentianae Radix et Rhizoma and Gentianae Macrophyllae Radix before and after irradiation by 60Co[J]. Chin J Pharm Anal, 2015, 35(12): 2173. |
| [12] |
王二兵, 赵正保, 曲婷丽. 60Co辐照灭菌对止嗽立效口服液主要成分的影响[J]. 中成药, 2013, 35(9): 2056. WANG EB, ZHAO ZB, QU TL. Influence of zhisou lixiao oral liquid with 60Co-γray irradiation on their main components[J]. Chin Tradit Pat Med, 2013, 35(9): 2056. |
| [13] |
雷曦, 申鸿. 60Co-γ射线辐照贮藏中药材对其主要成分的影响[J]. 中国药房, 2002, 13(2): 119. LEI X, SHEN H. Influence of preserving herbs with 60Co-γray irradiation on their main components[J]. China Pharm, 2002, 13(2): 119. |
| [14] |
毛艳, 贺金华, 顾政一, 等. 药西瓜中三萜类成分的LC-MS/MS分析研究[J]. 药物分析杂志, 2004, 34(7): 1192. MAO Y, HE JH, GU ZY, et al. Study on triterpene compounds in Fructus Colocynthis by LC-MS/MS[J]. Chin J Pharm Anal, 2004, 34(7): 1192. |
| [15] |
SHIMIZU N, ITOH T, SAITO M, et al. Acid-catalyled isomerization of cycloartane triterpene alchols:The formation of cucurbitane and lanostane-type isomets[J]. J Org Chem, 1984, 49(4): 709. DOI:10.1021/jo00178a030 |
 2017, Vol. 37
2017, Vol. 37 