2. 朗润医药有限公司, 上海 225300;
3. 沈阳药科大学, 沈阳 110016
2. Lonrain Meditech Co., Ltd., Shanghai 225300, China;
3. Shenyang Pharmaceutical University, Shenyang 110016, China
泼尼松(prednisone)是一种糖皮质激素类药物,此类药物可以通过与细胞浆糖皮质激素受体结合,与细胞膜糖皮质激素受体结合,与细胞膜的非特异作用以及通过影响其他信号通路而发挥抗炎作用[1],临床上常用于治疗类风湿性关节炎[2-5]。泼尼松控释片是一种择时释药制剂,与速释制剂相比,其优势在于睡前服用后,药物在清晨开始释药,对晨间关节僵硬的缓解起到更好的治疗效果。目前国内文献报道中关于血浆中泼尼松的测定多采用HPLC法[6-8],此方法灵敏度较低,样品处理方法多选择液液萃取法,其血浆用量多,操作步骤烦琐。LC-MS/MS法的灵敏度较高,但常见于泼尼松的体外定量[9]及定性[10]分析,国内未见用此方法对血浆中的泼尼松进行定量分析;国外文献报道关于生物样品中泼尼松的测定方法主要有LC-MS/MS法[11-13]和GC-MS法[14],样品处理方法多为固相萃取法[11-13],预处理方法耗时且生物样品用量较大。本试验采用沉淀蛋白法处理样品,LC-MS/MS方法测定Beagle犬血浆中泼尼松的药物浓度,并研究泼尼松控释片在犬体内的药动学行为。
1 仪器与材料API 4000三重四极杆串联质谱仪(配备Turboionspray离子源(ESI源)及Analyst 1.5.2数据采集软件,AB Sciex公司);Agilent 1290 Infinity液相色谱仪(配备G1330B脱气机,G4220A二元泵和G4226A自动进样器,Agilent公司);Venusil ASB色谱柱(2.1 mm×50 mm,3 μm;填料:十八烷基硅烷键合硅胶;Agela公司);CPA124S型电子分析天平(Sartorius公司);GL-16A型高速冷冻离心机(上海菲恰尔分析仪器有限公司);XW-80A涡旋混合器(上海青浦沪西仪器厂)。
泼尼松缓释片(规格5 mg·片-1,批号01309521,Mundipharma公司);泼尼松原料药(含量100.2%,批号K03C20120503,河南利华制药有限公司);二水合洛索洛芬钠对照品(含量100%,批号100638-200401,中国食品药品检定研究院);甲醇(色谱纯,迪马科技有限公司);醋酸铵(分析纯,天津市大茂化学试剂厂);纯净水(杭州娃哈哈集团有限公司)。
Beagle犬6只,雌雄各半,体重(10.1±0.6)kg,沈阳康平实验动物研究所提供,合格证号SCXK(辽)2014-0003。
2 方法与结果 2.1 溶液的配制系列标准溶液与质量控制(quality control,QC)工作溶液:分别精密称取2份泼尼松原料药10.0 mg于10 mL量瓶中,用甲醇溶解并定容,摇匀,配成质量浓度为1.00 g·L-1的储备液Ⅰ和Ⅱ。取储备液Ⅰ用甲醇逐级稀释成质量浓度分别为5.00、10.0、20.0、50.0、125、250 μg·L-1的系列标准溶液;取储备液Ⅱ用甲醇逐级稀释成质量浓度分别为8.00、40.0、200 μg·L-1的标准溶液,以此3个溶液及5.00 μg·L-1标准溶液作为QC工作溶液。
内标工作溶液:精密称取二水合洛索洛芬钠对照品12.3 mg(相当于洛索洛芬10 mg),用甲醇溶解并稀释成150 μg·L-1的洛索洛芬内标工作溶液。
醋酸铵溶液:称取醋酸铵3.85 g,加水使溶解成500 mL,制成浓度为100 mmol·L-1的溶液(Ⅰ),取溶液(Ⅰ)50 mL以水稀释至1,000 mL,制得5 mmol·L-1醋酸铵溶液;取溶液(Ⅰ)20 mL,以水稀释至100 mL,制得20 mmol·L-1醋酸铵溶液。
2.2 血浆样品的处理取Beagle犬血浆样品50 μL,置于1.5 mL塑料管中,依次加入内标工作溶液10 μL,20 mmol·L-1醋酸铵溶液10 μL以及甲醇100 μL,涡旋30 s后,-20 ℃冷冻15 min,-5 ℃冷冻离心(12 000 r·min-1)7 min,取10 μL上清液进行LC-MS/MS分析。
2.3 测定条件 2.3.1 色谱条件色谱柱:Venusil ASB C18(2.1mm× 50 mm,3 μm);流动相:5 mmol·L-1醋酸铵溶液(A)-甲醇(B),梯度洗脱(0~0.5 min,25%B;0.5~0.7 min,25%B→65%B;0.7~3.0 min,65%B;3.0~3.1 min,65%B→95%B;3.1~4.5 min,95%B;4.5~4.6 min,95%B→25%B;4.6~5.5 min,25%B);流速:0.2 mL·min-1;柱温:30 ℃;进样量:10 μL。
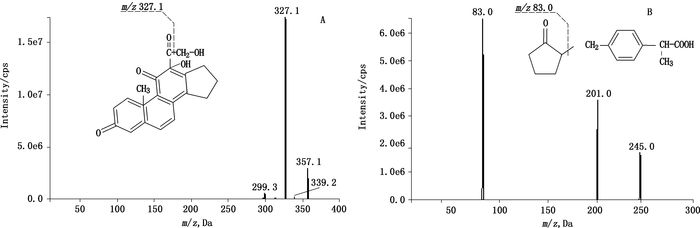
2.3.2 质谱条件离子源:ESI源;检测方式:负离子检测;扫描方式:多反应离子监测模式(MRM);源电压:-4.0 kV;Gas 1(N2):413.7 kPa;Gas 2(N2):344.8 kPa;Curtain Gas(N2):206.9 kPa;CAD Gas(N2):20.7 kPa;TEM:600 ℃;检测离子:m/z 357.1→m/z 327.1(泼尼松,待测物),m/z 245.0→m/z 83.0(洛索洛芬,内标物)。相应的二级全扫描质谱图见图 1。
|
图 1 泼尼松(A)和内标洛索洛芬(B)[M-H]-的产物离子全扫描质谱图 Figure 1 Product ion mass spectrometry of [M-H]- in prednisone(A)and loxoprofen(B, IS) |
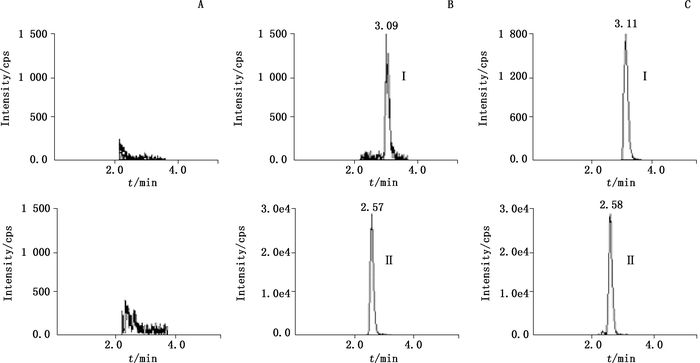
取6个不同来源的空白Beagle犬血浆50 μL,置于1.5 mL塑料管中,除以10 μL甲醇代替10 μL内标工作溶液外,其余按“2.2”项下方法操作,进行LC-MS/MS分析,获得空白血浆样品的色谱图,如图 2-A;将一定浓度的泼尼松标准溶液及洛索洛芬内标工作溶液加入到空白血浆中,按相同方法操作,得色谱图,如图 2-B,其中泼尼松的保留时间约为3.1 min,内标洛索洛芬的保留时间约为2.6 min;取犬给药后采集的血浆样品50 μL,按相同方法操作,得色谱图,如图 2-C。结果表明,空白血浆中内源性物质不干扰泼尼松及洛索洛芬的测定。
|
A.空白血浆样品(blank plasma sample)B.空白血浆添加泼尼松(1.00 μg·L-1)与洛索洛芬(30.0 μg·L-1)(blank plasma spiked with prednisone(1.00 μg·L-1)and loxoprofen(30.0 μg·L-1)C.比格犬口服给予5 mg泼尼松后13 h血浆样品(plasma sample 13 h after an oral administration of 5 mg prednisone to Beagle dogs) 图 2 Beagle犬血浆中泼尼松(Ⅰ)和洛索洛芬(Ⅱ,IS)的典型MRM色谱图 Figure 2 Typical MRM chromatograms of prednisone(Ⅰ)and loxoprofen(Ⅱ, IS)in Beagle dog plasma |
分别取质量浓度为5.00、10.0、20.0、50.0、125、250 μg·L-1的系列标准溶液10 μL,置于1.5 mL塑料管中,40 ℃空气流吹干后,加入空白犬血浆50 μL,制备相当于质量浓度为1.00、2.00、4.00、10.0、25.0和50.0 μg·L-1的标准血浆样品,其余按“2.2”项下方法操作,每一浓度进行LC-MS/MS双样本分析,获得色谱图,以泼尼松质量浓度C为横坐标,泼尼松与内标洛索洛芬的峰面积比值A为纵坐标,用加权(W=1/X2)最小二乘法进行线性回归运算,求得的直线回归方程:
A=0.039 2C + 0.006 99 r=0.998 3
泼尼松血浆质量浓度在1.00~50.0 μg·L-1范围内线性关系良好,定量下限为1.00 μg·L-1。
2.4.3 准确度与精密度试验分别取浓度为5.00、8.00、40.0、200 μg·L-1的QC工作溶液10 μL,按“2.4.2”项下方法操作,分别制备相当于质量浓度为1.00、1.60、8.00和40.0 μg·L-1的定量下限(LLOQ)样品和QC样品,每一浓度采用6样本分析,连续测定3 d,代入随行标准曲线计算LLOQ样品和QC样品的测得浓度,与配制的理论浓度对照,求得本方法的准确度(RE,%)与精密度(RSD,%),结果见表 1。
|
|
表 1 Beagle犬血浆中泼尼松的精密度与准确度(n=6) Table 1 Precision and accuracy of prednisone in Beagle dog plasma |
分别取质量浓度为8.00、40.0、200 μg·L-1的QC工作溶液10 μL,按“2.4.3”项下方法操作,制成泼尼松低、中、高3个浓度(1.60、8.00和40.0 μg·L-1)的QC样品,每一浓度采用6样本分析,获得相应的峰面积A。另取6只犬的空白血浆50 μL,除以10 μL甲醇代替10 μL内标工作溶液外,其余按“2.4.3”项下方法操作,将上清液转移至已吹干QC工作溶液10 μL和内标工作溶液10 μL的1.5 μL塑料管中,制成泼尼松低、中、高3个浓度(1.60、8.00和40.0 μg·L-1)的样品,每一浓度采用6样本分析,获得相应峰面积B。以正常提取样品所得的峰面积A与未经提取样品所得的峰面积B的均值比值计算低、中、高3个浓度下泼尼松和内标洛索洛芬的提取回收率,泼尼松的3个浓度的QC样品提取回收率分别为(85.0±2.7)%、(76.4±2.2)%、(87.5±2.5)%,RSD分别为3.2%、2.9%、2.8%;内标洛索洛芬的提取回收率为(90.6±4.7)%,RSD为5.1%。
2.4.5 基质效应试验分别取质量浓度为8.00、40.0、200 μg·L-1的QC工作溶液10 μL及内标工作溶液10 μL于1.5 μL塑料管中,于40 ℃空气流下吹干后,除以50 μL纯水代替50 μL血浆外,其余按“2.4.3”项下方法操作,制成泼尼松低、中、高3个浓度(1.60、8.00和40.0 μg·L-1)的无基质对照样品,每一浓度采用6样本分析,获得相应的峰面积C。与“2.4.3”项下所得的峰面积B比较,通过峰面积B与峰面积C的均值比值计算低、中、高3个质量浓度下泼尼松和内标洛索洛芬的基质效应。泼尼松3个浓度的QC样品基质效应分别为(87.1±6.9)%、(94.6±3.2)%、(95.9±5.8)%,RSD分别为7.9%、3.4%、6.0%;内标洛索洛芬基质效应为(105.5±12.1)%,RSD为11.5%。
2.4.6 血浆样品稳定性分别取质量浓度为8.00和200 μg·L-1的QC工作溶液10 μL于1.5 mL塑料管中,于40 ℃空气流下吹干后,加入50 μL空白血浆,制备低和高浓度(1.60和40.0 μg·L-1)的QC样品,经不同稳定性条件放置适当时间后,按“2.4.3”项下方法操作。分别考察血浆样品经沉淀蛋白处理后4 ℃放置24 h,血浆样品室温放置4 h,血浆样品-20 ℃放置14 h、血浆样品运输过程冰袋包围环境放置2 h,血浆样品-70 ℃经历7次冷冻-解冻循环,以及血浆样品-70 ℃放置31 d的稳定性,每一浓度采用3样本分析。结果表明泼尼松血浆样品在上述条件下稳定性良好,结果见表 2。
|
|
表 2 泼尼松在Beagle犬血浆中稳定性的考察(n=3) Table 2 Study on the stability of prednisone in Beagle dog plasma |
分别考察了泼尼松的储备液(1.00×106 μg·L-1)及QC工作溶液(8.00、40.0和200 μg·L-1)于室温放置4 h及-20 ℃放置26 d的稳定性,内标洛索洛芬的储备液(1.00×106 μg·L-1)及工作溶液(30 μg·L-1)于室温放置4 h及-20 ℃放置14 d的稳定性。结果表明泼尼松和洛索洛芬的储备液及工作溶液在上述条件下均稳定,结果见表 3。
|
|
表 3 泼尼松和内标洛索洛芬储备液及工作溶液稳定性的考察(n=3) Table 3 Study on the stability of prednisone and loxoprofen (IS)stock and working solutions |
Beagle犬6只(雌雄各半),餐后0.5 h口服给予泼尼松控释片1片,动物于实验期间自由饮水,进标准餐。分别于给药前(0 h)及给药后2.0、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、9.0、10、11、12、13、14和16 h经前肢正中静脉,不经麻醉每次取血0.5 mL,置肝素化离心试管中,4 000 r·min-1离心10 min,分离出血浆,于-70 ℃冰箱冷冻保存待测。
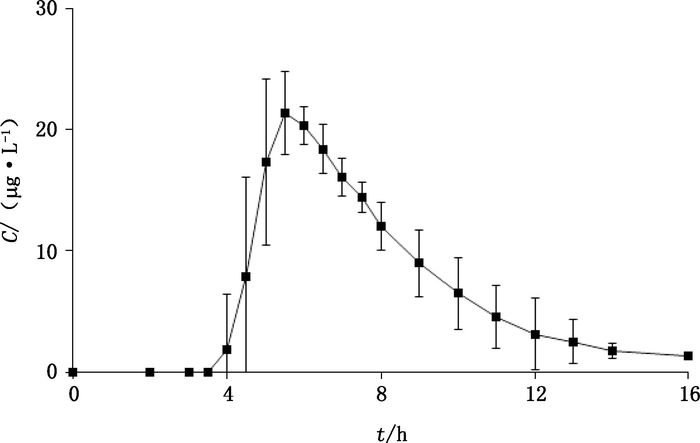
2.5.2 血浆样品的测定测定Beagle犬血浆中泼尼松的浓度时,每一分析批次建立2条标准曲线,同时分析穿插于生物样品测试中的低、中、高多样本QC样品。根据当日标准曲线求算未知样品浓度和QC样品浓度,得到泼尼松的平均血药浓度-时间曲线见图 3。
|
图 3 6只Beagle犬口服给予泼尼松缓释片后血浆中泼尼松的平均血药浓度-时间曲线(n=6) Figure 3 Mean plasma concentration-time curve of prednisone after oral administration of prednisone sustained release tablets to 6 Beagle dogs |
分别将6只受试Beagle犬口服给药后各时间点血浆中泼尼松的浓度数据输入DAS 3.2.2软件,采用梯形法计算AUC0-16和AUC0-∞,用半对数作图法由消除相的浓度点计算ke和t1/2,Tmax和Cmax采用实测值,得到泼尼松的主要药代动力学参数见表 4。
|
|
表 4 6只受试Beagle犬口服给予泼尼松缓释片后泼尼松的主要药代动力学参数(n=6) Table 4 Main pharmacokinetic parameters of prednisone after oral administration of prednisone sustained release tablets to 6 Beagle dogs |
在选择流动相时曾考察甲醇-5 mmol·L-1醋酸铵溶液等度洗脱,但血浆中的内源性物质在此条件下无法被洗脱干净,对泼尼松的测定存在明显干扰,因此需要高比例有机相对其进行洗脱,最终选择甲醇-5 mmol·L-1醋酸铵溶液梯度洗脱。
3.2 样品提取方法优化文献中报道的样品处理方法多为液液萃取法[3-5],此法血浆用量大,操作烦琐,本试验采用操作简单快速且血浆用量少的沉淀蛋白法处理血浆样品,缩短了样品处理时间。在沉淀试剂的选择时,考察了甲醇、乙腈等几种常规的有机溶剂,均有较大的基质效应,因此选择以甲醇作为沉淀试剂并在此基础上加入20 mmol·L-1醋酸胺溶液进行冷冻离心,此法有效地降低了基质效应。
3.3 药动学行为特征本试验采用的泼尼松控释片是一种择时释药片剂,其药动学研究结果显示,泼尼松在服药后约4 h开始释药,约6 h达到血药浓度峰值,具有明显的择时控释特征。
4 结论本文建立了一种简单、灵敏且高专属性的LC-MS/MS方法测定Beagle犬血浆中泼尼松的药物浓度,并成功应用于泼尼松控释片在Beagle犬体内的药代动力学研究。
| [1] |
史家欣, 李家树. 糖皮质激素抗炎作用机制的研究进展[J]. 实用医学杂志, 2014, 30(6): 983. SHI JX, LI JS. Development of anti-inflammatory mechanism of glucocorticoids[J]. J Pract Med, 2014, 30(6): 983. |
| [2] |
BUTTGEREIT F, BURMESTER G, STRAUB R, et al. Exogenous and endogenous glucocorticoids in rheumatic diseases[J]. Arthritis Rheum, 2011, 63(1): 1. |
| [3] |
胡清, 曾玉琴, 王芳, 等. 联合小剂量泼尼松治疗类风湿关节炎的临床研究[J]. 中华实用诊断与治疗杂志, 2008, 22(12): 908. HU Q, ZENG YQ, WANG F, et al. Low-dose prednisone combined with modifying antirheumatic drug in the clinical treatment of rheumatoid arthritis[J]. J Pract Diagn Ther, 2008, 22(12): 908. |
| [4] |
陈雪芳, 王佳良. IL-37在类风湿性关节炎患者体内表达的研究[J]. 中国卫生检验杂志, 2014(9): 1280. CHEN XF, WANG JL. Study on IL-37 expression in rheumatoid arthritis patients[J]. Chin J Health Lab Technol, 2014(9): 1280. |
| [5] |
庄铭城, 陈荣庆. 小剂量泼尼松联合甲氨蝶呤或来氟米特治疗类风湿关节炎的临床疗效[J]. 现代医院, 2014, 14(4): 46. ZHUANG MC, CHEN RQ. Clinincal effect of small dose prednisone associated with methotrexate or leflunomide on rheumatoid arthritis[J]. Mod Hosp, 2014, 14(4): 46. |
| [6] |
韦炳华, 唐蕾, 杨倩, 等. 丹墨胶囊对泼尼松在大鼠体内药动学的影响[J]. 中国药房, 2014, 25(27): 2497. WEI BH, TANG L, YANG Q, et al. Effects of Danmo capsule on pharmacokinetics of prednisone in rats[J]. China Pharm, 2014, 25(27): 2497. DOI:10.6039/j.issn.1001-0408.2014.27.01 |
| [7] |
王炜, 廖林川, 侯艳, 等. HPLC同时测定血液与尿液中的泼尼松和泼尼松龙[J]. 华西药学杂志, 2009, 24(3): 282. WANG W, LIAO LC, HOU Y, et al. Simultaneous determination of prednisone and prednisolone in blood and urine by HPLC[J]. West China J Pharm Sci, 2009, 24(3): 282. |
| [8] |
夏运成, 张旭光, 彭灿辉, 等. 高效液相色谱法检测肾病综合征患者泼尼松血药浓度及其临床意义[J]. 中国中西医结合肾病杂志, 2011, 12(9): 758. XIA YC, ZHANG XG, PENG CH, et al. HPLC determination of prednisone in serum of nephrotic syndrome and its clinical significance[J]. Chin J Integr Tradit West Nephrol, 2011, 12(9): 758. |
| [9] |
励炯, 沈国芳, 朱建, 等. UPLC-MS/MS法测定抗风湿中成药中非法添加8种抗风湿性化学成分[J]. 中草药, 2014, 45(18): 2647. LI J, SHEN GF, ZHU J, et al. Detection of eight antirheumatic constituents illegally added in Chinese patent medicine by UPLCMS/MS[J]. Chin Tradit Herb Drugs, 2014, 45(18): 2647. DOI:10.7501/j.issn.0253-2670.2014.18.014 |
| [10] |
刘斐, 陈长青, 郑静, 等. LC-MS/MS方法鉴定中药制剂中掺入的7种西药成分[J]. 药物分析杂志, 2009, 29(8): 1378. LIU F, CHEN CQ, ZHENG J, et al. LC-MS/MS identification of seven chemical substances added into traditional Chinese medicine[J]. Chin J Pharm Anal, 2009, 29(8): 1378. |
| [11] |
FRERICHS V, TORNATORE K. Determination of the glucocorticoids prednisone, prednisolone, dexamethasone, and cortisol in human serum using liquid chromatography coupled to tandem mass spectrometry[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2004, 802(2): 329. DOI:10.1016/j.jchromb.2003.12.015 |
| [12] |
LAVERDIÈRE I, CARON P, COUTURE F, et al. A liquid chromatographytandem mass spectrometry (LC-MS/MS)method for monitoring drug exposure in hematopoietic stem cell transplant recipients[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2012, 885-886(5): 131. |
| [13] |
RUITER A, TEENINGA N, NAUTA J, et al. Determination of unbound prednisolone, prednisone and cortisol in human serum and saliva by on-line solid-phase extraction liquid chromatography tandem mass spectrometry and potential implications for drug monitoring of prednisolone and prednisone in saliva[J]. Biomed Chromatogr, 2012, 26(7): 789. DOI:10.1002/bmc.v26.7 |
| [14] |
SHIBASAKI H, NAKAYAMA H, FURUTA T, et al. Simultaneous determination of prednisolone, prednisone, cortisol, and cortisone in plasma by GC-MS:Estimating unbound prednisolone concentration in patients with nephrotic syndrome during oral prednisolone therapy[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2008, 870(2): 164. DOI:10.1016/j.jchromb.2008.03.003 |
| [15] |
BANSA S, DESTEFANO A. Key elements of bioanalytical method validation for small molecules[J]. AAPS J, 2007, 9(1): 109. DOI:10.1208/aapsj0901011 |
 2017, Vol. 37
2017, Vol. 37 
