2. 绿叶制药集团有限公司长效和靶向制剂国家重点实验室, 烟台 264003;
3. 四川绿叶宝光药业股份有限公司, 泸州 646000
2. State Key Laboratory of Long-acting and Targeting Drug Delivery System, Lüye Pharma Group Ltd., Yantai 264003, China;
3. Sichuan Lüye Baoguang Pharma Group Ltd., Luzhou 646000, China
阿卡波糖(结构式见图 1-a)是一种从放线菌中分离得到的由4个单糖构成的寡糖,对小肠壁细胞刷状缘的α-葡萄糖苷酶具有竞争性抑制作用[1],能阻碍肠道内的多糖和低聚糖的水解,从而减少小肠对单糖的吸收,达到降低餐后血糖浓度的目的,是Ⅱ型糖尿病的常用药物之一。该药物作用机制独特,降糖疗效平稳,副作用小,且能够显著降低心血管事件的发生,市场前景十分广阔。
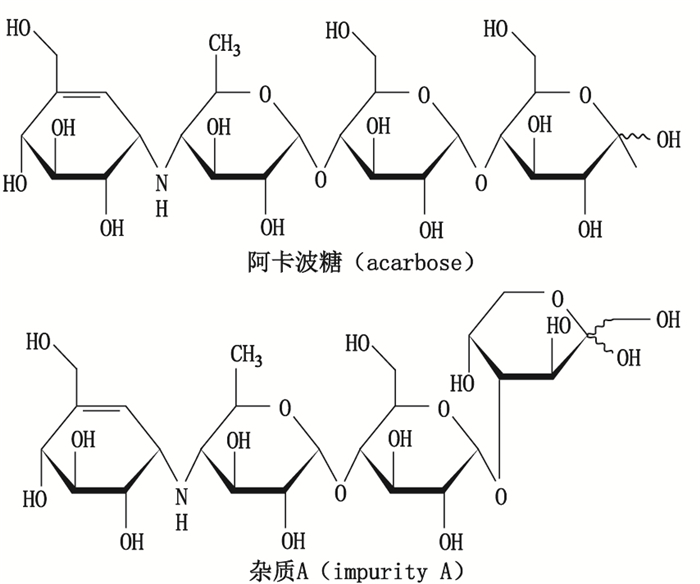
|
图 1 结构式 Figure 1 Chemical structures |
目前,阿卡波糖含量及其杂质测定的方法为高效液相色谱法,采用氨基色谱柱,35 ℃柱温,以乙腈-磷酸盐缓冲液(75:25) 为流动相,流速2 mL·min-1,检测波长210 nm,样品检测时间达40 min左右。虽然该法已经收载到了欧洲药典(8.0版)[2]和中国药典(2015年版)[3],但该方法存在的以下几种缺点严重影响了方法的重现,并造成应用困难:一是氨基色谱柱使用寿命短,使用150次左右柱效严重降低,色谱峰拖尾,不能继续使用[4];二是杂质A(O-4,6-双脱氧-4 -[[(1S,4R,5S,6S)-4,5,6-三羟基-3-(羟甲基)-2-环己烯]氨基]-α-(1→4)-O-α-D-吡喃葡糖基-(1→4)-D-葡萄糖烯-2-吡喃酮糖),发酵及降解过程中的主要杂质(结构见图 1-b)与阿卡波糖的色谱行为相似,不能完全分离[5](欧洲药典以峰谷比不小于1.2为准);三是流动相中乙腈比例大,流速快,但检测时间长,导致检测成本高。目前国内外关于阿卡波糖的研究[4-8],并未很好地解决阿卡波糖及其有关物质分离效果差,杂质干扰大及柱流失严重等问题。因此,有必要开发一种阿卡波糖含量及其杂质测定的新方法,以改善方法的重现性和可应用性,提高药品质量控制水平。
1990年,Alpert提出了亲水作用色谱(hydrophilic interaction liquid chromatography,HILIC)的概念[9]。在HILIC模式下,流动相通常为水和有机溶剂(主要为乙腈,含量>60%),固定相为亲水的极性材料。HILIC的固定相多种多样,除了传统的未衍生化硅胶和氨丙基键合硅胶外,还有氰基、二醇基、酰胺型、聚琥珀酰亚胺型、糖型和两性离子型键合硅胶[10]。HILIC的保留机理非常复杂,有关HILIC对溶质的保留机理尚无定论。Alpert[11]提出了主要由亲水作用产生的分配机理:在HILIC的模式下,当流动相进入色谱柱时,固定相表面会选择性吸附流动相中的水,在表面形成动态的“富水层”,溶质通过在“富水层”与流动相中的分配作用(主要作用),同时还存在偶极-偶极相互作用、氢键作用、离子交换作用,从而实现保留,这种观点得到很多人的支持。
HILIC适合分离强极性和亲水性样品,是寡糖分离的理想色谱模式[12-13]。氨基键合相是最早用于HILIC的极性键合固定相,该类色谱柱是经典的糖类分析柱。但氨基容易与还原性的糖形成Schiff碱,改变键合相和分析物的性质,同时氨基的柱稳定性较差,键合相容易流失[14]。本文选用XBridge Amide色谱柱,该柱使用了化学稳定的、三键键合式的酰胺官能团,其选择性与氨基柱相近,且基于BEH(亚乙基桥杂化颗粒)技术,色谱柱耐受性更强(pH 2~11),极端pH条件下最高柱温可达90 ℃,相对于氨基键合相的稳定性更高(柱流失减少),寿命更长[15]。Mark等[16]利用XBridge Amide色谱柱无需衍生成功分离了糖蛋白水解的单糖。利用示差折光或蒸发光检测器,XBridge Amide色谱柱可同时分离测定无紫外吸收的单糖和低聚糖[17-18]。与此同时,XBridge Amide色谱柱在核苷[19]、多羟基生物碱[20]、氨基酸以及多肽[21]等极性物质中都有广泛应用。
在本研究中,将酰胺键合相色谱柱应用于阿卡波糖分析,并通过正交设计试验对色谱参数中的流动相pH、盐浓度、柱温及流速进行了考察分析,建立了一种柱稳定性更高,阿卡波糖与有关物质分离效果更好的HPLC测定方法,成功解决了现有方法中存在的分离效果差,杂质干扰大及柱流失严重等问题,为阿卡波糖及其杂质的研究提供了一种新的方法。
1 仪器与试药岛津公司LC-20A高效液相色谱仪系统(包括LC-20AT泵;DGU-20A脱气机;SIL-20A自动进样器;CTO-10ASvp柱温箱;SPD-20A紫外检测器;Lab solution色谱工作站);Waters公司XBridge Amide色谱柱(4.6 mm×250 mm,3.5 μm;填料:三键键合式酰胺键合硅胶);Ohaus Corp.Brook公司AR1140万分之一电子天平;Mettler Toledo公司MS105Du型十万分之一电子天平;上海精科实业有限公司pH Meter PHS-3C电子pH计;无锡建仪实验器材有限公司SK250HP超声波清洗器。
阿卡波糖对照品(批号100808-201203,含量95.8%,中国食品药品检定研究院);阿卡波糖峰鉴别对照品[添加了杂质A,B,C,D,E,F和G的阿卡波糖对照品,每瓶20 mg,欧洲药品质量管理局(EDQM)];杂质A对照品(每瓶1 mg,TRC-Canada公司);阿卡波糖胶囊(批号140305、140308、140314,四川绿叶宝光药业股份有限公司);乙腈为色谱纯,甲酸铵、乙酸铵、甲酸、乙酸和氨水为分析纯,水为娃哈哈纯净水。
2 方法与结果 2.1 溶液的配制 2.1.1 备用缓冲盐溶液及流动相200 mmol·L-1甲酸铵缓冲盐溶液(pH 3.0):称取甲酸铵12.6 g至1 L量瓶中,加适量水溶解,加入甲酸25 mL,混匀,加水定容至刻度,即得;200 mmol·L-1乙酸铵缓冲盐溶液(pH 6.8):称取乙酸铵15.4 g至1 L量瓶中,加水溶解定容,即得;200 mmol·L-1乙酸铵缓冲盐溶液(pH 9.0):称取乙酸铵15.4 g至1 L量瓶中,加适量水溶解,加入氨水8 mL,混匀,加水定容至刻度即得。
流动相:由相应的备用缓冲盐溶液,经75%乙腈水按比例稀释而得:在750 mL乙腈和200 mL水中加入200 mmol·L-1乙酸铵缓冲盐溶液(pH 9.0)50 mL,混匀,超声(功率200 W,频率59 kHz),即得10 mmol·L-1乙酸铵缓冲盐水溶液(pH 9.0)-乙腈(25:75) 的流动相。同法,在750 mL乙腈和200 mL水中加入200 mmol·L-1甲酸铵缓冲盐溶液(pH 3.0)50 mL或200 mmol·L-1乙酸铵缓冲盐溶液(pH 6.8)50 mL,即得10 mmol·L-1甲酸铵缓冲盐水溶液(pH 3.0)-乙腈(25:75) 或10 mmol·L-1乙酸铵缓冲盐水溶液(pH 6.8)-乙腈(25:75) 的流动相。
2.1.2 阿卡波糖峰鉴别对照品溶液取阿卡波糖峰鉴别对照品1瓶(20 mg),加1 mL流动相溶解,摇匀,即得。
2.1.3 阿卡波糖对照品溶液称取阿卡波糖对照品适量,精密称定,加流动相制成质量浓度为1 mg·mL-1的溶液,摇匀,即得。
2.1.4 杂质A对照品溶液取杂质A对照品1瓶(1 mg),加1 mL流动相溶解,摇匀,即得。
2.1.5 杂质A与阿卡波糖对照品混合液取杂质A对照品溶液100 μL与阿卡波糖对照品溶液900 μL,混匀,即得。
2.1.6 阿卡波糖供试品溶液称取阿卡波糖胶囊内容物适量,精密称定,约相当于阿卡波糖25 mg,置于25 mL量瓶中,加流动相适量超声(功率200 W,频率59 kHz)溶解,加流动相定容至刻度,摇匀,过滤,取续滤液作为供试品溶液。
2.2 色谱条件采用Waters XBridge Amide色谱柱(4.6 mm×250 mm,3.5 μm),以10 mmol·L-1乙酸铵缓冲盐水溶液(pH 9.0)-乙腈(25:75) 为流动相,流速1.2 mL·min-1,柱温65 ℃,检测波长210 nm,进样量20 μL。
2.3 正交设计试验 2.3.1 正交试验因素水平的选取与实验设计通过前期实验的摸索,综合考虑阿卡波糖的保留时间及其杂质的分离情况,流动相中10 mmol·L-1乙酸铵缓冲盐水溶液(pH 9.0)-乙腈的比例确定为25:75。为确立最终色谱条件,采用4因素3水平正交设计(L9(34)正交表,见表 1),对以下4因素进行考察:
|
|
表 1 正交试验的因素及水平 Table 1 Factors and levels of orthogonal test |
因素A:流动相的pH。考察酸性、中性和碱性条件对阿卡波糖峰形及保留的影响,故设定以下pH水平:3.0、6.8、9.0。
因素B:柱温。预实验中35 ℃条件下阿卡波糖存在双峰现象,据文献[13]所述,糖类α,β异构体间的转化率随温度而变,提高温度可使分裂峰合并为单峰。故考察柱温的水平:45、55、65 ℃。
因素C:流动相中的盐浓度。为得到良好的峰形和保留作用,在流动相中添加缓冲盐,结合所用色谱柱,优选乙酸铵。考察盐浓度水平:5、10、20 mmol·L-1。
因素D:流速。流速不仅影响着保留时间,也与化合物间的分离情况有关。设定以下流速水平:1.0、1.2、1.4 mL·min-1。
每个试验条件下进样顺序:(1) 空白(流动相);(2) 杂质A与阿卡波糖对照品混合液;(3) 阿卡波糖峰鉴别标准品溶液。
组配了3个指标做优劣判断:① 可分离的杂质个数(N);② 阿卡波糖色谱峰的拖尾因子(T);③ 杂质A与主峰的分离度(R)。
2.3.2 正交试验结果分析正交试验方案设计及结果如表 2所示。
|
|
表 2 正交试验方案及结果 Table 2 Orthogonal test design and results |
对于多指标正交试验结果数据的分析,常用的方法有“综合评分法”和“综合平衡法”。根据文献[22]所述,只要评价试验指标的原则不变,不会因为使用不同的分析方法而改变较优方案的选择,特别是对于主要因素的水平选择,故本文中选择综合平衡法进行分析。综合平衡法是对所测得的各项指标,先分别按单指标极差分析,找出其因素水平的最优组合,然后根据各项指标重要性及各项指标中所得出的因素主次、水平优劣等进行综合平衡,最后确定整体最优因素水平组合。按照主峰拖尾因子越接近1.0越好、杂质个数越多越好、杂质A与主峰分离度越大越好的原则,对它们分别按单指标进行极差分析,计算结果见表 3。
|
|
表 3 综合平衡法各因素极差分析结果 Table 3 Results of factors range analysis by comprehensive balance |
对于不同指标而言,因素主次、水平优劣差异较大,确定整体最优因素水平,有一定难度,因此本试验综合各指标的优方案筛选出可能的整体较优组合,通过再次试验,确定最优组合。其中因素A选定水平3;因素B可选水平2或3;因素C在3项指标中影响均较小,选定水平2;因素D可选水平1或2。故综合平衡因素水平初步确定的较优组合为A3B3C2D1、A3B2C2D1、A3B3C2D2或A3B2C2D2。
为了确定最优组合,对4种可能的组合进行再次试验,结果见表 4。4种条件下,主峰均有良好的对称性,从杂质A与主峰分离度来看,A3B3C2D1、A3B3C2D2优于A3B2C2D1、A3B2C2D2,而A3B3C2D2的保留时间(结果未列出)要比A3B3C2D1的更短一些,所以选定的最优组合为A3B3C2D2。故最终确定的色谱条件参数:流动相pH 9.0,柱温65 ℃,盐浓度为10 mmol·L-1,流速1.2 mL·min-1。
|
|
表 4 组合筛选再试验结果 Table 4 Results of combination screening retest |
在优化选择的色谱条件下,阿卡波糖与杂质A在XBridge Amide色谱柱上可完全分离(图 2),分离度为2.175,阿卡波糖的保留时间约为19.1 min,杂质A的相对主峰的保留时间约为0.9。图 3为在本文色谱条件下得到的阿卡波糖峰鉴别对照品色谱图,与欧洲药品质量管理局提供的色谱图(图 4)比较可知,采用本法测定,在杂质A与主峰间可多检测出一种未知杂质。通过杂质A的相对保留时间定位,可知图 3中的4号峰为杂质A峰,其他杂质出峰顺序与图 4类似,推测峰2、3、6、7、8、9分别为杂质D、B、C、E、F、G,因未获得相关杂质对照品,故未做实验验证。综上所述,该方法不仅进一步改善了阿卡波糖与各杂质的分离情况,尤其是与杂质A的分离,还可多分离出1种未知杂质。
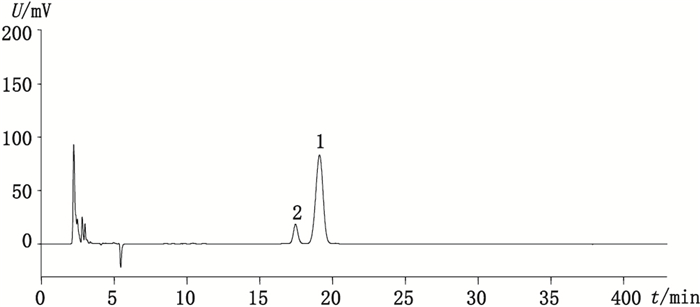
|
1.阿卡波糖(acarbose) 2.杂质A(impurity A) 图 2 杂质A与阿卡波糖对照品混合液色谱图 Figure 2 Chromatogram of mixed solution of impurity A and acarbose |
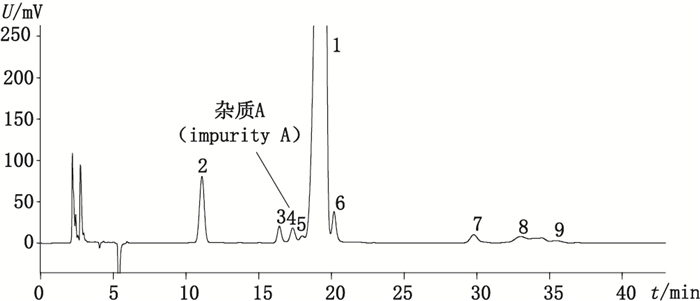
|
1.阿卡波糖(acarbose) 2~9.杂质(impurities) 图 3 阿卡波糖峰鉴别对照品色谱图 Figure 3 Chromatogram of acarbose reference substance for peak identification |
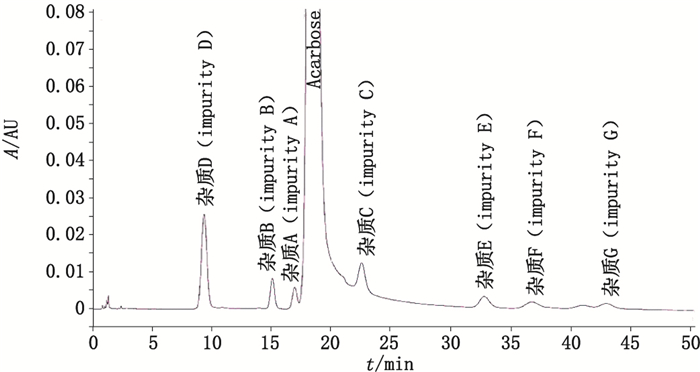
|
图 4 EDQM提供的阿卡波糖峰鉴别对照品色谱图 Figure 4 Chromatogram of acarbose reference substance for peak identification provided by EDQM |
精密吸取阿卡波糖峰鉴别对照品溶液,按“2.2”项下条件进样分析,结果见图 3。理论塔板数以阿卡波糖峰计算不小于5 000,阿卡波糖峰与杂质A峰分离度大于1.5,其他杂质分离情况良好,主峰对称性良好。
2.5.2 线性关系考察精密称取阿卡波糖对照品适量,加流动相溶解,制成4 mg·mL-1的阿卡波糖对照品储备液。精密量取储备液0.5、1.0、1.5、2.0、2.5、3.0 mL,分别置于10 mL量瓶中,加流动相制成不同浓度的系列对照品溶液。按上述色谱条件分别进样分析,记录色谱图。结果表明阿卡波糖质量浓度(C)在0.2~1.2 mg·mL-1范围内,与色谱峰面积(A)呈良好的线性关系,回归方程:
| $ \mathit{A}\rm{=3}\rm{.00}\times \rm{1}{{\rm{0}}^{\rm{6}}}\mathit{C}\rm{-4}\rm{.02}\times \rm{1}{{\rm{0}}^{\rm{3}}}\ \ \ \mathit{r}\rm{=0}\rm{.999}\ \rm{8} $ |
将“2.5.2”项下浓度最低点的阿卡波糖对照品溶液逐级稀释,依次进样测定。以信噪比(S/N=3) 测定阿卡波糖检测限为0.08 μg。
2.5.4 精密度试验取“2.5.2”项下的阿卡波糖对照品溶液,按上述色谱条件连续进样6次,进行精密度试验。计算阿卡波糖峰面积的RSD(n=6) 为0.15%,结果表明仪器的精密度均良好。
2.5.5 重复性试验取同一批胶囊样品(批号140314),按“2.1.6”项下方法配制供试品溶液6份,按上述色谱条件进样,进行重复性试验。结果阿卡波糖含量平均值(n=6) 为98.60%,RSD为0.98%,表明重复性良好。
2.5.6 溶液稳定性试验精密量取阿卡波糖供试品溶液,室温下放置,分别于0、2、4、6、8、10、24 h进样测定,结果阿卡波糖峰面积的RSD为0.29%,表明供试品溶液至少在24 h内稳定。
2.5.7 色谱柱稳定性采用XBridge Amide色谱柱(4.6 mm×250 mm,3.5 μm),在进样第1、100、200及300针后,色谱峰的拖尾因子(T)、杂质A与主峰分离度(R)和主峰理论塔板数(n)见表 5,表明虽然本实验色谱条件使用了缓冲盐体系,以及较高的流动相pH和柱温,但该色谱柱依然展示了良好的柱稳定性。
|
|
表 5 色谱柱稳定性结果 Table 5 Results of column stability |
取“2.1.6”项下已测知阿卡波糖准确含量的胶囊样品(批号140314)9份,再分别精密加入相当于阿卡波糖含量80%、100%、120%的对照品溶液,分别制备得到低、中、高3个浓度的供试溶液,按“2.2”项下色谱条件进样测定,计算加样回收率,结果见表 6。
|
|
表 6 加样回收率结果 Table 6 Results of sample recovery |
为了研究液相色谱条件的微小变化对实验结果的影响程度,进行耐用性试验。考察因素有流动相的比例、pH及柱温、流速。将阿卡波糖供试品溶液与对照品溶液,分别在不同条件下注入液相色谱仪,按外标法计算阿卡波糖为标示量的百分百含量,结果见表 7。
|
|
表 7 耐用性试验结果 Table 7 Results of durability test |
取3个批次阿卡波糖胶囊,按“2.1.6”与“2.1.3”项下方法制备供试品溶液与对照品溶液,进样分析,记录色谱图。按外标法计算阿卡波糖含量,结果见表 8。
|
|
表 8 阿卡波糖样品含量测定结果(n=3) Table 8 Determination results of acarbose content |
本文利用HILIC,采用XBridge Amide色谱柱,并借助正交试验对色谱参数中的流动相pH、盐浓度以及柱温和流速进行了考察分析,建立了一种阿卡波糖及其杂质分离研究的新方法,并通过了方法学验证。结果证明该法可将阿卡波糖与杂质A完全分离,而且XBridge Amide色谱柱采用了BEH(亚乙基桥杂化颗粒)技术,填料为酰胺三键键合相,与氨基柱相比固定相更稳定,不易产生柱流失,进样300多针,依然保持良好的峰形,较高的分离度及理论塔板数。
综上所述,本文建立的方法重复性好,结果准确,选用的色谱柱耐用性强,克服了阿卡波糖与相关杂质难分离的难题,解决了现有方法中存在的分离效果差、杂质干扰大及柱流失严重等问题,为阿卡波糖及其杂质的研究提供了一种全新的方法。
| [1] |
王霜, 顾明春. Meta分析法对拜糖平降糖作用有效性的评价[J]. 实用医药杂志, 2003, 20(2): 96. WANG S, GU MC. Meta-analysis of acarbose in blood glucose control[J]. Pract J Med Pharm, 2003, 20(2): 96. |
| [2] |
EP 8. 0[S]. 2014:1462
|
| [3] |
中国药典2015版. 二部[S]. 2015: 538 ChP 2015. Vol Ⅱ[S]. 2015:538 |
| [4] |
谢丽华, 陈乔, 李英然. HPLC测定阿卡波糖的含量[J]. 河北化工, 2011, 34(4): 34. XIE LH, CHEN Q, LI YR. Assay of acarbose tested by HPLC[J]. Hebei Chem Ind, 2011, 34(4): 34. |
| [5] |
邓晓辉. HPLC法测定阿卡波糖原料药的含量[J]. 安徽医药, 2005, 9(7): 509. DENG XH. Determination of acarbose by HPLC[J]. Anhui Med Pharm J, 2005, 9(7): 509. |
| [6] |
孙敏, 王欣荣. HPLC-ELSD法测定阿卡波糖发酵液中麦芽糖、葡萄糖和阿卡波糖的含量[J]. 中国抗生素杂志, 2011, 36(10): 772. SUN M, WANG XR. Determination of maltose, glucose and acarbose in acarbose fermentation broth by HPLC-ELSD[J]. Chin J Antibiot, 2011, 36(10): 772. |
| [7] |
刘海燕, 陈华, 赵莲, 等. RID-HPLC法测定阿卡波糖原料药含量[J]. 河北农业大学学报, 2007, 30(1): 97. LIU HY, CHEN H, ZHAO L, et al. Determination of acarbose by RID-HPLC[J]. J Agric Univ Hebei, 2007, 30(1): 97. |
| [8] |
LACHMANN B, NOE CR. Determination of acarbose by capillary zone electrophoresis[J]. Pharmazie, 2013, 68(7): 531. |
| [9] |
ALPERT AJ. Hydrophilic-interaction chromatography for the separation of peptides, nucleic acids and other polar compounds[J]. J Chromatogr A, 1990, 499(19): 177. |
| [10] |
沈爱金, 郭志谋, 梁鑫淼. 亲水作用色谱固定相的发展及应用[J]. 化学进展, 2014, 26(1): 10. SHEN AJ, GUO ZM, LIANG XM. Development and application of hydrophilic interaction liquid chromatographic stationary phases[J]. Prog Chem, 2014, 26(1): 10. |
| [11] |
金小青, 姚立新, 薛昆鹏. 亲水作用色谱的发展概述[J]. 化工管理, 2014(27): 70. JIN XQ, YAO LX, XUE KP. Development of hydrophilic interaction chromatography[J]. Chem Enterprise Manage, 2014(27): 70. DOI:10.3969/j.issn.1008-4800.2014.27.057 |
| [12] |
梁鑫淼. 基于亲水作用色谱的寡糖色谱分离新进展[J]. 色谱, 2011, 29(3): 191. LIANG XM. The advances in chromatographic separation of oligosaccharides based on hydrophilic interaction chromatography[J]. Chin J Chromatogr, 2011, 29(3): 191. |
| [13] |
BUSZEWSKI B, NOGA S. Hydrophilic interaction liquid chromatography(HILIC)-a powerful separation technique[J]. Anal Bioanal Chem, 2012, 402(1): 231. DOI:10.1007/s00216-011-5308-5 |
| [14] |
陈华. Xbridge Amide色谱柱测定果糖注射液中果糖含量[J]. 药物生物技术, 2012, 19(6): 525. CHEN H. Xbridge Amide used for determination of fructose in fructose injection[J]. Pharm Biotechnol, 2012, 19(6): 525. |
| [15] |
LOWENTHAL MS, KILPATRICK EL, PHINNEY KW. Separation of monosaccharides hydrolyzed from glycoproteins without the need for derivatization[J]. Anal Bioanal Chem, 2015, 407(18): 5453. DOI:10.1007/s00216-015-8717-z |
| [16] |
黄蕊, 吴光斌, 陈发河. 高效液相色谱法测定水果中常见的4种糖和糖醇[J]. 集美大学学报, 2014, 19(3): 179. HUANG R, WU GB, CHEN FH. Measurement of four common sugars and sugar alcohol in fruits by high performance liquid chromatography[J]. J Jimei Univ, 2014, 19(3): 179. |
| [17] |
张洁, 翟志雷, 张伟, 等. HPLC法同时测定维生素C咀嚼片中维生素C和糖的含量[J]. 中国卫生检验杂志, 2015, 25(10): 1534. ZHANG J, ZHAI ZL, ZHANG W, et al. Simultaneous determination of vitamin C and sugar in chewable vitamin C by HPLC[J]. Chin J Health Lab Technol, 2015, 25(10): 1534. |
| [18] |
VIVAS MM, GONZALO ER, GOMEZ DG, et al. Hydrophilic interaction chromatography coupled to tandem mass spectrometry in the presence of hydrophilic ion-pairing reagents for the separation of nucleosides and nucleotide mono-, di-and triphosphates[J]. J Chromatogr A, 2015, 1414: 129. DOI:10.1016/j.chroma.2015.08.040 |
| [19] |
YANG S, WANG BL, XIA XJ, et al. Simultaneous quantification of three active alkaloids from atraditional Chinese medicine Ramulus Mori(Sangzhi)in rat plasmausing liquid chromatography-tandem mass spectrometry[J]. J Pharm Biomed Anal, 2015, 109: 177. DOI:10.1016/j.jpba.2015.02.019 |
| [20] |
CAO ZY, SUN LH, MOU RX, et al. A novel method of the simultaneous analysis of seven biothiols inrice(Oryza sativa L.)using hydrophilic interaction chromatography coupled with electrospray tandem mass spectrometry[J]. J Chromatogr B, 2015, 976-977: 19. DOI:10.1016/j.jchromb.2014.11.007 |
| [21] |
HAO ZG, XIAO BM, WENG ND. Impact of column temperature and mobile phase components on selectivity of hydrophilic interaction chromatography(HILIC)[J]. J Sep Sci, 2008, 31(9): 1449. DOI:10.1002/(ISSN)1615-9314 |
| [22] |
苑玉凤. 多指标正交试验分析[J]. 湖北汽车工业学院学报, 2005, 19(4): 53. YUAN YF. Analysis of multi-target orthogonal experiment[J]. J Hubei Automot Ind Inst, 2005, 19(4): 53. |
 2017, Vol. 37
2017, Vol. 37 
