2. 江苏省食品药品监督检验研究院, 南京 210008;
3. 中国药科大学药物化学教研室, 南京 210009;
4. 常州制药厂有限公司, 常州 213018;
5. 中国医药城公共平台服务中心, 泰州 225300
2. Jiangsu Institute for Food and Drug Control, Nanjing 210008, China;
3. Department of Medicinal Chemistry, China Pharmaceutical University, Nanjing 210009, China;
4. Changzhou Pharmaceutical Factory, Changzhou 213018, China;
5. China Medical City Public Services Platform, Taizhou 225300, China
盐酸多西环素(doxycycline hyclate)为四环素类抗生素,含有并四苯基本骨架[1],主要用于敏感细菌所致的呼吸系统感染、泌尿系统感染、生殖系统感染、胆道感染等[2-4]。自盐酸多西环素作为次选药物对治疗作为生物恐怖性疾病[5]病原体之一的炭疽杆菌有疗效后,其质量的深入研究随之得到重视。
药品杂质研究与药品质量息息相关,尤其需要重视对含量超过0.1%[6]的杂质的定性与定量研究。文献[7]应用二维液相-离子阱-飞行时间质谱法(2D-LC-IT-TOF)推测中国药典(ChP)[8]中盐酸多西环素片主峰后相邻峰为EP 8.0[9]中杂质F(2-乙酰-2-脱氨甲酰多西环素),但该研究仅从质谱层面对其进行推定,并没有得到确证,因此有必要对其进行进一步的研究。目前,ChP采用主成分自身对照法对盐酸多西环素有关物质进行杂质控制,但孔英梅等[10]指出,主成分自身对照法或面积归一化法未提供所检测的杂质在设置的检出波长处的响应因子,而不同杂质的响应因子有可能不同,且差别较大,致使虽有定性和定量结果,但可靠性较差,因此有关物质定性、定量的最佳方法是采用已知对照品的方法。且调研发现,目前并无杂质F对照品出售。随着药物现代化以及生物化工的迅速发展,制备液相色谱作为一种快速高效的制备分离技术受到医药、生物化工等各个科研和工业领域的重视,应用越来越广泛,成为一种必不可少的分离分析手段[11],目前已应用于氯吡格雷[12]、氟康唑[13]、头孢地尼[14]等杂质分离纯化。因此本文拟采用制备液相色谱法分离制备杂质F,并运用紫外光谱、红外光谱、质谱及核磁共振等多种手段对其进行结构确证,且采用杂质添加和保留时间比对的方法进一步确证制备所得杂质为中国药典2010年版(ChP 2010)中多西环素“后相邻峰”,同时应用高效液相色谱法测定该杂质的相对校正因子,为杂质F的定性与定量研究提供参考。
1 仪器与试药LC-20AP制备型全自动高效液相色谱仪、HPLC色谱仪、LCMS-IT-TOF/MS质谱仪、UV-2550紫外分光光度计(日本岛津公司);Synergi Hydro-RP C18(50 mm×250 mm,10 μm;菲罗门公司)色谱柱;Nicolet 5700型傅里叶变换红外光谱仪(Thermo公司);Bruker AVANCE-400核磁共振仪(Bruker公司)。
供分离纯化用样品[来源于常州制药有限公司,将多西环素成盐母液(成分含乙醇、水、盐酸)减压浓缩,浓缩过程控温55~60 ℃,浓缩干后得含2-乙酰-6-脱碳酰胺多西环素的粗品,含杂质F(2-乙酰-2-脱氨甲酰多西环素)约8%~10%];乙腈、三氟乙酸为色谱纯;醋酸铵、EDTA二钠、三乙胺均为分析纯;Millipore纯化水(Millipore公司)。
2 实验方法与结果 2.1 盐酸多西环素杂质F的制备 2.1.1 制备液相色谱条件色谱柱:Synergi C18(50 mm×250 mm,10 μm);流动相:含0.1%三氟乙酸的水(A)-含0.1%三氟乙酸的乙腈(B),梯度洗脱(0.0 min/15%B;40.0 min/40%B;40.5 min/15%B;50.0 min/15%B);流速:80 mL·min-1;柱温:室温;检测波长:254 nm;进样体积:5 mL。
2.1.2 制备样品溶液取供分离纯化用样品适量,用乙腈-二甲亚砜(2:1)溶解并稀释制成约100 mg·mL-1的溶液,即得。
2.1.3 制备杂质精密量取制备样品溶液5 mL注入LC-20AP制备型全自动高效液相色谱仪,按“2.1.1”项条件进行梯度洗脱,采用自动馏分收集器收集25 min后的组分(见图 1),然后在35 ℃旋转蒸发去除有机溶剂,最后采用冷冻干燥法除去水分,即得。
|
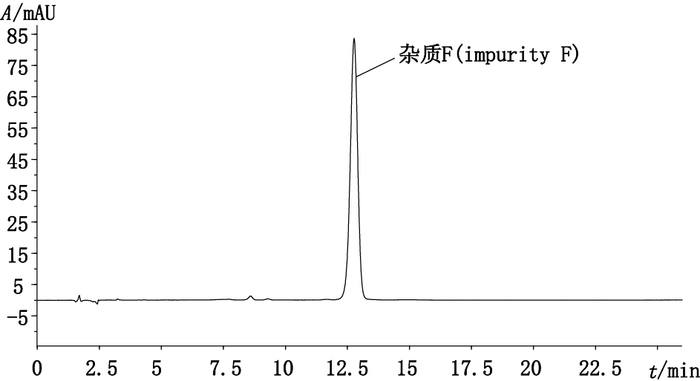
图 1 制备获得杂质纯度测定的色谱图 Figure 1 Chromatogram of prepared impurity |
按盐酸多西环素ChP 2010方法[8]测定,采用面积归一化法计算制备获得杂质的纯度为98.7%(见图 1)。色谱柱:Sapphire C18(250 mm×4.6 mm,5 μm);柱温:35 ℃;流动相:醋酸盐缓冲液[0.25mol·L-1醋酸铵-0.1 mol·L-1乙二胺四乙酸二钠-三乙胺(100:10:1),用冰醋酸或氨水调节pH至8.8]-乙腈(85:15);检测波长:280 nm。
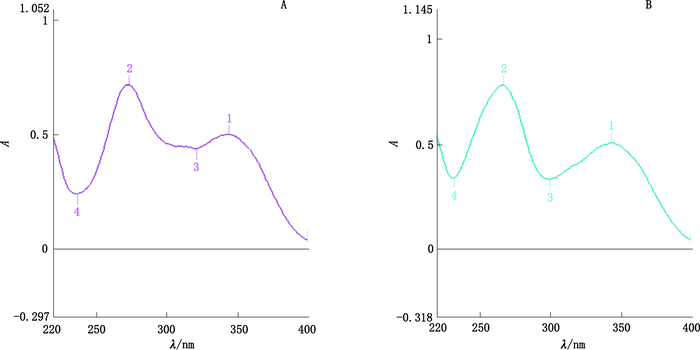
2.3 制备获得杂质的结构确证 2.3.1 紫外吸收光谱制备获得杂质与多西环素紫外吸收光谱(见图 2)。两者图谱对比发现:制备获得杂质与多西环素紫外吸收光谱趋势基本相同,可见制备获得杂质与多西环素有相似的共轭结构。
|
图 2 制备获得杂质(a)与多西环素(b)的紫外吸收光谱图 Figure 2 Ultraviolet spectra of the impurity(a)and doxycycline(b) |
采用KBr压片方式测得制备获得杂质有νO-H(3384 cm-1)、νC-H(2 930 cm-1、2 880 cm-1)、νC=O(1 678 cm-1)、不饱和苯环骨架振动(1 618 cm-1、1 583 cm-1、1 458 cm-1)、δO-H(1 386 cm-1)、νC-C(1 244 cm-1)、νC-N(1 202 cm-1、1 170 cm-1)、νC-O(1 132 cm-1)、δC-H(1 000~900 cm-1)、γC-H(838 cm-1)、γC-H(800 cm-1)、γC=C(721 cm-1)、γO-H(664 cm-1、619 cm-1)和苯环骨架变形振动(546 cm-1、520 cm-1)等特征吸收峰,表明化合物结构中含有不饱和苯环、叔胺、芳香酮、酚、烯酮、烯醇、饱和醇和三取代苯等结构。
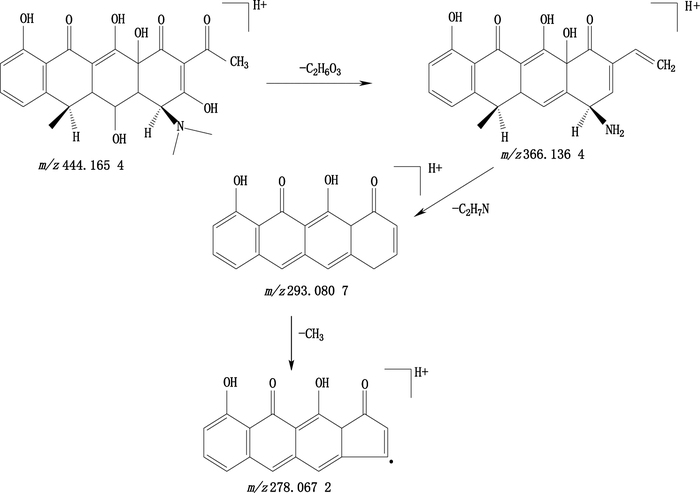
2.3.3 质谱制备获得杂质的[M+H]+为m/z 444.165 4,MS3、MS4、MS5前体离子为m/z 366.136 4、293.080 7、278.067 2。采用氢碳比、氮规则及多级质谱信息,预测分子式为C23H25NO8,推断其可能的质谱裂解途径(见图 3)与杂质F的分子结构相符。
|
图 3 制备获得杂质可能的质谱裂解途径 Figure 3 The plausible fragmentation pathways of the impurity |
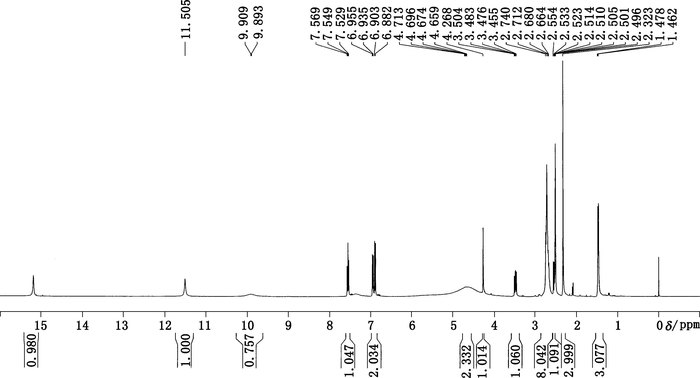
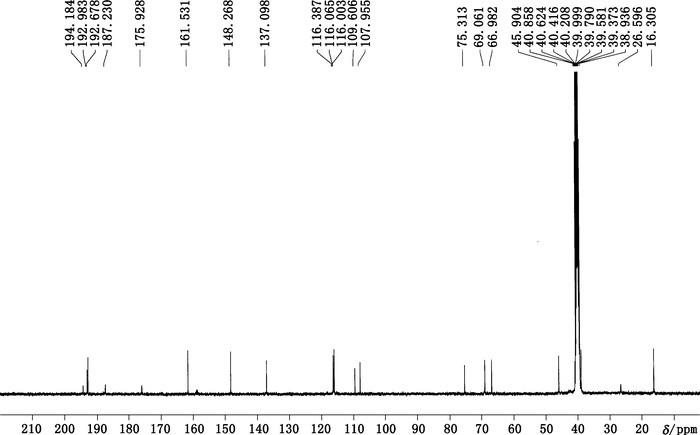
将制备获得杂质用d-DMSO溶解后,测定其1H NMR(见图 4)、13C NMR(见图 5)、DEPT(90°,135°)、COSY、HSQC、HMBC谱。
|
图 4 制备获得杂质的氢谱图 Figure 4 1H-NMR spectrum of prepared impurity |
|
图 5 制备获得杂质的碳谱图 Figure 5 1C-NMR spectrum of prepared impurity |
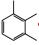
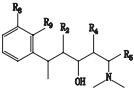
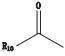
氢谱中共给出12组氢(见表 1),其中δ2.501 ppm处的信号为氘代DMSO溶剂峰,各组峰的积分比例由低场到高场为1:1:1:1:2:2:1:1:8:1:3:3。HSQC谱显示第1、第2、第3、第6组峰不与任何C之间存在相关,应该为活泼H。碳谱中共给出22个碳信号(见表 2),根据分子式中有23个碳原子,可以推测还有2个碳可能因为存在对称结构而产生重叠信号。DEPT谱显示该分子中存在11种C,8种CH,3种CH3,无CH2类型C存在。COSY谱显示,H-4和H-5相关,且均为叔碳氢,可以推测该结构中一定存在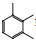
|
|
表 1 1H NMR 数据及信号归属 Table 1 Data of 1H NMR and signal attribution |
|
|
表 2 1C-NMR数据及信号归属 Table 2 Data of 1C-NMR and signal attribution |
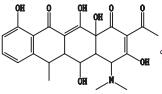
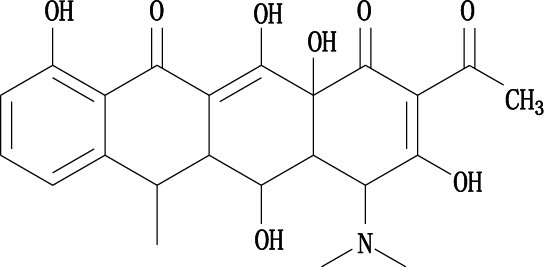
经UV、IR、MS、NMR等光谱分析鉴定,确定本次分离制备的杂质为EP 8.0[9]中的盐酸多西环素杂质F(化学名称为2-乙酰-2-脱氨甲酰多西环素,分子式为C23H25NO8),其结构见图 6。
|
图 6 盐酸多西环素杂质F的化学结构 Figure 6 The chemical structure of impurity F of doxycycline hyclate |
2014年国家评价性抽验品种“盐酸多西环素片”常规检查中发现杂质F的含量在0.30%~0.98%的范围内,且在强制破坏条件下均未观察到杂质F含量的显著增加,而含量太低不利于应用制备液相色谱法进行分离制备。经跟踪调查发现,杂质F为土霉素中杂质C在盐酸多西环素合成过程中的共合成产物,主要来源于原料。因此本研究选择常州制药有限公司提供的多西环素成盐母液浓缩后的粗品作为本研究的供试分离纯化用样品,该样品含杂质F约8%~10%,适合杂质F的分离制备。
3.2 干燥方式的选择文献报道[15],四环类抗生素在高温条件下稳定性较差,因此本研究选择冷冻干燥方式除去水分制备杂质F。
3.3 相对校正因子的测定按ChP 2010 [8]中盐酸多西环素含量测定方法进行测定,量取各对应色谱峰面积,分别采用ChP和USP方法计算制备获得杂质与多西环素的相对校正因子分别为1.05、0.95,这可为多西环素有关物质的定量研究提供参考。
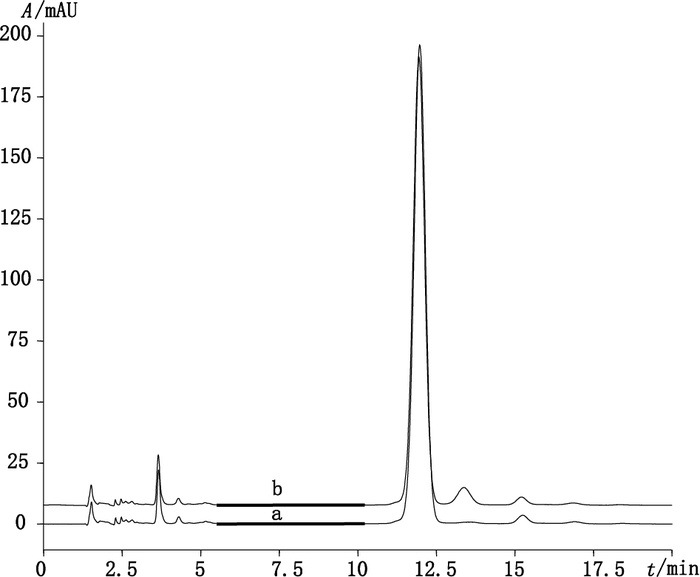
3.4 在质量标准中的应用采用紫外光谱、红外光谱、质谱及核磁共振等多种手段分析鉴定,确定本研究分离制备的杂质为杂质F。通过在含多西环素的溶液中添加杂质F的方法,比较杂质F添加前后的色谱图(见图 7)发现,添加杂质F后多西环素后相邻峰面积显著增加,因此充分证明了ChP[8]中“多西环素后相邻峰”为欧洲药典[9]中的杂质F。
|
图 7 未添加杂质F(a)和添加杂质F(b)的色谱图 Figure 7 Chromatogram before(a)and after(b)adding impurity F |
本次杂质F的成功制备为盐酸多西环素杂质对照品的制备提供新方法,这也为有关物质的定性和定量提供充分依据。药品安全影响人民生命健康,因此本杂质仍有待于进行进一步的毒性、药动学及药效学等研究,为药品临床用药的安全性提供参考。
| [1] |
ZAIDI S, CHAABANE T, SIVASANKAR V, et al. Electrocoagulation coupled electro-flotation process:Feasible choice in doxycycline removal from pharmaceutical effluents[J]. Arabian J Chem, 2015. |
| [2] |
杨春, 袁哲, 黄文祥, 等. 注射用盐酸多西环素治疗急性细菌性感染的临床研究[J]. 中国抗生素杂志, 2006, 31(11): 675. YANG C, YUAN Z, HUANG WX, et al. A clinical trial of doxycyclinc hydrochloride for injection in the treatment of acute bacterial infections[J]. Chin J Antibiot, 2006, 31(11): 675. DOI:10.3969/j.issn.1001-8689.2006.11.010 |
| [3] |
OKADA T, MOROZUMI M, TAJIMA T, et al. Rapid effectiveness of minocycline or doxycycline against macrolide-resistant mycoplasma pneumonia infection in a 2011 Outbreak Among Japanese Children[J]. Clin Infect Dis, 2012, 55(12): 1642. DOI:10.1093/cid/cis784 |
| [4] |
SAIGAL K, DHAWAN B, RAWRE J, et al. Genital mycoplasma and chlamydia trachomatis infections in patients with genital tract infections attending a tertiary care hospital of North India[J]. Indian J Pathol Microbiol, 2016, 59(2): 194. DOI:10.4103/0377-4929.182019 |
| [5] |
王浴生, 周黎明. 生物恐怖性炭疽杆菌病与抗生素的防治[J]. 四川生理科学杂志, 2004, 26(3): 119. WANG YS, ZHOU LM. Bioterrorism anthrax bacillus disease and the prevention and cure of antibiotics[J]. Sichuan J Physiol Sci, 2004, 26(3): 119. |
| [6] |
KUMAR YR, PRASAD RAJU VV, KUMAR RR, et al. Structural identification and characterization of impurities in moxifloxacin[J]. J Pharm Biomed Anal, 2004, 34(5): 1125. DOI:10.1016/j.jpba.2003.11.012 |
| [7] |
张锦琳, 张娅, 赵述强, 等. 在线脱盐-高效液相色谱-离子阱-飞行时间质谱法鉴定盐酸多西环素有关物质结构[J]. 中国药学杂志, 2015, 50(23): 2073. ZHANG JL, ZHANG Y, ZHAO SQ, et al. Structure identification of related substances in doxycycline hyclate by 2D-LC-IT-TOF/MS[J]. Chin Pharm J, 2015, 50(23): 2073. |
| [8] |
中国药典2010年版. 二部[S]. 2010: 690 ChP 2010. Vol Ⅱ[S]. 2010:690 |
| [9] |
EP 8. 0. Vol Ⅱ[S]. 2014:2110
|
| [10] |
孔英梅, 杨伯群. 新药有关物质检查中的一些问题[J]. 中国新药杂志, 2000, 9(7): 462. KONG YM, YANG BQ. Problems in examination of related substances in NDA file[J]. Chin New Drugs J, 2000, 9(7): 462. |
| [11] |
于丽丽, 刘巧, 陈丹, 等. 制备型高效液相色谱法在天然药物分离中的应用[J]. 中华中医药学刊, 2009, 27(7): 1465. YU LL, LIU Q, CHEN D, et al. Application of preparative high performance liquid chromatography in the isolation of naturaI medicines[J]. Chin Arch Tradit Chin Med, 2009, 27(7): 1465. |
| [12] |
MOHAN A, HARIHARAN M, VIKRAMAN E, et al. Identification and characterization of a principal oxidation impurity in clopidogrel drug substance and drug product[J]. J Pharm Biomed Anal, 2008, 47(1): 183. DOI:10.1016/j.jpba.2007.12.021 |
| [13] |
DONGRE VG, KARMUSE PP, GHUGRE PD, et al. Preparative isolation and structural elucidation of impurities in fluconazole by LC/MS/MS[J]. J Pharm Biomed Anal, 2006, 42(3): 334. DOI:10.1016/j.jpba.2006.04.012 |
| [14] |
RAO KV, RANI A, REDDY AV, et al. Isolation, structural elucidation and characterization of impurities in cefdinir[J]. J Pharm Biomed Anal, 2007, 43(4): 1476. DOI:10.1016/j.jpba.2006.10.031 |
| [15] |
李伟明, 鲍艳宇, 周启星. 四环素类抗生素降解途径及其主要降解产物研究进展[J]. 应用生态学报, 2012, 23(8): 2300. LI WM, BAO YY, ZHOU QX. Degradation pathways and main degradation products of tetracycline antibiotics:research progress[J]. Chin J Appl Ecol, 2012, 23(8): 2300. |
 2017, Vol. 37
2017, Vol. 37 
