2. 成都市食品药品检验研究院, 成都 610000;
3. 成都汇众成生物科技公司, 成都 611137
2. Chengdu Institute for Food and Drug Control, Chengdu 610000, China;
3. Chengdu Huizhong of Biological Technology Company, Chengdu 611137, China
玛咖为十字花科(Brassicaceae)独行菜属(Lepidium)一年生或两年生的一种药食两用植物Lepidium meyenii Walp.干燥根茎[1],主产于南美洲安第斯山脉,是一种纯天然食品,营养成份丰富,有“南美人参”之誉[2]。从2002年起,该植物相继在我国云南、西藏、四川等地引种成功[3]。现代研究表明,玛咖在抗疲劳,提高生育力,改善性功能,调节内分泌系统等方面有明显的药理作用[4-6],其保健功能日益受到国际上的关注。近年来,由于其价格的攀升和各方面因素,因其外形极似萝卜或芫根,市场上有些商家利用萝卜或芫根的根冒充玛咖,因此市场上出现了许多伪劣假冒玛咖的原材料和玛咖产品,严重影响了我国玛咖产业的发展。为了鉴定该药材,保障该药材的质量,急需建立一种快速、简便、有效可靠的鉴别方法。
自2010年来,由Chen等[7-9]首次提出利用内转录间隔区2(ITS2)条形码来鉴别药用植物,并且该技术在药用植物鉴定方向得到了极大的应用和发展[10-12]。药材中所含微量元素对人体起到重要的补充与调节作用,从而达到一定的治疗作用。现代研究表明,65Zn、23Na、39K等微量元素对人体的生长发育、生殖遗传、免疫、内分泌等重要生理过程起着极其重要的作用。随着绿色产品逐渐受到人们的青睐,人们在关注中草药中微量元素的同时,其重金属残留问题也越来越受到重视,并且各种中药中的重金属也在中国药典中进行了相关规定。玛咖这种药食两用植物最近几年在国内被炒得火热,但对其安全性评价的研究一直处于空白,仅有少量文献对我国云南丽江产玛咖的重金属进行了报道研究[13-15]。本研究采用ITS2序列对玛咖及其混伪品基源植物进行DNA条形码鉴别研究,为玛咖的鉴定提供准确的分子依据,同时采用微波消解-石墨炉原子吸收光谱法对不同产地玛咖中的重金属元素和痕量元素进行测定,为玛咖药材的微量元素及重金属元素研究提供参考依据,从而更好地控制玛咖的质量。
1 仪器、试剂与样品凝胶电泳成像系统(BIO-RAD公司);全自动进样品快速球磨仪(上海净信实业发展有限公司);Allegra X-30R Centrifuge离心机(BECKMAN COULTER公司);iCycler iQ Multi-Color Real-Time PCR Detection Systerm(BIO-RAD公司);dNTP;2×Taq PCR MasterMix(天根生化科技有限公司);植物DNA提取试剂盒(天根生化科技有限公司);通用引物ITS2F/ITS3R(由成都擎科梓熙生物技术有限公司合成)。
微波消解仪(Milestone公司);AA-6800原子分光光度计(岛津公司);ECH-1电子恒温加热板(上海新仪微波化学科技有限公司);65%优级纯硝酸,30%优级纯过氧化氢(成都市科龙化工厂),1 000 μg·mL-1的各种元素标准溶液(镉,批号GSB04-1721-2004;铜,批号GSB04-1725-2004;铅,批号GSB04-1742-2004;铬,批号GSB04-1723a-2004;钙,批号GSB04-1720-2004;镁,批号GSB04-1735-2004;钠,批号GSB04-1738-2004;钾,批号GSB04-1733-2004;铁,批号GSB04-1726-2004。国家有色金属及电子材料分析测试中心),灌木枝叶组合样(批号GBW07602(GSV-1),中国地质科学院地球物理地球化学勘查研究所)。
本研究所用的材料包括4个物种16个样品,包括实验样品及在GenBank下载序列(见表 1)。实验室样品经成都中医药大学药学院李敏教授鉴定为十字花科Brassicaceae独行菜属Lepidium玛卡(Lepidium meyenii Walp.)的干燥根茎;萝卜为十字花科植物萝卜属Raphanus萝卜(Raphanus sativus L.)的干燥块根;芫根为十字花科植物芜菁(Brassica rapa L.)的干燥块根。凭证标本保存于成都中医药大学科技楼实验室。
|
|
表 1 实验材料 Table 1 The experimental materials |
取玛咖、萝卜和芫根各约30 mg,加入2 mL液氮后,用DNA快速球磨仪研磨3 min(30次·s-1),用植物DNA提取试剂盒提取总DNA,将沉淀剂改为三氯甲烷,其余步骤均按照试剂盒说明书进行。
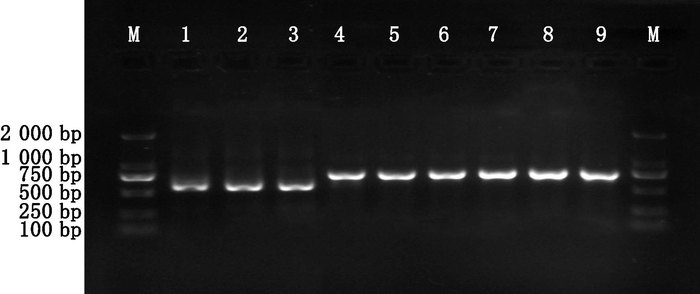
2.1.2 PCR扩增及测序PCR扩增正向引物ITS2F为5′ > ATGCGATACTTGGTGTGAAT < 3′,反向引物ITS3R为5′ > GACGCTTCTCCAGACTACAAT < 3′。PCR反应体系为25μL,包括2.5 μmol·L-1正反引物各1.0 μL,2×Easy Taq PCR Super Mix(Trans Gen Biotech Co.,China)12.5 μL,模板DNA为2 μL,ddH2O为8.5 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,退火温度为56 ℃,30 s;72 ℃延伸2 min,40个循环;72 ℃延伸10 min。反应结束后取5 μL反应产物,利用琼脂糖凝胶电泳检测纯度,观察到条带单一,表明PCR扩增良好(见图 1),再将扩增好的DNA送至成都擎科梓熙生物技术有限公司进行双向测序。
|
M. maker 1.芫根(Brassica rapa L.)2.萝卜(Raphanus sativus L.)3.白萝卜(white radish)4-9.玛咖(Lepidium meyenii Walp.) 图 1 样品PCR扩增结果 Figure 1 The PCR amplification results of samples |
将所得的测序峰图利用CodonCode Aligner V 6.0.2(CodonCode Co.,USA)进行校对拼接,除去引物区。基于隐马尔夫模型的HMMer注释方法将所有测得的序列及在GenBank上下载的序列用CodonCode Aligner V 6.0.2除去两端的5.8S和28S区,从而获得内部转录间隔区ITS2序列。再利用MEGA 6.0(molecular evolutionay genetics analysis)进行序列的分析比对,并计算K2P遗传距离,建立NJ tree,同时将测得的序列利用sequin软件提交到数据库,获得GenBank登陆号。
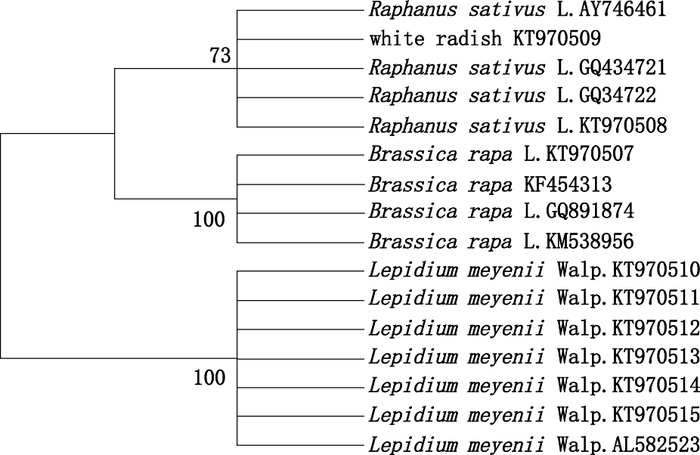
2.1.4 聚类分析通过MEGA 6.0软件,基于玛咖及其混伪品的ITS2序列,构建NJ tree(图 2所示),从图中可以看出,玛咖、芫根及萝卜各聚为1支,呈现出明显的单系性,玛咖和芫根的支持率均为100%,萝卜的支持率为73%,通过构建NJ tree能够很明显地将玛咖与其混伪品(芫根和萝卜)区分开来。
|
图 2 基于ITS2序列构建玛咖及其混伪品的NJ tree Figure 2 NJ tree of Lepidium meyenii and its adulterants based on ITS2 |
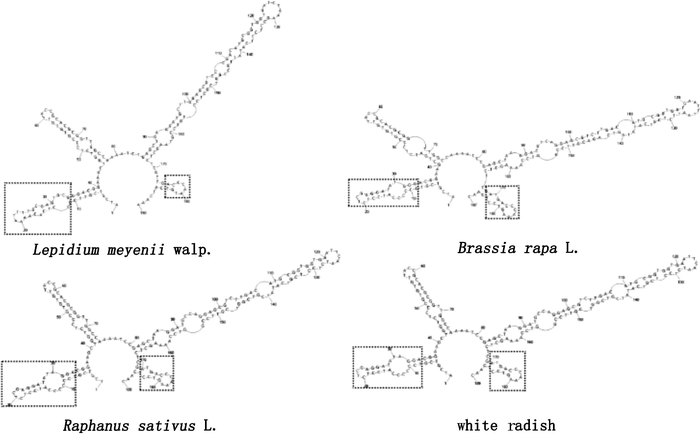
将玛咖及其混伪品的ITS2序列导入PseudoViewer 2.5软件中建立其二级结构(如图 3),从图中可以看出,所有样品的二级结构都是由1个中心主环和4个螺旋结构构成,其顺时针依次为螺旋Ⅰ、Ⅱ、Ⅲ及Ⅳ区,每个螺旋上都有大小不同的环和长度不同的茎构成。根据玛咖、芫根及萝卜的二级结构可以看出玛咖的螺旋Ⅰ、Ⅳ区明显与其他3个的Ⅰ、Ⅳ区不同,玛咖在Ⅰ区上有3个环,在Ⅳ区上只有1个环,而其他3个样品在Ⅰ、Ⅳ区上均有2个环。因此,可以通过ITS2二级结构,更能明显直观地鉴别玛咖及其混伪品。
|
图 3 玛咖及其混伪品的 ITS2 二级结构比较 Figure 3 The comparison of Lepidium meyenii and its adulterants on ITS2 secondary structures |
玛咖的ITS2区间序列长度为190 bp,其中GC含量为54.7%,而芫根ITS2序列长度为187~191 bp,GC含量为52.9%,萝卜ITS2序列长度为188~194 bp,GC含量为55.4%~55.9%。在样品的ITS2序列中,玛咖与芫根出现变异位点有42~46个,与萝卜出现的变异位点有39~42个,并且通过采用MEGA 6.0对样本进行种内种间K2P遗传距离计算(见表 2)。
|
|
表 2 玛咖及其混伪品 ITS2 的 K2P 遗传距离(cM) Table 2 The K2P genetic distance of Lepidium meyenii and its adulterants from ITS2 |
从表 2可以发现,不同产地的玛咖的遗传距离为0,说明玛咖自2002年来从秘鲁引种至我国境内在种内遗传中基本没有出现太大的变异情况,同时也证明ITS2序列作为玛咖的条形码具有很好的稳定性。玛咖与不同混伪品之间的种间遗传距离分布在0.205~0.250 cM,且玛咖最大种内变异距离明显小于最小种间变异距离,说明ITS2序列可以作为DNA条形码对玛咖与其混伪品进行快速、准确的鉴定。
2.2 不同产地玛咖中微量元素的测定 2.2.1 供试品溶液的配制取不同产地玛咖粉末各0.50 g,精密称定,置于微波消解罐中,加入硝酸5 mL和30%过氧化氢溶液1 mL,再加入超纯水2 mL,封盖后放入微波消解仪中进行消解,其消解参数见表 3,消解完后在电热板上赶酸至1 mL,用超纯水溶解并定容至50 mL,摇匀,作为测定镉(112Cd)、铜(63Cu)、铅(207Pb)、铬(52Cr)、钠(23Na)、铁(56Fe)的供试品溶液;再分别量取1.0 mL和0.1 mL上述溶液于10 mL量瓶中,加超纯水定容至刻度线,摇匀,作为测定镁(24Mg)和钙(40Ca)、钾(39K)的供试品溶液。
|
|
表 3 微波消解条件 Table 3 The conditions of Microwave digestion |
在微波消解罐中,按上述供试品溶液的制法,制作1份空白对照溶液。
2.2.3 各个元素标准工作母液的制备精密量取112Cd、63Cu、207Pb、52Cr元素标准溶液各0.5 mL,分别置于500 mL量瓶中,用2.0%硝酸溶液稀释分别制成质量浓度为1.0 μg·mL-1的标准储备液;分别取112Cd、63Cu、207Pb的标准储备液各2.5 mL,分别置于50 mL量瓶中,用2.0%硝酸溶液稀释分别制成质量浓度为0.05 μg·mL-1的112Cd、63Cu、207Pb标准工作母液;取112Cr元素的标准储备液0.5 mL,置于50 mL量瓶中,用2.0%硝酸溶液稀释制成质量浓度为0.01 μg·mL-1的112Cr标准工作母液[16]。精密量取40Ca、24Mg、23Na、39K、56Fe元素标准溶液各2.0 mL,分别置于500 mL量瓶中,用2.0%硝酸溶液稀释分别制成质量浓度为4.0 μg·mL-1的标准储备备液;分别取24Mg、23Na、39K、56Fe的标准储备液各25 mL,分别置于50 mL量瓶中,用2.0%硝酸溶液稀释分别制成质量浓度为2.0 μg·mL-1的24Mg、23Na、39K、56Fe标准工作母液。
2.2.4 仪器工作参数|
|
表 4 仪器工作参数(石墨原子吸收法) Table 4 Optimal working parameters of the apparatus(GFAAS) |
|
|
表 5 仪器工作参数(火焰原子吸收法) Table 5 Optimal working parameters of the apparatus(FAAS) |
在给定工作参数下,分别将“2.2.3”项下的标准工作母液由仪器自动稀释成系列浓度的标准工作液,进样量50 μL,以浓度(X)为横坐标,吸收度(Y)为纵坐标建立标准曲线,如表 6。结果表明各个元素各自的线性关系良好。
|
|
表 6 各元素回归方程及相关系数 Table 6 Regression equations of each element and correlation coefficients |
分别取112Cd、63Cu、207Pb、52Cr、40Ca、24Mg、23Na、39K、56Fe元素的标准工作液,按“2.2.4”项下的工作参数,连续测定5次,以吸收度计算RSD分别为1.2%、1.0%、1.6%、0.8%、1.5%、1.6%、1.4%、1.2%、1.3%,表明仪器精密度良好。
2.2.7 重复性试验取同一批次样品(云南140301号)6份,每份约0.50 g,精密称定,按“2.2.1”项下方法分别制备供试品溶液,按“2.2.4”项下的工作参数测定。其112Cd、63Cu、207Pb、52Cr、40Ca、24Mg、23Na、39K、56Fe元素的平均含量分别为0.39 μg·g-1、5.61 μg·g-1、0.44 μg·g-1、1.09 μg·g-1、2.33 mg·g-1、1.16 mg·g-1、0.13 mg·g-1、17.23 mg·g-1、0.23 mg·g-1,RSD分别为1.9%、1.4%、1.6%、1.3%、1.7%、1.6%、1.5%、1.2%、1.4%。表明该方法可行,重复性良好。
2.2.8 加样回收率试验取已知含量玛咖(云南140301号)样品约0.25 g共9份,精密称定,加入适量的112Cd、63Cu、207Pb、52Cr、40Ca、24Mg、23Na、39K、56Fe元素标准溶液,使其为被测组分的0.8、1.0、1.2倍,按“2.2.1”项下制备供试溶液,测定其吸光度,计算回收率及RSD。112Cd、63Cu、207Pb、52Cr、40Ca、24Mg、23Na、39K、56Fe元素的回收率分别为93.2%、96.7%、95.4%、102.7%、94.3%、95.7%、105.9%、96.4%、98.1%,RSD分别为1.8%、2.3%、2.1%、1.5%、1.7%、2.6%、1.9%、1.5%、2.4%,表明其回收率良好,该方法有效可靠。
2.2.9 准确性试验按“2.2.1”项下方法制备供试品溶液,按“2.2.4”项下的工作参数测定国家一级标准物质灌木枝叶组合样品中112Cd、63Cu、207Pb、52Cr、40Ca、24Mg、23Na、39K、56Fe元素的含量,将各元素的测定值与标准值比较(见表 7),其结果表明,这9种元素的测定值与标准值相符,说明本方法的测定结果准确。
|
|
表 7 标准样品中各元素浓度的测定值与标准值比较(μg·g-1,n=3) Table 7 Comparison of measured value and certified value for standard sample |
按照“2.2.1”项下制备不同产地玛咖样品供试品溶液,按“2.2.4”项下的工作参数测定其微量元素,结果见表 8。
|
|
表 8 中文标题 Table 8 英文标题 |
由表 8可以看出,6个不同产地玛咖中各元素均有明显差异。63Cu、207Pb、52Cr 3种重金属元素含有量均在《药用植物及制剂进出口绿色行业标准》的限量标准内[17],均符合规定。而112Cd元素在云南、西藏及四川中有不同程度的超标,新疆玛咖中的112Cd元素最高,达到0.667 μg·g-1,其原因可能是因为该地区土壤中112Cd元素含有量较高所致,或者可能由于十字花科植物本身对112Cd元素有较强的富集能力[18]。
从测定的玛咖痕量元素来看,玛咖中含有丰富的矿物元素,特别是39K、40Ca、24Mg这3种元素含量较高。39K、23Na元素对人体中Na+-K+泵的吸K排Na生理功能有着重要意义,高39K低23Na的饮食对维护Na+-K+泵的运作、预防白内障、高血压等疾病起着重要作用[19]。所有玛咖均含有较为丰富的40Ca元素,研究表明,40Ca元素在生长发育等重要生理过程中起着极其重要的作用,玛咖有抗骨质疏松的能力可能与其含有丰富的40Ca有关[20]。
3 结论与讨论 3.1 DNA条形码鉴定本研究运用了近几年一种新的分子生物技术—DNA条形码来对玛咖及其混伪品进行鉴别研究。结果表明运用ITS2条形码能明显区别玛咖与其他同科植物的混伪品,并且其二级结构更能直观地反映出它们的区别,同时根据构建的系统聚类树也能很清楚地辨别玛咖与萝卜和芫根。2010年版《中华人民共和国药典》首次将DNA条形码技术用于乌梢蛇饮片、蕲蛇饮片、川贝母中药材的检测[21],2015年版《中华人民共和国药典》载入了中药材DNA条形码分子鉴定法指导原则[22],分子鉴定已成为传统鉴定的有效补充方法,其中的ITS2条形码标定技术在植物物种鉴定方面已成为一种非常有效的手段,其优点是简便高效,不受样品的外观形态以及研究者专业水平的限制,以至于非专业的研究人员也可以通过DNA试剂提取盒较好、较快地提取样本中的DNA来鉴别物种。但要想更好地提出植物中的DNA还应该尽量除去植物中干扰成分,为后期的正常测序分析奠定基础。玛咖、萝卜以及芫根富含丰富的多糖、黏液质成分,对后期的PCR有一定的干扰,本研究对购买的DNA试剂盒提取方法进行了优化,将沉淀试剂改为三氯甲烷,能有效地沉淀样品中的多糖等成分,得到纯度更高的DNA样品用于PCR扩增。因此,采用DNA分子技术—ITS2条形码能更加准确、高效地用于植物品种之间的鉴别,为玛咖药材以及其他植物药的真伪鉴别提供了有效的手段,更为其后期的质量控制研究提供了有效保障,同时也可在药材市场的物种鉴定中发挥重要的价值。
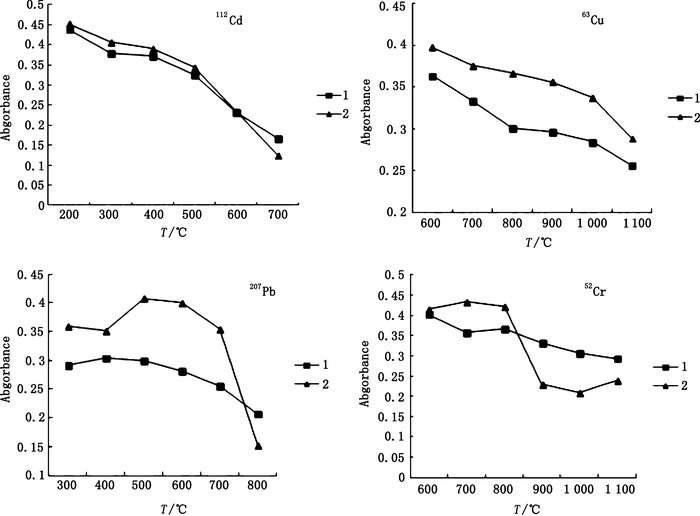
3.2 最佳灰化温度选择灰化温度对于GFAAS测定数据的准确性有显著影响,灰化温度过高可能造成被测元素损失,灵敏度降低,重复性变差;而灰化温度过低则会造成背景吸光值高。因此,对各元素的灰化温度进行了考察。固定原子化温度,吸取适宜浓度标准工作液和供试品溶液,对112Cd、63Cu、207Pb及52Cr分别在灰化温度200~700、600~1 100、300~800、600~1 100 ℃范围内测定吸光度,其温度与吸光度关系见图 4。可以看出112Cd的吸光度值在200~700 ℃呈下降趋势,在300~400 ℃较为平缓,而在200 ℃时虽然最高,但经测定此处背景值很高,因此选用400 ℃作为112Cd的最佳灰化温度;63Cu的吸光度值在800~1 100 ℃呈下降趋势,在800~900 ℃较为平缓,经测定在800 ℃时背景值低于0.01,因此选用800 ℃作为63Cu的最佳灰化温度;207Pb的吸光度值在500 ℃最高,因此选用500 ℃作为207Pb最佳灰化温度;样品中52Cr的吸光度值在800 ℃以后陡然下降,而标准品中700~800 ℃时较为平缓,综合考虑选用700 ℃作为52Cr的最佳灰化温度。
|
1. 标准工作液(standard working solution) 2. 供试品溶液(test sample solution) 图 4 灰化温度曲线 Figure 4 Curves of ashing temperature |
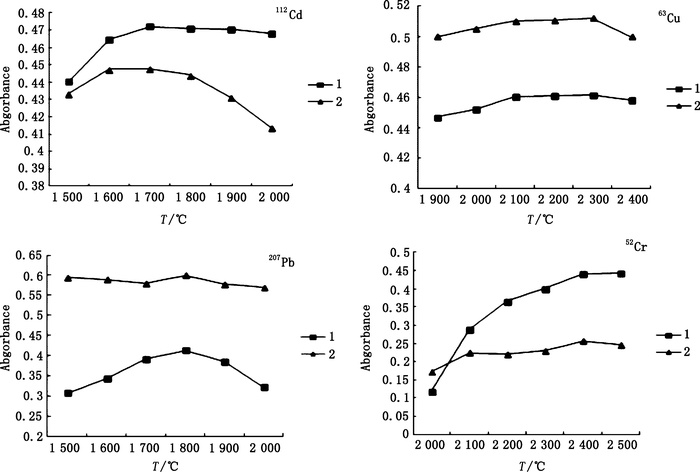
原子化的目的在于通过加热使待测元素尽可能多地蒸出以供检测,原子化温度过低会使待测元素原子化不完全,使测定值偏低,原子化温度过高会影响石墨管寿命。因此,试验对原子化温度也进行了优化。固定灰化温度,吸取适宜浓度标准工作液和供试品溶液,对112Cd、63Cu、207Pb及52Cr分别在原子化温度1 500~2 000、1 900~2 400、1 500~2 000、2 000~2 500 ℃范围内测定吸光度,其温度与吸光度关系见图 5。可见,112Cd、63Cu、207Pb、52Cr的吸光度值分别在1 700、2 300、1 800、2 400 ℃时最高,故选用1 700 ℃作为112Cd的最佳原子化温度,2 300 ℃作为63Cu的最佳原子化温度,1 800 ℃作为207Pb的最佳原子化温度,2 400 ℃作为52Cr的最佳原子化温度。
|
1. 标准工作液(standard working solution) 2. 供试品溶液(test sample solution) 图 5 原子化温度曲线 Figure 5 Curves of atomization temperature |
本次研究,部分产地玛咖药材中Cd元素含量超标。Cd是一种毒性很强的重金属,对人的中枢神经破坏力很大,而且极易干扰肾功能和生殖功能。Cd的毒性是潜在性的,即使饮用水中Cd质量浓度低至0.1 mg·L-1,也能在人体(特别是妇女)组织中积聚,潜伏期可长达10年至30年,且早期不易觉察[23]。为了降低中药材中Cd的含有量,建议可以对受污染的土壤进行改良措施,如在土壤中施加石灰,提高其pH;或施加磷酸盐之类的化肥,使其生成磷酸Cd沉淀,降低土壤中的Cd元素[24]。
玛咖中含有丰富的矿物元素,且6个不同产地玛咖中的矿物元素有明显差异。玛咖具有抗疲劳、抗衰老、提高生育能力以及调节生理功能等作用,这些药用效果均与玛咖中含有的各种微量元素有关。
随着药品食品现代化的发展,人们对其中的痕量元素及重金属元素的含量越来越重视。玛咖药材作为各种保健品的主要原料,受到许多研究人员和企业的关注,并且我国云南、新疆等地区近几年来相继引进玛咖这一品种,更应该控制其中的重金属含量,从而满足各国对玛咖质量与安全的限量要求,加快我国玛咖产业的发展。因此,通过对玛咖中微量元素的研究,对确保其质量和安全性有着重要的意义。
| [1] |
GONZALES GF, GONZALES C, GONZALES-CASTAÑEDA C. Lepidium meyenii(Maca):a plant from the highlands of peru-from tradition to science[J]. Forsch Komplementmed, 2009, 16(6): 373. DOI:10.1159/000264618 |
| [2] |
GONZALES FG, VILLAORDUNA L, GASCO M, et al. Maca (Lepidium meyenii Walp), una revision sobre sus propiedades biologicas[J]. Rev Peru Med Exp Salud Publica, 2014, 31(1): 100. |
| [3] |
余龙江, 金文闻, 李为, 等. 南美植物玛咖的研究进展[J]. 中草药, 2003, 34(2). YU LJ, JIN WW, LI W, et al. Research advances on Maca of South American plant[J]. Chin Tradit Herb Drugs, 2003, 34(2). |
| [4] |
LEE MS, SHIN BC, YANG EJ, et al. Maca(Lepidium meyenii) for treatment of menopausal symptoms:a systematic review[J]. Maturitas, 2011, 70(3): 227. DOI:10.1016/j.maturitas.2011.07.017 |
| [5] |
ZHANG Y, YU L, JIN W, et al. Effect of ethanolic extract of Lepidium meyenii Walp on serum hormone levels in ovariectomized rats[J]. Indian J Pharmacol, 2014, 46(4): 416. DOI:10.4103/0253-7613.135955 |
| [6] |
RUBIO J, CALDAS M, DÁVILA S, et al. Effect of three different cultivars of Lepidium meyenii(Maca)on learning and depression in ovariectomized mice[J]. BMC Complement Altern Med, 2006, 6: 23. DOI:10.1186/1472-6882-6-23 |
| [7] |
CHEN SL, YAO H, HAN JP, et al. Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species[J]. PLoS One, 2010, 5(1). |
| [8] |
YAO H, SONG JY, LIU C, et al. Use of ITS2 region as the universal DNA barcode for plants and animals[J]. PLoS One, 2010, 5(10). |
| [9] |
陈士林. 中药DNA条形码分子鉴定[M]. 北京: 人民卫生出版社, 2012. CHEN SL. Molecular Identification of DNA in Chinese Traditional Medicine[M]. Beijing: People's Health Publishing House, 2012. |
| [10] |
WANG CZ, LI P, DING JY, et al. Discrimination of Lonicera japonica Thunb. from different geographical origins using restriction fragment length polymorphism analysis[J]. Pharm Soc Japan, 2007, 30(4): 779. |
| [11] |
SUN Z, GAO T, YAO H, et al. Identification of Lonicera japonica and its related species using the DNA barcoding method[J]. Planta Med, 2011, 77(3): 301. DOI:10.1055/s-0030-1250324 |
| [12] |
辛天怡, 姚辉, 罗焜, 等. 羌活药材ITS/ITS2条形码鉴定及其稳定性与准确性研究[J]. 药学学报, 2012, 47(8): 1098. XIN TY, YAO H, LUO K, et al. Stability and accuracy of the identification of Notopterygii Rhizoma et Radix using the ITS/ITS2 barcodes[J]. Acta Pharm Sin, 2012, 47(8): 1098. |
| [13] |
杨申明, 张蒙, 汪启莲, 等. ICP-AES测定玛咖中微量元素的含量[J]. 微量元素与健康研究, 2015, 32(1): 26. YANG SM, ZHANG M, WANG QL, et al. Determination of trace elements in Maca by ICP-AES[J]. Stud Trace Elem Health, 2015, 32(1): 26. |
| [14] |
季华国, 木书林. 玛咖中重金属铅、镉的测定探究[J]. 食品安全导刊, 2015, 11(33): 122. JI HG, MU SL. The determination of heavy metal lead and cadmium in Maca[J]. China Food Saf Mag, 2015, 11(33): 122. |
| [15] |
蒋寒林. 外来物种玛咖主要化学成分研究[D]. 广州: 华南理工大学, 2014 JIANG HL. Study on the Chemical Compositions in Alien Species of Maca[D]. Guangzhou:South China University of Technology, 2014 |
| [16] |
李江, 王江瑞, 张潇, 等. 微波消解-原子吸收分光光度法测定不同产地药用忍冬中重金属[J]. 药物分析杂志, 2015, 35(6): 1054. LI J, WANG JR, ZHANG X, et al. Determination of heavy metals in medicinal honeysuckle from different areas by microwave digestionatomic absorption spectroscopy[J]. Chin J Pharm Anal, 2015, 35(6): 1054. |
| [17] |
GB/T5009药用植物及制剂进出口绿色行业标准[S]. 2004 GB/T5009 Green Trade Standards of Importing Exporting Medicinal plants Preparations[S]. 2004 |
| [18] |
栾云霞, 王北洪, 陆安祥, 等. 十字花科蔬菜对土壤中镉的吸收积累特性研究[C]//第四届全国农业环境科学学术研讨会论文集. 2011: 91 LUAN YX, WANG BH, LU AY, et al. Characteristics of cruciferous vegetables on the absorption and accumulation of cadmium in the soil[C]//Proceedings of the Fourth National Symposium on Agricultural Environmental Science. 2011:91 |
| [19] |
童晓青, 贺亮, 刘本同, 等. 不同颜色玛咖营养成分分析[J]. 食品工程, 2015(3): 57. TONG XQ, HE L, LIU BT, et al. Analysis of different colors of Maca's nutrition composition[J]. Food Eng, 2015(3): 57. |
| [20] |
彭璐, 赵云, 许旭东, 等. 玛咖对维甲酸诱导的骨质疏松症的抑制作用[J]. 中药药理与临床, 2014, 30(3): 98. PENG L, ZHAO Y, XU XD, et al. Anti-osteoporosis activity of Lepidium meyenii(Maca)introduced into Yunnan province in the retinoic acid-induced osteoporosis model[J]. Pharmacol Clin Chin Mater Med, 2014, 30(3): 98. |
| [21] |
中国药典2015年版. 一部[S]. 2015: 78, 372 ChP 2015. Vol Ⅰ[S]. 2015:78, 372 |
| [22] |
中国药典2015年版. 四部[S]. 2015: 383 ChP 2015. Vol Ⅳ[S]. 2015:383 |
| [23] |
杨云, 刘洋洋, 陈波. 不同来源沉香药材中重金属含量及其安全性分析[J]. 中国实验方剂学杂志, 2013, 19(20): 72. YANG Y, LIU YY, CHEN B. Determination of heavy metal in agarwood from different resources and evaluation on its safety[J]. Chin J Exp Tradit Med Form, 2013, 19(20): 72. |
| [24] |
刘毅. 镉的危害及其研究进展(综述)[J]. 中国城乡企业卫生, 2003, 8(4): 12. LIU Y. The harm of cadmium and its research progress[J]. Chin J Urban Rural Enterprise Hyg, 2003, 8(4): 12. |
 2017, Vol. 37
2017, Vol. 37 
