2. 四川省食品药品检验检测院, 成都 610097
2. Sichuan Institute for Food and Drug Control, Chengdu 610097, China
蒲黄为香蒲科植物水烛香蒲Typha angustifolia L.、东方香蒲Typha orientalis Presl或同属植物的干燥花粉,收载于中国药典2015年版一部,具有止血、化瘀、通淋的功效,用于吐血、衄血、咯血、崩漏、外伤出血、经闭痛经、胸腹刺痛、跌扑肿痛、血淋涩痛[1],为重要的中药品种。本文对国家评价性抽样中发现的可疑样品进行了检测,确证除已见报道并建立了标准的金胺O染色外[2],蒲黄中还存在用柠檬黄及酸性黄36染色的情况,故建立了蒲黄中同时检查这2种染色剂的定性检验方法[3]。
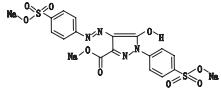
酸性黄36(metanil yellow),又称酸性间胺黄、皂黄,为一种工业上应用的偶氮染料。工业上主要用于肥皂的着色和羊毛、丝绸织物的染色以及皮革、漆类及木制品着色、生物着色等。酸性黄36具有中等毒性,成人误服约0.25 g可引起中毒。在国家强制性标准中未规定其可作为食用色素使用,食品领域文献报道多用HPLC-DAD或HPLC-MS方法进行检测[4-7]。在中药材中尚未发现使用酸性黄36进行染色的报道。
柠檬黄(tartrazine),又称酒石黄、酸性淡黄、肼黄。为水溶性合成色素。柠檬黄不是蒲黄应有的化学成分,在药学领域主要用于胶囊壳的着色剂[8]。柠檬黄用于药材染色已有报道[9],采用的是TLC初筛,HPLC确认的检测方法,但针对蒲黄药材尚无相关标准。
2种色素相对分子质量、结构式等信息见表 1。
|
|
表 1 2种色素信息一览表 Table 1 The information of tartrazine and metanil yellow |
Merck公司硅胶G薄层板。Agilent公司1200高效液相色谱仪(配有四元梯度泵、DAD检测器);Waters公司Sunfire C18(150 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶)色谱柱,Agilent公司ZORBAX SB-C18(150 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶)色谱柱。Agilent公司1290-6540飞行时间质谱仪。WIGGENS公司UE10SFD超声波清洗器。丹佛公司DENVER TB-225D电子分析天平。
乙腈为色谱纯试剂,水为超纯水,其余试剂均为分析纯。柠檬黄对照试剂,中国食品药品检定研究院,批号510004-201401,供HPLC检查用,以C16H9N4Na3O9S2计,含量为91.0%,使用前不需干燥处理;酸性黄36对照试剂,Dr.Ehrenstorfer GmbH,批号C10029500,以C18H14N3NaO3S计,含量为99.0%。蒲黄对照药材,中国食品药品检定研究院,批号为121225-201003。药材样品蒲黄134批,均为2015年国家评价性抽验样品。
1.2 溶液的配制 1.2.1 对照溶液取对照试剂柠檬黄和酸性黄36适量,分别加70%乙醇制成每1 mL中各含0.5 mg的溶液,作为柠檬黄对照试剂溶液Ⅰ和酸性黄36对照试剂溶液Ⅰ(TLC用);取对照试剂柠檬黄和酸性黄36适量,加70%乙醇制成每1 mL中各含0.05 mg的混合溶液,作为对照试剂混合溶液Ⅱ(HPLC用);取对照试剂柠檬黄和酸性黄36适量,加70%乙醇制成每1 mL中各含0.01 mg的混合溶液,作为对照试剂混合溶液Ⅲ(TLC和HPLC用)。
1.2.2 供试品溶液取蒲黄粉末2 g,加70%乙醇20 mL,密塞,超声处理(功率90 W,频率40 kHz)20 min,离心(转速为4 000 r·min-1,时间为5 min),取上清液作为供试品溶液。
1.2.3 阴性样品溶液取蒲黄对照药材粉末,同供试品溶液制备方法制备阴性样品溶液。
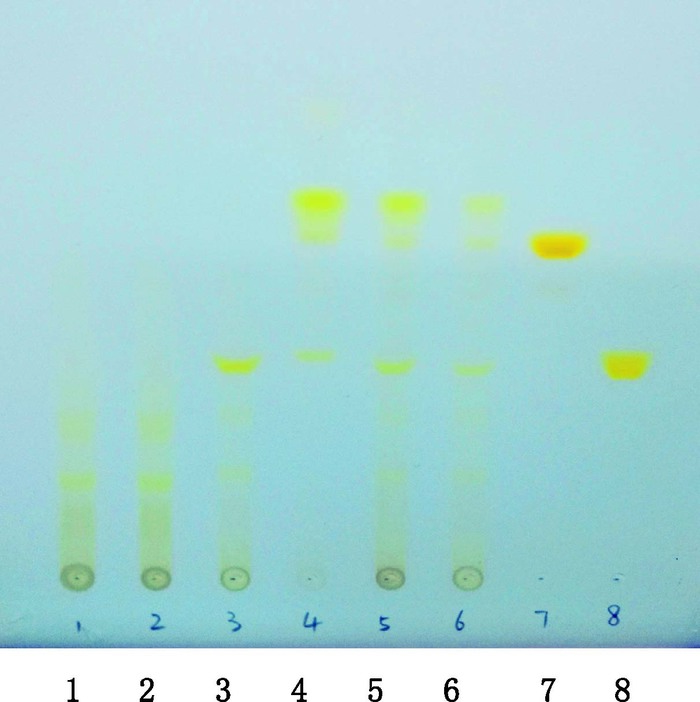
2 柠檬黄和酸性黄36的TLC检查 2.1 TLC检查结果取上述“1.2”项下供试品溶液和对照试剂溶液Ⅰ各10 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-正丁醇-乙醇-氨水-水(1:3:3:1:1)为展开剂,展开,取出,晾干;日光下检视[10-11]。结果在134批供试品色谱中,4批疑似检出柠檬黄,3批(样品2、样品3、样品4)疑似检出酸性黄36,见图 1。将采用HPLC-DAD法进行验证。
|
1、2.阴性样品溶液(test solution of negative samples)3~6. 4个阳性样品的供试品溶液(test solution of four potential dyed samples)7.酸性黄36对照试剂溶液Ⅰ(solution Ⅰ of metanil yellow reference reagent)8.柠檬黄对照试剂溶液Ⅰ(solution Ⅰ of tartrazine reference reagent) 图 1 疑似染色蒲黄样品TLC图 Figure 1 TLC chromatograms of the potential dyed Typhae Pollen |
取“1.2”项下柠檬黄对照试剂溶液Ⅰ和酸性黄36对照试剂溶液Ⅰ、疑似含染色剂样品的供试品溶液和阴性样品溶液,按“2.1”项下方法进行试验,结果阴性样品溶液无干扰。
2.3 检出限的考察取“1.2”项下对照试剂混合溶液Ⅲ,以不同点样量按“2.1”项下方法进行试验,见图 2。结果显示,当大于或者等于对照试剂混合溶液Ⅲ(柠檬黄质量浓度为10.18 μg·mL-1,酸性黄36质量浓度为10.72 μg·mL-1)浓度时,可见柠檬黄和酸性黄36斑点。故本方法柠檬黄的最低检出限为0.03 µg,酸性黄36的最低检出限为0.05 µg。
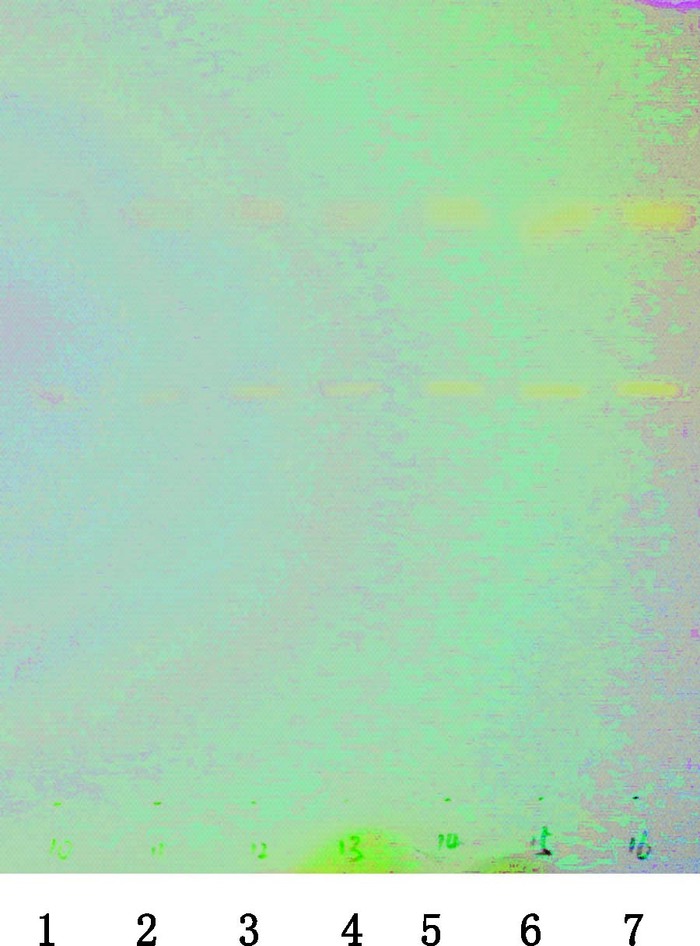
|
1~7.对照试剂混合溶液Ⅲ,点样量依次为1、3、5、7、10、11、12 μL(mixed solution Ⅲ of reference reagents,the sampling volume were 1,3,5,7,10,11 and 12 μL,from left to right) 图 2 柠檬黄及酸性黄36检出限 Figure 2 Detection limit of artrazine and metanil yellow |
采用Sunfire C18(150 mm×4.6 mm,5 μm)色谱柱,以甲醇为流动相A,0.2 mol·L-1的乙酸铵溶液为流动相B,梯度洗脱(0~10 min,12%A,88%B;10~15 min,12%A→90%A,88%B→10%B;15~20 min,90%A→12%A,10%B→88%B;20~30 min,12%A,88%B)。采用二极管阵列检测器,在428 nm波长处检测柠檬黄,在422 nm波长处检测酸性黄36。理论板数按柠檬黄对照试剂色谱中的主峰计算不低于3 000[12-14]。
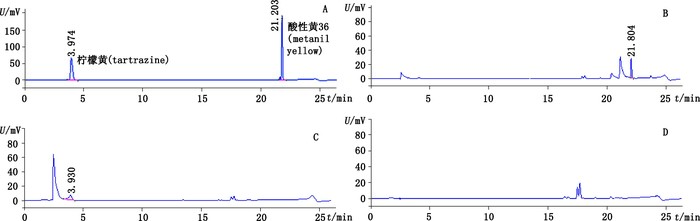
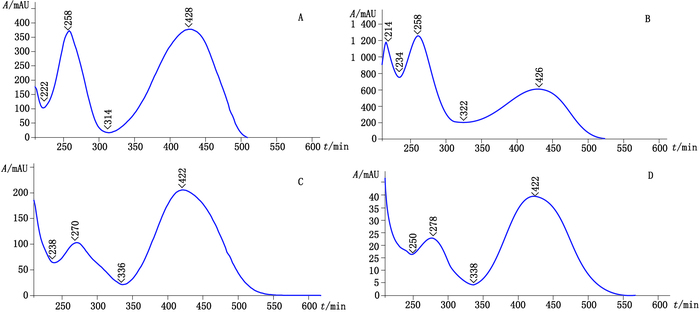
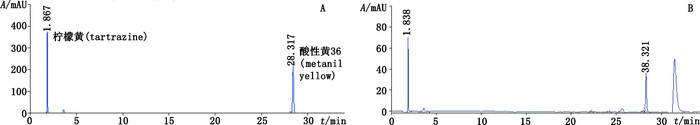
3.2 专属性的考察取对照试剂混合溶液Ⅱ、疑似含染色剂样品的供试品溶液、阴性样品溶液,分别进样,进行液相色谱的考察,结果供试品溶液呈现与柠檬黄对照试剂或酸性黄36对照试剂保留时间相同的色谱峰,阴性样品溶液未检出与2种对照试剂相同的色谱峰,见图 3。并扫描柠檬黄及酸性黄36色谱峰在200~600 nm波长范围的紫外-可见吸收光谱,见图 4。进行峰纯度检查,结果其纯度因子均在990以上,从而证明该方法符合专属性要求。
|
图 3 对照试剂混合溶液Ⅱ(A)、酸性黄36阳性样品的供试品溶液(B)、柠檬黄阳性样品的供试品溶液(C)和阴性样品溶液(D)的HPLC-DAD色谱图 Figure 3 The HPLC-DAD chromatograms of mixed solution Ⅱ of tartrazine and metanil yellow reference substances(A), test solution of positive sample dyed with metanil yellow(B), test solution of positive sample dyed with tartrazine(C)and test solution of negative samples(D) |
|
图 4 柠檬黄对照品(A)、柠檬黄阳性样品(B)和酸性黄36对照品(C)、酸性黄36阳性样品(D)HPLC-DAD色谱峰的光谱图 Figure 4 The UV spectrograms of tartrazine reference substance(A), positive sample dyed with tartrazine(B)metanil yellow reference substance(C)and positive sample dyed with metanil yellow(D) |
取不同低浓度的柠檬黄和酸性黄36的对照试剂溶液,按“3.1”项下色谱条件进行测定。以信噪比为3:1的量确定为其检测限,结果本方法能检出柠檬黄和酸性黄36的仪器检测限分别为0.46 ng和0.25 ng。
3.3.2 方法检测限的确定精密吸取不同体积的对照试剂混合溶液Ⅲ,分别置具塞锥形瓶中,减压蒸干,再精密加入蒲黄对照药材2 g,按“3.1”项下色谱条件进行测定。以信噪比为3:1的量确定为其检测限,结果本方法能检出柠檬黄和酸性黄36的方法检测限分别为0.52 ng和0.35 ng。
3.3.3 疑似检出染色样品测定取对照试剂混合溶液Ⅱ,TLC法中疑似检出柠檬黄、酸性黄36的供试品溶液及阴性样品溶液(70%乙醇),按“3.1”项下色谱条件进行HPLC-DAD测定。结果显示,4批样品中有3批(样品1、样品2、样品3)疑似检出柠檬黄,其中1批(样品3)紫外光谱图不完全相同。酸性黄36检测结果与TLC法相同,即3批(样品2、样品3、样品4)均疑似检出酸性黄36。
3.4 建立另一色谱系统对该定性方法的验证采用Agilent ZORBAX SB-C18(150 mm×4.6 mm,5 μm)色谱柱,以乙腈为流动相A,0.05 mol·L-1的乙酸铵溶液为流动相B,梯度洗脱(0~40 min,5%A→50%A,95%B→50%B),采用二极管阵列检测器,在428 nm波长处检测柠檬黄,在422 nm波长处检测酸性黄36。理论板数按柠檬黄对照试剂色谱中的主峰计算不低于3 000。
建立了不同于原流动相系统的甲醇-乙酸铵溶液流动相体系进行验证,结果与原流动相系统一致,供试品溶液呈现与柠檬黄对照试剂或酸性黄36对照试剂保留时间相同的色谱峰,见图 5。证明所建立的柠檬黄、酸性黄36 HPLC-DAD定性方法结果准确。
|
图 5 柠檬黄、酸性黄36对照试剂混合溶液Ⅱ(A)和阳性样品供试品溶液(B)HPLC-DAD色谱图 Figure 5 The HPLC-DAD chromatograms of mixed solution Ⅱ of tartrazine and metanil yellow reference substances(A)and test solution of the potential dyed sample(B) |
采用Agilent公司1290-6540飞行时间质谱仪。以乙腈-0.02 mol·L-1乙酸铵为流动相系统;质谱检测参数:装配有电喷雾离子源,扫描方式为ESI+扫描,去溶剂雾化气氮气流速9 L·min-1,喷雾压力310 kPa,雾化气温度325 ℃,毛细管电压3 500 V,碎裂电压135 V,同时进行一级质谱全扫描、二级质谱全扫描,扫描范围m/z 100~600 [13-14]。
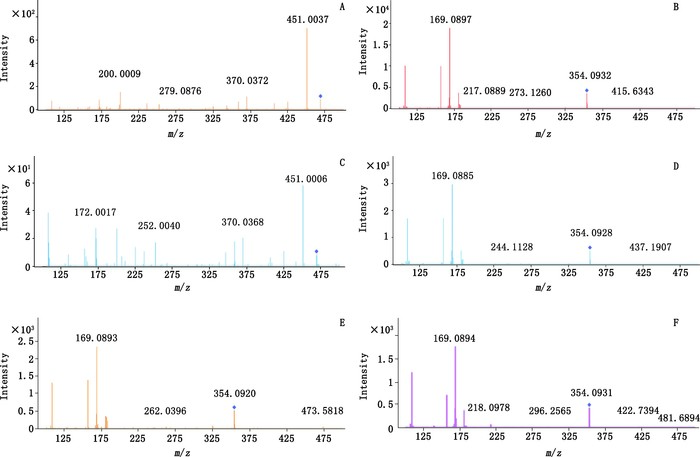
4.2 疑似检出染色样品测定取对照试剂混合溶液Ⅱ,TLC法中疑似检出柠檬黄、酸性黄36样品的供试品溶液,按“4.1”项下条件进行HPLC-MS测定,结果见表 2、图 6。在染色样品色谱中,与柠檬黄、酸性黄36相应色谱峰具有相同的质谱特征。4批样品中有1批(样品1)检出柠檬黄,3批(样品2、样品3、样品4)检出酸性黄36。
|
|
表 2 对照试剂质谱信息 Table 2 The mass information of reference substances |
|
图 6 柠檬黄对照试剂(A)、酸性黄36对照试剂(B)和4个阳性样品(C、D、E、F)离子扫描图 Figure 6 The mass spectrograms of tartrazine reference substance(A), metanil yellow reference substance(B)and 4 dyed samples(C, D, E, F) |
经TLC法、HPLC-DAD法和HPLC-MS法检测,最后确定蒲黄1批样品中检出柠檬黄,3批样品中检出酸性黄36。
本文建立了同时检查柠檬黄、酸性黄36的TLC法、HPLC-DAD法和HPLC-MS法,可用于定性检查。
6 讨论 6.1 蒲黄非法染色现状通过本项目研究,提示当前市场上的蒲黄染色情况严重,除用前几年发现的金胺O进行染色外,又出现了用柠檬黄进行染色,还首次检出酸性黄36用于药材的染色,染色依然是影响蒲黄药材及饮片质量的主要问题,且有用多种染色剂进行染色的趋势。
6.2 染色检查方法优缺点研究提示,染色的检查方法各有优缺点。TLC简便快捷,可以对大批量样品进行快速筛查;HPLC-DAD可对疑似样品做初步确认,并可以进行定量测定;而HPLC-MS可确定染色情况,从而避免假阳性的产生。
6.3 样品提取方法考察本实验参照蒲黄中金胺O检查的补充检验方法(2007007)以及西红花中多种色素检查的补充检验方法(2011001)进行,用70%乙醇进行直接提取,较为简单,快捷,实用。
6.4 HPLC-DAD方法考察HPLC-DAD法中,采用DAD检测器在200~600 nm波长范围内对供试品液中的柠檬黄和酸性黄36色谱峰进行扫描,柠檬黄最大吸收波长为258 nm,428 nm;酸性黄36最大吸收波长为270 nm、422 nm。鉴于在低波长下2种色素的测定杂质峰干扰较大,所以选择428 nm和422 nm为测定波长。实验过程中曾采用甲醇-乙酸铵溶液流动相体系,结果发现柠檬黄出峰时间基本都在3 min左右,采用乙腈-乙酸铵溶液流动相体系能够使其出峰时间较晚,故选择该体系。
6.5 建议因柠檬黄HPLC保留较弱,建议采用250 mm规格色谱柱;DAD检测以428 nm附近是否出现最大吸收峰为主要判断依据。
| [1] |
中国药典2010年版. 一部[S]. 2015: 353 ChP 2010. Vol Ⅰ[S]. 2015:353 |
| [2] |
国家食品药品监督管理局药品检验补充检验方法和检验项目批准件2011001[S]. 2011: 1 State Food and Drug Administration Inspection and Additional Testing Methods and Project Approval Documents 2011001[S]. 2011:1 |
| [3] |
符江, 荆文光, 章军, 等. 中药中非法添加问题研究现状与分析[J]. 中草药, 2014, 45(3): 437. FU J, JING WG, ZHANG J, et al. Illegally added question research present situation and the analysis in Chinese medicine[J]. Chin Tradit Herb Drugs, 2014, 45(3): 437. |
| [4] |
马晓燕. 几种合成色素的同时检测及其对细胞毒性研究[D]. 杭州: 中国计量学院, 2012 MA XY. Simultaneous Determination and Cytotoxicity of Several Synthetic Colorants[D]. Hangzhou:China Jiliang University, 2012 |
| [6] |
GB/T5009. 35-2003食品中合成着色剂的测定[S]. 2003: 1 GB/T5009. 35-2003 Determination of Synthetic Colour in Food[S]. 2003:1 |
| [7] |
杨琳, 陈青俊, 丁献荣, 等. 反相高效液相色谱法测定食品中的多种黄色工业染料[J]. 食品工业科技, 2011, 32(2): 350. YANG L, CHEN QJ, DING XR, et al. RP-HPLC determination of five kinds of yellow industrial dyes in foods[J]. Sci Technol Food Ind, 2011, 32(2): 350. |
| [8] |
姜国萍, 孙萍, 朱日然. 染色中药添加色素的检测技术研究进展[J]. 时珍国医国药, 2015, 26(3): 649. JIANG GP, SUN P, ZHU RR. The dyeing testing technology research progress of Chinese medicine adding pigment[J]. Lishizhen Med Mater Med Res, 2015, 26(3): 649. |
| [9] |
翟清, 杨志伟, 石鑫磊, 等. 染色蒲黄中柠檬黄的检测方法研究[J]. 中国医药科学, 2015, 5(19): 69. ZHAI Q, YANG ZW, SHI XL, et al. Detection method of staining in tartrazine Typhae Pollen[J]. Chin Med Pharm, 2015, 5(19): 69. |
| [10] |
胡青, 孙健, 张甦, 等. 中药中48种非法染色色素的TLC法检测[J]. 中国医药工业杂志, 2015, 46(7): 695. HU Q, SUN J, ZHANG K, et al. Simultaneous detection of 48 banned pigments in traditional Chinese medicine by TLC[J]. Chin J Pharm, 2015, 46(7): 695. |
| [11] |
杨蝉. 中药及胶囊中九种合成色素的检测方法研究[D]贵阳: 贵阳中医学院, 2014 YANG C. Detection Method Research of Nine Kinds of Synthetic Pigment in Chinese Medicine and Capsule[D]. Guiyang:Guiyang University of Chinese Medicine, 2014 |
| [12] |
翟海云, 刘振平, 余晓, 等. 高效液相色谱法测定中药中的五种禁用黄色工业染料[J]. 化学研究与应用, 2014, 26(1): 135. ZHAI HY, LIU ZP, YU X, et al. Simultaneous determination of five kinds of unallowable yellow industrial dyes in traditional Chinese medicine by HPLC[J]. Chem Res Appl, 2014, 26(1): 135. |
| [13] |
赵志磊, 吴广臣, 李小亭, 等. 高效液相色谱测定食品中非食用色素皂黄[J]. 食品工业科技, 2008, 29(6): 284. ZHAO ZL, WU GC, LI XT, et al. Determination of metanil yellow in food by HPLC[J]. Sci Technol Food Ind, 2008, 29(6): 284. |
| [14] |
饶伟文, 蒋玲, 赵纯玉, 等. 几种染色掺假中药的化工染料鉴定[J]. 药物分析杂志, 2007, 27(11): 1742. RAO WW, JIANG L, ZHAO CY, et al. Identification of chemical industry dyes in adulteration of Chinese medicinal materials[J]. Chin J Pharm Anal, 2007, 27(11): 1742. |
| [15] |
项婧. 液相色谱-质谱法测定食品中多种合成色素和染料及相应质谱库的建立[D]. 沈阳: 沈阳药科大学, 2009 XIANG J. Determination of Colorants and Dyes in Food by HPLCEMS and Establishment of a Mass Spectra Library[D]. Shenyang:Shenyang Pharmaceutical University, 2009 |
 2017, Vol. 37
2017, Vol. 37