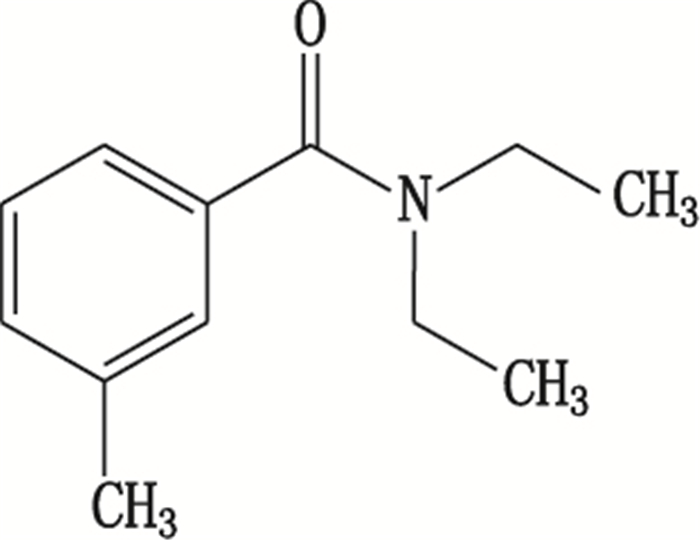
避蚊胺(DEET)化学名称为N,N-二乙基间甲苯甲酰胺(化学结构见图 1),对多种昆虫有驱避作用,是一种高效、广谱驱避剂,对蚊、蠓、蚋有良好的驱避效果,对人畜低毒,对皮肤无刺激,无变态反应,已被广泛应用[1-2]。1957年在美国注册,是国际公认的最好驱避剂[3]。
|
图 1 避蚊胺的化学结构 Figure 1 Structure of N, N-diethyl-m-toluamide |
目前避蚊胺的分析方法主要集中于气相色谱法(GC)[4-7],常用内标法,以邻苯二甲酸二乙酯、丙体六六六、正十八烷及邻苯二甲酸二丁酯作为内标物;也有利用气相色谱-质谱法(GC-MS)进行分析[2]。分析方法较为复杂,且成本高、时间长。有用高效液相色谱法(HPLC)测定驱蚊肤宁和微球中避蚊胺含量的报道[8-9],采用的是内标法[8]。国外有报道利用高效薄层色谱法(HPTLC)测定化妆品中避蚊胺的含量[10],利用HPLC法分析血浆、尿液和皮肤中的避蚊胺及其代谢产物[11-14]。而目前对于软膏中驱蚊胺的分析方法未见报道。驱蚊膏中有效成分避蚊胺的含量对其驱避时间的长短有直接影响,因此建立一种简单快捷的方法测定其中避蚊胺的含量很有必要。本研究应用反相高效液相色谱技术,首次建立了驱蚊膏中避蚊胺含量测定的方法,样品制备操作简便,快速,可用于其质量控制,具有一定参考价值。
1 仪器与试药 1.1 仪器Agilent 1260液相系统:配有G1311C四元梯度泵,G1329B自动进样器,G1316A柱温箱,G4212B DAD检测器(安捷伦公司);Alltima C18色谱柱(150 mm×4.6 mm,5 µm;填料:十八烷基硅烷键合硅胶;奥泰公司);Mettler XP-205电子天平(梅特勒公司);KQ-800KDE型超声仪(昆山市超声仪器有限公司);HH. S11-Ni2型电热恒温水浴锅(北京长安永创科学仪器有限公司);SPX-250 IC微电脑人工气候箱(上海博迅实业有限公司)。
1.2 试药甲醇为色谱纯,甲醇、盐酸、30%过氧化氢、氢氧化钠为分析纯。避蚊胺对照品[批号6F JDA-DC,纯度98%,梯希爱(上海)化成工业发展有限公司];驱蚊膏(批号:143056、129731、14209,规格:避蚊胺34.34%,3M公司)。
2 方法与结果 2.1 色谱条件色谱柱:Alltima C18(150 mm×4.6 mm,5 µm);流动相:甲醇-水(65:35);流速:0.8 mL·min-1;检测波长:210 nm;进样量:10 µL。在上述色谱条件下,避蚊胺色谱峰的理论塔板数为11 380,对称因子为1.0。
2.2 对照品溶液的制备精密称取避蚊胺对照品约1 000 mg,置于100 mL量瓶中,加入甲醇适量,超声使溶解,并用甲醇稀释至刻度,摇匀,即为对照品储备液。精密量取对照品储备液适量,分别用甲醇-水(65:35)稀释成质量浓度约为0.008、0.02、0.04、0.10、0.20 mg·mL-1的对照品溶液。
2.3 供试品溶液的制备精密称取驱蚊膏约0.15 g(约相当于避蚊胺50 mg),置25 mL量瓶中,加入甲醇适量,振摇2 min,超声(800 W,40 kHz)30 min,加甲醇稀释至刻度,摇匀,过滤,精密量取续滤液1.0 mL,置50 mL量瓶中,加甲醇-水(65:35)稀释至刻度,摇匀,经0.45 µm微孔滤膜滤过,取续滤液作为供试品溶液。
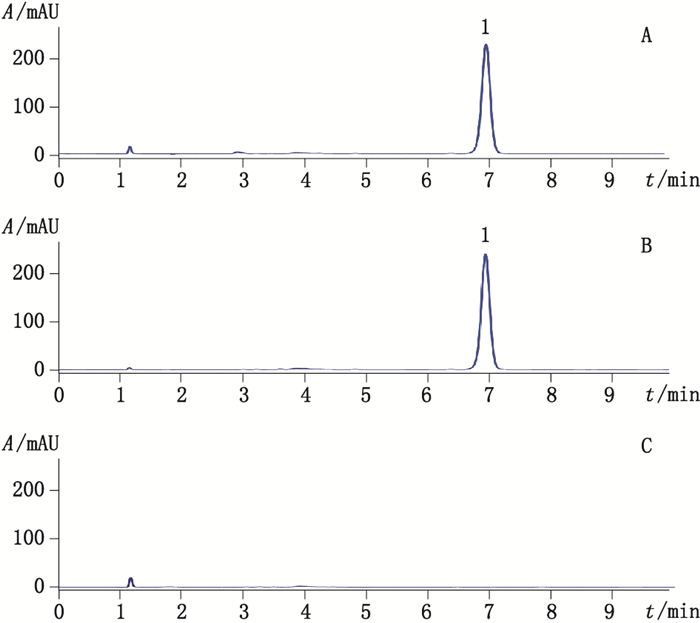
2.4 专属性试验 2.4.1 基质干扰试验按照驱蚊膏说明书提供的配方,配制不含避蚊胺的阴性空白样品,按上述方法制得阴性对照溶液。分别对避蚊胺对照品溶液、供试品溶液及阴性对照溶液进样分析。避蚊胺对照品溶液、供试品溶液和阴性对照溶液的色谱图(图 2)显示:样品中的基质不干扰避蚊胺的测定。
|
1避蚊胺(N,N-diethyl-m-toluamide) A.对照品溶液(0.039 89 mg·mL-1避蚊胺)[reference substance solution(0.039 89 mg·mL-1N,N-diethyl-m-toluamide)] B.供试品溶液(0.042 29 mg·mL-1避蚊胺)[test sample solution(0.042 29 mg·mL-1N,N-diethyl-m-toluamide)] C.阴性对照溶液(negative control solution) 图 2 高效液相色谱图 Figure 2 HPLC chromatograms |
为进一步考察方法的专属性,本研究对驱蚊膏样品,分别在加热、光照、氧化、酸化和碱化等条件下进行了强制降解实验,以排除降解产物对避蚊胺色谱峰的干扰。
2.4.2.1 热降解产物供试溶液精密称取驱蚊膏(批号143056)约0.15 g(约相当于避蚊胺50 mg),置25 mL量瓶中,80 ℃水浴加热6 h,冷却至室温后,按照“2.3”项下方法制备供试溶液,备用。
2.4.2.2 光降解产物供试溶液将上述样品置于微电脑人工气候箱中,10 000 Lux光照强度下照射6 h后,按“2.3”项下方法制备供试溶液,备用。
2.4.2.3 氧化产物供试溶液在上述样品中分别加入30%的过氧化氢溶液1 mL,放置6 h后,按“2.3”项下方法制备供试溶液,备用。
2.4.2.4 酸降解产物供试溶液在上述样品中加入1 mmol·L-1盐酸溶液1 mL,放置6 h后,用1 mmol·L-1氢氧化钠溶液中和成中性,按“2.3”项下方法制备供试溶液。
2.4.2.5 碱降解产物供试溶液在上述样品中加入1 mmol·L-1氢氧化钠溶液1 mL,放置6 h后,用1 mmol·L-1盐酸溶液中和成中性,按“2.3”项下方法制备供试溶液。
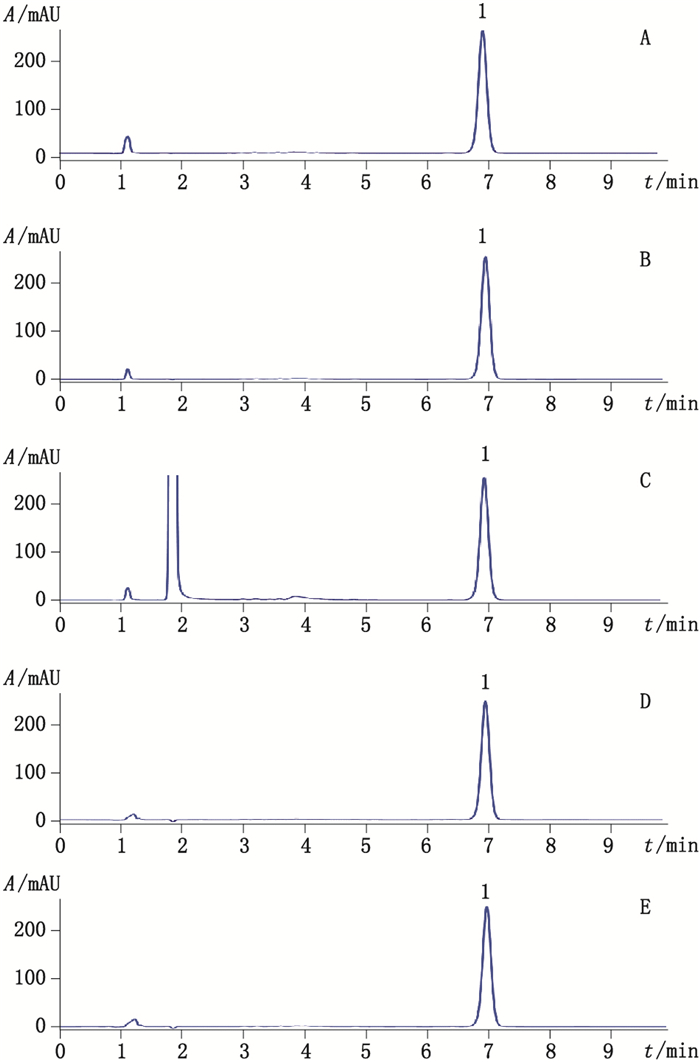
将上述各供试溶液按“2.1”项下色谱条件操作,结果表明在该色谱条件下,驱蚊膏样品在上述各条件下均未检测到降解产物(图 3),并且与未进行强制降解试验的供试品溶液相比,避蚊胺色谱峰峰面积未发生明显变化,说明驱蚊膏中的有效成分避蚊胺及辅料在加热、光照、氧化、酸化和碱化等条件下均较稳定,在各强制降解试验条件下不干扰避蚊胺色谱峰。
|
1.避蚊胺(N,N-diethyl-m-toluamide) A.热降解(0.046 32 mg·mL-1避蚊胺)[heat degradation(0.046 32 mg·mL-1N,N-diethyl-m-toluamide)] B.光降解(0.045 11 mg·mL-1避蚊胺)[photodegradation(0.045 11 mg·mL-1 N,N-diethyl-m-toluamide)] C.氧化降解(0.044 99 mg·mL-1避蚊胺)[oxidation degradation(0.044 99 mL-1N,N-diethyl-m-toluamide)] D.酸降解(0.043 07 mg·mL-1避蚊胺)[acid degradation(0.043 07 mL-1N,N-diethyl-m-toluamide)] E.碱降解(0.043 69 mg·mL-1避蚊胺)[alkali degradation(0.043 69 mg·mL-1 N,N-diethyl-m-toluamide)] 图 3 驱蚊膏样品强制降解产物色谱图 Figure 3 Chromatograms of forcedly degraded mosquito repellent ointment samples |
分别精密吸取“2.2”项下各浓度对照品溶液10 µL注入液相色谱仪,按上述色谱条件测定,记录峰面积,以避蚊胺的质量浓度(mg·mL-1)对峰面积进行线性回归,得线性方程:
| $ Y{\rm{ = 57}}\;{\rm{821}}X{\rm{ + 16}}{\rm{.554}}\;\;r{\rm{ = 0}}{\rm{.999}}\;{\rm{9}} $ |
线性范围0.008~0.200 g·L-1。
将对照品溶液逐级稀释后,进样测定;以信噪比(S/N)约为3.0时的浓度为检测限,信噪比(S/N)约为10.0时的浓度为定量限,避蚊胺的检测限和定量限分别为0.040 µg·mL-1和0.080 µg·mL-1。
2.6 精密度试验取同一份供试品溶液,按已确定的色谱条件连续进样测定6次,避蚊胺峰面积的RSD(n=6)为0.05%,表明本方法精密度良好。
2.7 稳定性试验取批号143056的样品制成的供试品溶液分别于0、2、4、8、12、24 h测定峰面积,计算其RSD(n=6)为0.18%,表明供试品溶液在24 h内稳定性良好。
2.8 重复性试验精密称取同一批号的样品(批号143056)6份,按照已确定的方法制得供试品溶液,分别进样测定,结果避蚊胺的平均含量(n=6)为34.62%,RSD为1.7%,表明方法的重复性良好。
2.9 加样回收率试验精密称取样品(批号143056)9份,分成3组,每组3份,各组分别精密加入对照品储备液4、5、6 mL(分别相当于样品中避蚊胺含有量的80%,100%,120%),按照“2.3”项下方法制得各加样供试溶液,进样测定,计算加样回收率和RSD,结果见表 1。
|
|
表 1 加样回收率试验结果(n=3) Table 1 The recoveries of N, N-diethyl-m-toluamide |
应用本文建立的方法对3批驱蚊膏进行测定,结果见表 2。
|
|
表 2 驱蚊膏中避蚊胺的含量(%) Table 2 Contents of N, N-diethyl-m-toluamide in the mosquito repellent ointment |
本实验室在前期初步研究中,采用紫外-可见分光光度法,在200~300 nm范围内分别对对照品溶液和供试品溶液进行扫描,避蚊胺的紫外谱图在210 nm处有最大吸收,因而选择210 nm作为检测波长;考察了甲醇-水(65:35)、甲醇-0.1%磷酸溶液(60:40)作为流动相对避蚊胺色谱峰的影响,发现避蚊胺色谱峰的理论塔板数和对称因子无明显差异,为操作简便,选择甲醇-水(65:35)作为流动相;考察了0.8 mL·min-1和1.0 mL·min-1不同流速的影响,结果流速为0.8 mL·min-1时避蚊胺色谱峰的理论板数较高,样品中的基质不干扰避蚊胺的测定,避蚊胺的保留时间适宜,为6.99 min,方便样品数量较多时的分析检测,缩短分析周期。
3.2 提取溶剂的选择考察了用无水乙醇、甲醇、甲醇-水(65:35)、磷酸-60%甲醇(1:1 000)提取样品,发现用磷酸-60%甲醇(1:1 000)时提取率较低,提取不完全,用甲醇、甲醇-水(65:35)的提取率无明显差异,但是用甲醇-水(65:35)提取时溶液过滤困难,实验效率低,不易操作,用无水乙醇提取时避蚊胺色谱峰的峰形对称性较差。用甲醇提取样品能提取完全,且软膏中的基质不干扰样品测定,过滤容易,避蚊胺色谱峰对称性好,故最终选择用甲醇作为提取溶剂。
3.3 样品稀释溶剂的选择考察了用甲醇提取样品,第2步稀释时采用甲醇、甲醇-水(65:35)为稀释溶剂时的影响,发现用甲醇-水(65:35)稀释时避蚊胺色谱峰的理论塔板数较高、对称因子为1.0,能与流动相匹配,故选择用甲醇-水(65:5)作为样品稀释溶剂。
3.4 方法学验证强制降解试验在方法学验证中非常重要,本实验参照国际通行的ICH方法学验证原则[15-16],对强制降解试验进行了系统研究。驱蚊膏样品在加热、光照、氧化、酸化和碱化等条件下均较为稳定,未检测到降解产物,不会对避蚊胺含量测定结果产生影响。
3.5 测定方法的探讨虽然已有关于避蚊胺分析方法的文献报道,但大多是采用气相色谱法,需要选择合适的内标物,分析方法较为复杂、成本高、时间长。有少数用高效液相色谱法测定驱蚊肤宁和微球中避蚊胺含量的方法,基质为溶液,采用的是内标法,目前对于软膏中避蚊胺的分析方法尚未见报道,软膏基质脂溶性比例较高,其分析方法较溶液更为复杂。本研究采用反相高效液相色谱技术,首次建立了驱蚊膏中避蚊胺含量测定的方法,该方法样品制备及分析方法简单、快速、实用,可在10 min之内完成对样品的分析检测。经方法学考察,精密度、重复性、稳定性、加样回收率均良好,基质无干扰,适用于驱蚊膏中避蚊胺含量的准确测定,为质量控制提供科学依据。
| [1] |
郑剑, 陈超. 3种驱避剂驱蚊效果的评价研究[J]. 中华卫生杀虫药械, 2010, 16(5): 342. |
| [2] |
张大伟, 陶波. 避蚊胺气相色谱-质谱联用分析研究[J]. 现代农药, 2012, 11(4): 34. |
| [3] |
刘士军, 谭伟龙. 4种避蚊胺驱蚊剂型实验室和现场驱蚊效果观察[J]. 中华卫生杀虫药械, 2009, 15(2): 104. |
| [4] |
毕富春, 王文丽. 驱蚊胺气相色谱法分析[J]. 农药, 1988, 27(6): 25. |
| [5] |
李洁, 姜志宽. 气相色谱法分析避蚊胺(deet)原油含量[J]. 卫生杀虫药械, 1996, 2(4): 33. |
| [6] |
李洁, 张应阔, 姜志宽, 等. 昆虫驱避剂DEET乳剂的气相色谱分析[J]. 卫生杀虫药械, 1996, 2(2): 24. |
| [7] |
马宏安, 王效义, 尤洪涛. 昆虫驱避剂驱蚊肤宁的气相色谱分析[J]. 卫生杀虫药械, 1999, 5(1): 14. |
| [8] |
王效义, 尤洪涛, 马宏安, 等. 昆虫驱避剂驱蚊肤宁的高效液相色谱分析[J]. 中国媒介生物学及控制杂志, 1999, 10(5): 349. |
| [9] |
高静, 高申. 避蚊胺微球载药量的HPLC测定[J]. 中国医药工业杂志, 2005, 36(9): 572. |
| [10] |
MARKOVIC G, AGBABA D, STAKIC DZ, et al. Determination of some insect repellents in cosmetic products by high-performance thinlayer chromatography[J]. J Chromatogr A, 1999, 847(1-2): 365. DOI:10.1016/S0021-9673(99)00029-1 |
| [11] |
KASICHAYANULA S, HOUSE JD, WANG T, et al. Simultaneous analysis of insect repellent DEET, sunscreen oxybenzone and five relevant metabolites by RP HPLC with UV detection:Application to an in vivo study in a piglet model[J]. J Chromatogr B, 2005, 822(1): 271. |
| [12] |
ABU-QARE AW, ABOU-DONIA MB. Simultaneous determination of malathion, permethrin, DEET(N, N-diethyl-m-toluamide), and their metabolites in rat plasma and urine using high performance liquid chromatography[J]. J Pharm Biomed, 2001, 26(2): 291. DOI:10.1016/S0731-7085(01)00407-1 |
| [13] |
BAYNES RE, YEATTS JL, RIVIERE JE. Analysis of N, N-diethyl-m-toluamide in porcine skin perfusates using solid-phase extraction disks and reversed-phase high-performance liquid chromatography[J]. J Chromatogr B, 2002, 780(1): 45. DOI:10.1016/S1570-0232(02)00412-9 |
| [14] |
JUN HW, QIU HC. Solid-phase extraction and liquid chromatographic quantitation of insect repellent N, N-diethyl-m-toluamide in plasma[J]. J Pharm Biomed, 1996, 15(2): 241. DOI:10.1016/0731-7085(96)01828-6 |
| [15] |
ICH-Q2A Text on Validation of Analytical Procedures[S]. 1995
|
| [16] |
ICH-Q2B Validation of Analytical Procedures:Methodology[S]. 1996 http://www.mendeley.com/catalog/validation-analytical-procedures-methodology/
|
 2017, Vol. 37
2017, Vol. 37 
