2. 贵州省食品药品检验所, 贵阳 550004;
3. 贵州医科大学, 贵阳 550004;
4. 中国食品药品检定研究院, 北京 100050
2. Guizhou Provincial of Food and Drug Inspection Institute, Guiyang 550004, China;
3. Guizhou Medical University, Guiyang 550004, China;
4. National Institute For Food and Drug Control, Beijing 100050, China
贵州土大黄为蓼科酸模属植物尼泊尔酸模(Rumex nepalensis Spreng.)、齿果酸模(Rumex dentatus Linn.)或羊蹄(Rumex crispus Linn.)的新鲜或干燥根及根茎。主产于湖北、陕西、贵州、云南等地[1],土大黄中主要含有蒽醌、黄酮、奈和萘酚以及二苯乙烯等化合物,其中蒽醌类以大黄素、大黄酚和大黄素甲醚含量较高[2]。土大黄具有抗菌消炎,抗氧化,止血,抗肿瘤等功效[3-4],根提取物对正常小鼠非特异性免疫功能(单核-巨噬细胞系统吞噬功能)有一定影响[5],主要用于银屑病、出血证、跌打损伤、紫癜等疾病的治疗[6-9]。土大黄现在用于乙肝散、肝乐欣胶囊、肤痔清软膏、止血片等制剂的制备,应用比较广泛。目前,对土大黄药材的质量控制仅见于《贵州省中药材、民族药材质量标准》2003年版,现行标准中仅有外观性状描述、显微鉴别及简单的薄层鉴别和含量测定[10-11],专属性不强,可控性差。为了有效地控制土大黄的质量,本文参考相关资料[12],对本品中的游离蒽醌与总蒽醌(以大黄素、大黄酚和大黄素甲醚的总量计)含量进行了测定,为科学应用本品提供参考。
1 仪器与试药 1.1 仪器岛津公司LC-20AD高效液相色谱仪(SPD-M20A二极管阵列检测器、CBM-20A系统控制器、CTO-20AC柱温箱、LC-20AT泵、SIL-20A自动进样器、LC2000色谱数据工作站),迪马科技有限公司Diamonsil C18(4.6 mm×200 mm,5 μm;填料:十八烷基硅烷键合硅胶)色谱柱;天津市泰斯特仪器有限公司DK-98-11A型电热恒温水浴锅,梅特勒-托利多仪器有限公司XS205型电子分析天平,上海宗义实业发展有限公司0.45 μm微孔滤膜。
1.2 试药大黄素对照品(批号110756-200110)、大黄酚对照品(批号110796-200615)、大黄素甲醚对照品(批号110758-200611)购于中国食品药品检定研究院。
土大黄药材共31批,采集于贵州省花溪平桥、清镇、小关以及罗甸等地,均由贵阳中医学院陈德媛研究员鉴定为尼泊尔酸模(Rumex nepalensis Spreng.)、齿果酸模(Rumex dentatus Linn.)和羊蹄(Rumex crispus Linn.),其中9批样品未鉴定品种。
甲醇、乙腈为色谱纯,其余试剂均为分析纯。水为重蒸馏水。
2 方法与结果 2.1 色谱条件与系统适用性试验色谱柱:Diamonsil C18(4.6 mm×200 mm,5 μm);流动相:甲醇-0.1%磷酸溶液(83:17);流速:1.0 mL·min-1;检测波长:254 nm;柱温:30 ℃;进样量:10 μL。
分别取空白溶剂(甲醇)、混合对照品溶液和供试品溶液注入液相色谱仪,记录色谱图,见图 1;从图中可见,空白溶剂在大黄素、大黄酚和大黄素甲醚位置处无干扰峰,供试品溶液中大黄素、大黄酚和大黄素甲醚峰与其他组分分离完全(分离度>1.5),理论板数按大黄素峰计算不低于4 000。
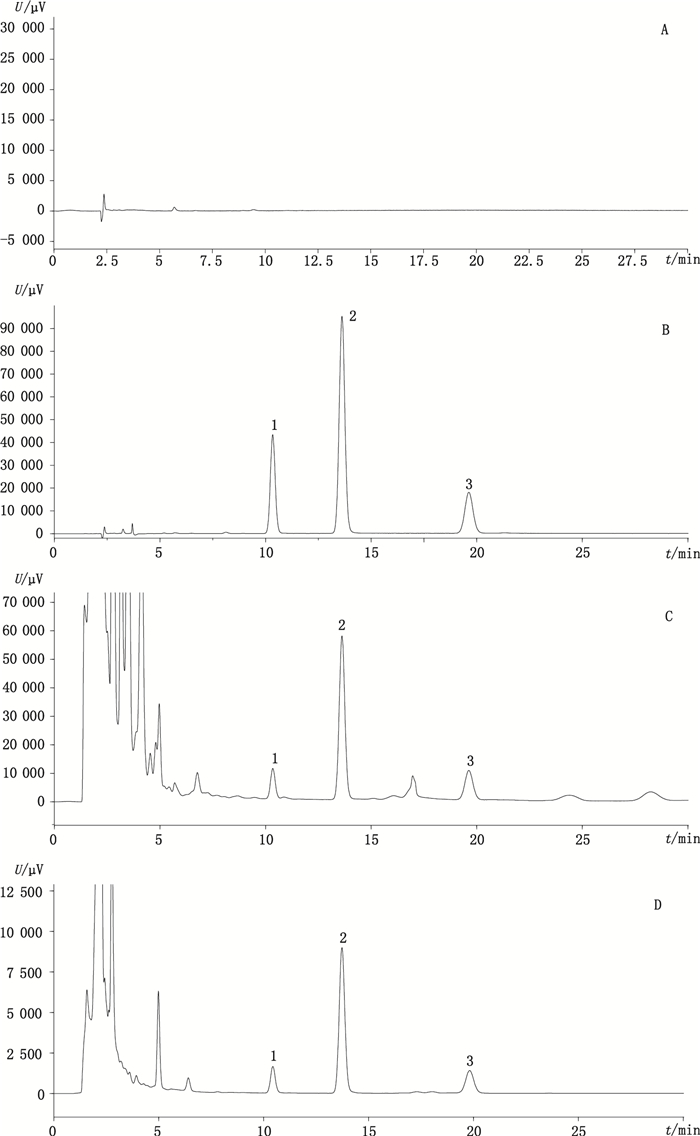
|
1.大黄素(emodin)2.大黄酚(chrysophanol)3.大黄素甲醚(ararobinol) 图 1 混合对照品及26号土大黄样品的HPLC图谱 Figure 1 HPLC chromatograms of mixed reference substances and Rumex sample No. 26 |
精密称定大黄素对照品0.024 17 g,置100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,制得大黄素对照品储备液(0.241 7 mg·m-1);精密称定经五氧化二磷干燥至恒重的大黄酚对照品0.018 06 g,置100 mL量瓶中,加氯仿-甲醇(1:4)溶解并稀释至刻度,摇匀,制得大黄酚对照品储备液(0.180 6 mg·m-1);精密称定经五氧化二磷干燥至恒重的大黄素甲醚对照品0.018 47 g,置100 mL量瓶中,加氯仿-甲醇(2:3)溶解并稀释至刻度,摇匀,制得大黄素甲醚对照品储备液(0.184 7 mg·m-1)。
2.3 供试品溶液制备 2.3.1 游离蒽醌供试品溶液取本品粉末(过4号筛)约0.6 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,称量,加热回流80 min,放冷,再称量,用甲醇补足减失的量,摇匀,滤过,取续滤液,即得。
2.3.2 总蒽醌供试品溶液取本品粉末(过4号筛)约0.2 g,精密称定,置具塞锥形瓶中,精密加入甲醇-盐酸(10:0.3)25 mL,称量,置80 ℃水浴中加热回流60 min,放冷,再称量,用甲醇-盐酸(10:0.3)补足减失的量,摇匀,滤过,取续滤液,即得。
2.4 标准曲线的制备分别精密量取“2.2”项下大黄素、大黄酚及大黄素甲醚的对照品储备液适量,置于同一25 mL量瓶中,加甲醇稀释至刻度,制成每1 mL含大黄素、大黄酚和大黄素甲醚分别为19.34、36.12、14.78 μg的混合对照品溶液。分别精密吸取该混合对照品溶液0.5、1、3、9、15、21、27 μL,注入液相色谱仪,记录色谱图,以峰面积为纵坐标,对照品质量浓度为横坐标,绘制标准曲线,得大黄素,大黄酚,大黄素甲醚的线性回归方程:
| $ \begin{align} & Y\text{=3}\text{.523}\times \text{1}{{\text{0}}^{\text{6}}}X\text{-5}\text{.205}\times \text{1}{{\text{0}}^{\text{3}}}\ \ r\text{=0}\text{.999}\ \text{9} \\ & Y\text{=5}\text{.005}\times \text{1}{{\text{0}}^{\text{6}}}X\text{-1}\text{.129}\times \text{1}{{\text{0}}^{\text{4}}}\ \ r\text{=0}\text{.999}\ \text{9} \\ & Y\text{=3}\text{.249}\times \text{1}{{\text{0}}^{\text{6}}}X\text{-1}\text{.728}\times \text{1}{{\text{0}}^{\text{4}}}\ \ r\text{=0}\text{.999}\ \text{9} \\ & \\ \end{align} $ |
结果表明,大黄素,大黄酚,大黄素甲醚进样量分别在9.670~522.2、18.06~975.2、7.390~399.1 ng范围内与峰面积呈良好的线性关系。
2.5 精密度试验取“2.4”项下的混合对照品溶液,按“2.1”项下条件连续进样6次。计算大黄素、大黄酚和大黄素甲醚峰面积的RSD分别为0.38%、0.42%、0.71%,表明仪器精密度良好。
2.6 重复性试验取26号样品,分别按“2.3.1”和“2.3.2”项下方法平行制备6份供试品溶液,按“2.1”项下条件进样测定。计算游离蒽醌中大黄素、大黄酚和大黄素甲醚的平均含量分别为0.017%、0.086%、0.033%,RSD分别为1.8%、1.5%、2.0%;总蒽醌中大黄素、大黄酚和大黄素甲醚的平均含量分别为0.085%和0.408%、0.136%,RSD分别为1.8%、1.4%、1.8%,表明该方法的重复性良好。
2.7 稳定性试验取26号样品,分别按“2.3.1”和“2.3.2”项下方法制备供试品溶液各1份,分别于供试品溶液制备后0、4、8、12、16、24 h按“2.1”项下条件测定,计算游离蒽醌中大黄素、大黄酚和大黄素甲醚峰面积的RSD分别为0.73%、0.27%、0.61%,总蒽醌中大黄素、大黄酚和大黄素甲醚峰面积的RSD分别为1.4%、0.78%、1.4%,说明游离蒽醌和总蒽醌的供试品溶液在24 h内稳定性良好。
2.8 加样回收率试验精密称取已知含量(大黄素、大黄酚和大黄素甲醚的含量分别为0.017%、0.086%、0.033%)的26号土大黄样品0.3 g共6份,分别置具塞锥形瓶中,精密加入大黄素、大黄酚和大黄素甲醚混合对照品溶液(分别精密量取“2.2”项下中大黄素、大黄酚及大黄素甲醚的对照品储备液适量,置于同一25 mL量瓶中,加甲醇稀释至刻度,摇匀,即得质量浓度分别为10.63、6.36、8.127 μg·mL-1的混合对照品溶液)25 mL,按“2.3.1”项下方法制备供试溶液,按“2.1”项下条件进样测定,计算游离蒽醌的回收率。结果见表 1。
|
|
表 1 土大黄中游离蒽醌的加样回收率试验 Table 1 Recovery of free anthraquinones |
精密称取已知含量(大黄素、大黄酚和大黄素甲醚的含量分别为0.085%、0.408%、0.136%)的26号土大黄样品0.1 g共6份,分别置具塞锥形瓶中,精密加入大黄素、大黄酚和大黄素甲醚混合对照品溶液(分别精密量取“2.2”项下中大黄素、大黄酚及大黄素甲醚的对照品储备液适量,置于同一25 mL量瓶中,加甲醇稀释至刻度,既得质量浓度分别为16.44、15.89、12.56 μg·mL-1的混合对照品溶液)25 mL,按“2.3.2”项下方法制备供试溶液,按“2.1”项下条件测定,计算总蒽醌的回收率。结果见表 2。
|
|
表 2 土大黄中总蒽醌的加样回收率试验 Table 2 Recovery of total anthraquinones |
取31批不同产地的土大黄,按“2.3.1”和“2.3.2”项下方法制备供试品溶液,按“2.1”项下条件进样测定,采用外标一点法计算土大黄中游离蒽醌和总蒽醌含量后,再计算结合蒽醌含量(总蒽醌含量-游离蒽醌含量)以及结合蒽醌与游离蒽醌的比值,结果见表 3。
|
|
表 3 样品含量测定结果(n=2) Table 3 Determination results |
比较氯仿、甲醇、水作为提取溶剂,通过研究选择甲醇作为提取溶剂;比较了超声和加热回流提取方法,通过研究证明加热回流方法更好;通过对比加热回流时间20、40、60、80和100 min的提取效果,最后选择了加热回流80 min的时间。
3.2 总蒽醌提取方法的研究比较了氯仿-盐酸和甲醇-盐酸作为总蒽醌的水解提取溶剂,结果表明甲醇-盐酸作为水解提取液更好;试验过程中考察了不同酸度的甲醇-盐酸水解提取液,分别考察了(10:0.05)、(10:0.1)、(10:0.3)、(10:0.6)和(10:0.9)水解提取液,结果表明水解提取液为甲醇-盐酸(10:0.3)时,总蒽醌可水解完全,故选择甲醇-盐酸(10:0.3)为总蒽醌供试品溶液的水解提取液。通过对比加热回流时间20、40、60、80和100 min的水解提取效果,最后采用了加热回流60 min的时间。
3.3 样品含量测定结果分析羊蹄样品中结合蒽醌的含量是游离蒽醌含量的1.58~12.36倍,花溪平桥的羊蹄中结合蒽醌的含量高于清镇、小关等地,可能是因为花溪平桥的环境比较潮湿而且是在阳光充沛的环境,在湿润而又阳光充沛的地理环境下土大黄中结合蒽醌含量更高。结果说明,土大黄同种不同产地中结合蒽醌和游离蒽醌的含量差异很大,且结合蒽醌的含量均大于游离蒽醌的含量。
齿果酸模样品中结合蒽醌的含量是游离蒽醌的1.39~2.11倍,4个不同产地中蒽醌含量差别不是很大。尼泊尔酸模,仅有2批药材,有待做进一步的研究。未鉴定品种的9批样品中结合蒽醌的含量是游离蒽醌的0.56~3.59倍。31批样品中共有4批样品的结合蒽醌含量小于游离蒽醌含量。
3.4 结论羊蹄和齿果酸模中结合蒽醌含量均大于游离蒽醌含量,且结合蒽醌含量最高的是产于花溪和清镇的羊蹄,齿果酸模和尼泊尔酸模次之。土大黄提取物可以调节肠道蠕动,导致泻下的是结合蒽醌类成分,游离蒽醌类化合物促进腹泻的活性很弱[13-15],故在临床应用中,建议选取花溪和清镇产的羊蹄作为以泻下作用为功效的药材。本试验的方法准确,可靠,为土大黄药材的质量控制提供了科学依据。
| [1] |
曾建飞. 中国植物志[M]. 北京: 科学出版社, 2004, 162. ZENG JF. Flora of China[M]. Beijing: Science Press, 2004, 162. |
| [2] |
张燕, 李治建, 夏木西努尔·肖盖提, 等. 土大黄化学成分及药理作用研究进展[J]. 中药药理与临床, 2012, 83(3): 173. ZHANG Y, LI ZJ, XIAMUXINVER·XGT, et al. Research progress on chemical constituents and pharmacological effects of Rumex L[J]. Pharmacol Clin Chin Mater Med, 2012, 83(3): 173. |
| [3] |
刘红淼, 李艳玲, 杨继章, 等. 土大黄的药理作用及临床应用研究进展[J]. 中国药房, 24, 15(15): 1422. LIU HM, LI YL, YANG JZ, et al. Research progress on pharmacological action and clinical application of Rumex L[J]. Chin Pharm, 24, 15: 1422. |
| [4] |
热比姑丽·伊斯拉木, 斯拉甫·艾白. 土大黄研究进展[J]. 科技导报, 2013, 31(30): 67. REBIGULI·YSLM, SILAPU·AB. Research progress of Rumex L[J]. Sci Technol Rev, 2013, 31(30): 67. DOI:10.3981/j.issn.1000-7857.2013.30.010 |
| [5] |
尤力都孜·买买提, 阿布都吉力力·阿布都艾尼, 热比姑丽·伊斯拉木. 土大黄根提取物对小鼠非特异性免疫功能的影响[J]. 中国药业, 2016, 26(10): 18. YOULIDUZI·MMT, ABUDUJIELILI·ABUDUAINI, RBGL·YSLM. Effects of Rumex L. root extract on non-specific immune function of mice[J]. China Pharm, 2016, 26(10): 18. |
| [6] |
热比姑丽·伊斯拉木, 曼尔丹·尼牙孜, 尤力都孜·买买提, 等. 土大黄不同提取物对银屑病小鼠模型的作用[J]. 西北药学杂志, 2015, 30(1): 47. REBIGULI·YSLM, MANERDAN·NYZ, YOULIDUZI·MMT, et al. Effect of different extracts of Rumex L on the mouse psoriasis model[J]. Northwest Pharm J, 2015, 30(1): 47. |
| [7] |
艾克拜尔·安扎尔, 夏木西努尔·肖盖提, 热比姑丽·伊斯拉木, 等. 土大黄对实验性银屑病的作用[J]. 中药药理与临床, 28, 1(1): 107. AIKEBAIER·AZE, XIAMUXINVER·XIAOGAOTI, REBIGULI·YSLM, et al. Effect of Rumex L. on experimental psoriasis[J]. Pharmacol Clin Chin Mater Med, 28, 1: 107. |
| [8] |
傅正良, 牛广斌, 王丽芳. 论大黄、山大黄及土大黄的临床应用[J]. 光明中医, 2008, 23(9): 1354. FU ZL, NIU GB, WANG LF. The clinical application of Rhei Radix et Rhizoma, Rheum rhaponticum and Rumex L[J]. Guangming TCM, 2008, 23(9): 1354. |
| [9] |
果艳凤, 王会丽. 大黄与土大黄的鉴别及应用[J]. 河北中医, 2010, 32(10): 1546. GUO YF, WANG HL. Identification and application of Rhei Radix et Rhizoma and Rumex L[J]. Hebei J TCM, 2010, 32(10): 1546. DOI:10.3969/j.issn.1002-2619.2010.10.060 |
| [10] |
王世清, 麻秀萍, 万明香, 等. 贵州土大黄的品种鉴定与含量测定[J]. 中药材, 2004, 27(10): 725. WANG SQ, MA XP, WAN MX, et al. Identification and content determination of Rumex L. in Guizhou[J]. J Tradit Chin Med, 2004, 27(10): 725. DOI:10.3321/j.issn:1001-4454.2004.10.009 |
| [11] |
高晨曦, 王世清, 洪迪清, 等. 贵州土大黄的品种鉴定研究[J]. 中药材, 2007, 30(5): 523. GAO CX, WANG SQ, HONG DQ, et al. Study on the identification of Rumex L. varieties in Guizhou[J]. J Tradit Chin Med, 2007, 30(5): 523. |
| [12] |
中国药典2015年版. 一部[S]. 2015: 23 ChP 2015. Vol Ⅰ[S]. 2015:23 |
| [13] |
严孝金, 冯天师, 王玉刚. 从化学、药效和毒性角度比较认识正品大黄与土大黄[J]. 中国中药杂志, 2014, 39(19): 3876. YAN XJ, FENG TS, WANG YG. Comparison of Radix et Rhizoma Rhei and Rumex from the aspects of chemistry, efficacy and toxicity[J]. China J Chin Mater Med, 2014, 39(19): 3876. |
| [14] |
GHOSH L, GAYEN JR, MURUGESAN T, et al. Evaluation of purgative activity of roots of Rumex nepalensis[J]. Fitoterapia, 2003, 74(4): 372. DOI:10.1016/S0367-326X(03)00063-7 |
| [15] |
FAIRBAIRN JW. The active constituents of the vegetable purgativescontaining anthracene derivatives[J]. J Pharm Pharmacol, 1949, 1(10): 683. |
 2017, Vol. 37
2017, Vol. 37 
