2. 中药品质评价北京市重点实验室, 北京 100102
2. Beijing Key Laboratory for Quality Evaluation of Traditional Chinese Medicine, Beijing 100102, China
中药鸡骨草(Abri Herba)为豆科植物广州相思子Abrus cantoniensis Hance的干燥全株,其性凉,味甘、微苦,归肝、胃经,有利湿退黄,清热解毒,疏肝止痛的功效[1]。鸡骨草最早出自《岭南采药录》,1977年被收入中国药典,在我国主要分布在广东、广西等地,并为两广的道地药材[2]。鸡骨草中的生物碱类和黄酮类是其主要活性成分[3],之前的研究主要集中在生物碱,黄酮类的研究还比较少。夏佛塔苷和新西兰牡荆苷2是鸡骨草中的主要黄酮碳苷。夏佛塔苷在鸡骨草中含量较高,是许多中草药和中成药制剂质量控制的重要指标[4-10]。新西兰牡荆苷2具有抗炎、抗氧化[11]、抗痉挛[12]、抗CC14[13]损伤作用及抗前列腺癌作用[14]。在2015年版中国药典中,鸡骨草只有定性鉴别,没有含量测定项,不利于鸡骨草的质量控制,因此,本文选择相思子碱、下箴刺桐碱、新西兰牡荆苷2、夏佛塔苷4个活性成分,首次建立UPLC同时测定4种成分含量的方法,为鸡骨草药材的质量控制提供新的依据,有利于鸡骨草进一步的研究和开发。
1 仪器与材料 1.1 仪器Waters Acquity UPLC H-Class超高效液相色谱仪,Waters Empower3色谱工作站,含四元梯度泵、自动进样器、紫外检测器(Waters公司);ACQUITY UPLC HSS T3 C18色谱柱(100 mm×2.1 mm,1.8 μm;填料:高强度硅胶键合十八烷基硅烷;Waters公司);MS105DU分析天平(Mettler Toledo公司);DK-98-1型电热恒温水浴锅(天津市泰斯特仪器有限公司)。
1.2 材料对照品相思子碱(批号PS160511-01)、下箴刺桐碱(批号PS13101403)、新西兰牡荆苷2(批号PS13071901)、夏佛塔苷(批号PS13031802)购自成都普思生物科技有限公司,供含量测定用;乙腈、甲醇均为色谱纯,甲酸为色谱纯,水为屈臣氏纯净水。5批不同产地的鸡骨草信息见表 1,由广西药用植物园提供,并由北京中医药大学中药学院杨遥君副教授鉴定为广州相思子Abrus cantoniensis Hance的干燥全草。
|
|
表 1 梯度洗脱程序 Table 1 Gradient elution program |
采用ACQUITY UPLC HSS T3 C18(2.1 mm×100 mm,1.8 μm)色谱柱,ACQUITY UPLC柱在线过滤器,以乙腈(A)-0.2%甲酸溶液(B)为流动相,梯度洗脱(表 1),流速0.3 mL·min-1,检测波长270 nm,柱温30 ℃,进样量2 μL;各峰分离度均大于1.5,理论塔板数均大于10 000。对照品及广西钦州样品色谱图见图 1。
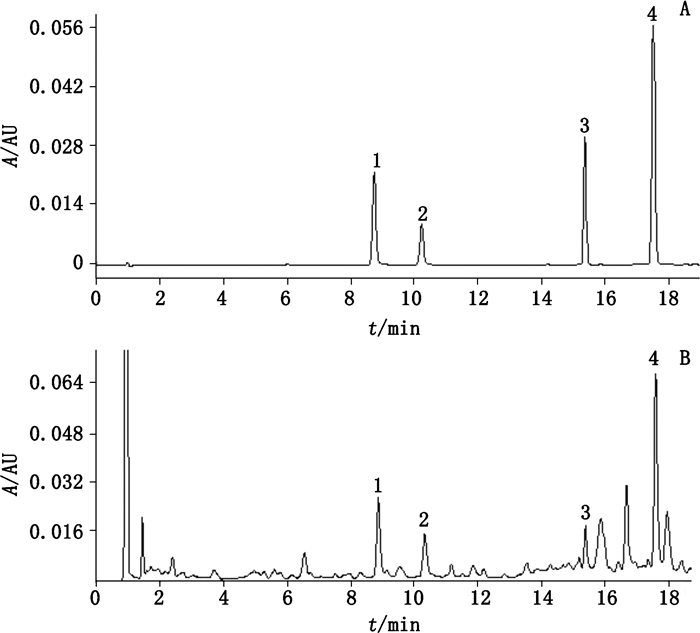
|
1.相思子碱(abrine)2.下箴刺桐碱(hypaphorine)3.新西平牡荆苷2.(vicenin-2)4.夏佛塔苷(schaftoside) 图 1 对照品(A)和鸡骨草样品(B)UPLC图 Figure 1 UPLC chromatogram of reference substance(A)and Abri Aerba(B) |
鸡骨草干燥全草粉碎过40目筛,取约1 g,精密称定,置圆底烧瓶内,加70%甲醇100 mL,回流加热2 h,提取液浓缩至干,用70%的甲醇溶解并转移至10 mL量瓶中,加70%甲醇定容至刻度,摇匀,过0.22 μm滤膜,取续滤液作供试品溶液。
2.3 对照品储备液及混合对照品溶液的制备精密称取相思子碱、下箴刺桐碱、新西兰牡荆苷2、夏佛塔苷的对照品适量,分别以70%甲醇超声(功率200 W,频率100 kHz)溶解并定容,制得相思子碱、下箴刺桐碱、新西兰牡荆苷2、夏佛塔苷的质量浓度分别为102.0、68.80、54.0、109.2 μg·mL-1的对照品储备液;分别精密量取各对照品储备溶液5 mL,置20 mL量瓶中,加甲醇稀释至刻度,即得混合对照品溶液。
2.4 线性关系考察分别精密量取各对照品储备液0.5、1.0、2.0、3.0、4.0、5.0 mL,加70%甲醇定容至5 mL,按“2.1”项下色谱条件测定,以对照品质量浓度为横坐标,峰面积值为纵坐标进行线性回归,回归方程、相关系数及线性范围见表 2。
|
|
表 2 线性关系实验结果 Table 2 Linearity |
取混合对照品溶液,按“2.1”项下色谱条件进样测定,48 h内每间隔6 h测定1次,记录峰面积,分别计算相思子碱、下箴刺桐碱、新西兰牡荆苷2、夏佛塔苷峰面积的RSD分别为0.45%、0.39%、0.40%、0.40%。结果表明混合对照品溶液在48 h内稳定性良好。
2.6 精密度试验取混合对照品溶液,按“2.1”项下色谱条件连续进样6次,分别计算相思子碱、下箴刺桐碱、新西兰牡荆苷2、夏佛塔苷峰面积的RSD分别为0.28%、0.31%、0.24%、0.23%。结果表明仪器精密度良好。
2.7 重复性试验取广西钦州样品粉末,精密称定,按“2.2”项下的方法平行制备6份供试品溶液,按“2.1”项下色谱条件进行UPLC分析,结果相思子碱、下箴刺桐碱、新西兰牡荆苷2、夏佛塔苷含量平均值(n=6)分别为23.12、17.25、6.65、45.30 μg·g-1,RSD分别为1.6%、2.5%、3.4%、3.6%,表明方法的重复性较好。
2.8 加样回收率试验取同一批已知含量的鸡骨草样品约0.5 g,精密称定6份(0.498 8 g、0.498 6 g、0.499 2 g、0.499 8 g、0.501 3 g、0.500 3 g),分别精密加入一定量相思子碱、下箴刺桐碱、新西兰牡荆苷2、夏佛塔苷对照品溶液,按“2.2”项下方法制成供试溶液,按“2.1”项下色谱条件进样测定,计算加样回收率,结果见表 3。
|
|
表 3 加样回收率试验结果 Table 3 Recovery |
取5批不同产地鸡骨草药材适量,按“2.2”项下方法制备供试品溶液,在“2.1”项色谱条件下进行测定,采用回归方程法计算结果见表 4。
|
|
表 4 鸡骨草中4种成分的含量测定结果(n=3,μg·g-1) Table 4 Contents of the 4 chemical markers in the samples |
实验过程中对供试品溶液的制备方法进行了考察:精密称取鸡骨草粉末约1.0 g,分别考察了超声提取、索氏提取、回流提取3种提取方法,结果表明超声提取法所得到的供试品溶液中待测4种成分含量特别低;而索氏提取和回流提取比较,回流所得到的供试品溶液中,待测成分含量更高,提取更完全,因此选择回流提取。实验考察了纯甲醇、80%甲醇、70%甲醇、50%甲醇作为提取溶剂,结果表明70%甲醇提取效率最高,因此最终选择70%甲醇回流提取法作为提取最佳条件。
3.2 色谱柱的选择本实验考察了Waters的ACQUITY UPLC HSS T3 C18(2.1 mm×100 mm,1.8 μm)、ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)和Agilent UPLC SB C18(2.1 mm×100 mm,1.8 μm)3款色谱柱,结果表明,在相同条件下,UPLC HSS T3柱能够使4个待测成分达到基线分离,并且峰形更好,柱效更高。待测4种成分的出峰时间都比较靠前,属于极性较大的物质,而ACQUITY UPLC HSS T3柱是极性分析专用柱,与100%水相完全兼容,在反相条件下对极性化合物的保留显著增强,由此可见HSS T3柱是本实验待测成分分离的最佳选择。
3.3 流动相的选择本实验比较了甲醇-纯水、乙腈-纯水、甲醇-0.1%甲酸水、乙腈-0.1%甲酸水、甲醇-0.2%甲酸水、乙腈-0.2%甲酸水,结果表明,有机相种类影响较大,用乙腈分离较好,流动相pH影响也比较大,加0.2%甲酸调节pH后,峰形更对称,更好。因此选择乙腈-0.2%甲酸水为流动相。
3.4 检测波长的选择利用PDA检测器在210~400范围内扫描,发现相思子碱和下箴刺桐碱的最大吸收波长均为219 nm和278 nm,夏佛塔苷和新西兰牡荆苷2的最大吸收波长均为225、270、333 nm,分别尝试了以上波长,结果表明在270 nm处4种成分都有较好吸收,基线平稳且杂质干扰较少,因此选择270 nm作为检测波长。
3.5 建立方法的意义不同产地的鸡骨草中相思子碱和下箴刺桐碱的含量适中,变化不太大,新西兰牡荆苷2的含量普遍较低,夏佛塔苷的含量变化较大。2015年版中国药典中,鸡骨草的鉴别以相思子碱为对照,可能与其在不同产地药材中的含量比较稳定有关。黄酮碳苷具抗炎、抗菌、抗病毒、保护心血管[4]及对CCl4和半乳糖胺诱导的肝脏毒性具有保护作用等[15-16],最近有学者[17]研究了鸡骨草中的新西兰牡荆苷2和夏佛塔苷,发现其具有显著的抗氧化活性并可以抵抗酒精引起的胃溃疡,在预防和治疗胃溃疡方面有很大的潜力,可见二者的药理活性不容忽视。本文对新西兰牡荆苷2和夏佛塔苷进行含量测定,为鸡骨草的研究及开发利用提供了新思路、新方向。
3.6 小结本文建立了同时测定鸡骨草中的相思子碱、下箴刺桐、新西兰牡荆苷2、夏佛塔苷含量的UPLC方法,考察了提取方法和色谱条件,选出最佳提取方法和条件,方法学考察表明,重复性、稳定性、精密性和加样回收试验均符合中国药典相关标准[18],且药典中目前还没有含量测定项,此方法可以为全面评价鸡骨草药材的质量提供参考,更希望能为药典修订提供参考。
| [1] |
中国药典2015年版. 一部[S]. 2015: 194 ChP 2015. Vol Ⅰ[S]. 2015:194 |
| [2] |
白隆华, 董青松, 蒲瑞翎. 中药鸡骨草研究概况[J]. 广西农业科学, 2005, 36(5): 476. BAI LH, DONG QS, PU RL. Study on Chinese medicine chickenbone herba[J]. Guangxi Agric Sci, 2005, 36(5): 476. |
| [3] |
程瑛琨, 陈勇, 王璐, 等. 正交设计优选鸡骨草总黄酮和总生物碱的提取工艺[J]. 西北药学杂志, 2007, 22(2): 61. CHENG YK, CHEN Y, WANG L, et al. Optimal extracting conditions for total flavonoids and total alkaloids in chicken-bone herba with orthogonal design[J]. Northwest Pharm J, 2007, 22(2): 61. |
| [4] |
吴新安, 赵毅民. 天然黄酮碳苷及其活性研究进展[J]. 解放军药学学报, 2005, 21(2): 135. WU XA, ZHAO YM. Study on natural flavonoid C-glycosides and their activity[J]. Pharm J Chin PLA, 2005, 21(2): 135. |
| [5] |
龚金炎, 吴晓琴, 张英. 碳苷黄酮及其药理活性研究进展[J]. 天然产物研究与开发, 2010, 22(3): 525. GONG JY, WU XQ, ZHANG Y. Advanced research of flavonoid C-glycosides and their pharmacological effects[J]. Nat Prod Res Dev, 2010, 22(3): 525. |
| [6] |
黄劲通. HPLC法测定石淋通颗粒中夏佛塔苷的含量[J]. 中国医药指南, 2012, 10(36): 445. HUANG JT. HPLC method for determination of schaftosie in stone spray flux particles[J]. Guid China Med, 2012, 10(36): 445. DOI:10.3969/j.issn.1671-8194.2012.36.338 |
| [7] |
唐海明, 陈建南, 张扬. HPLC法同时测定不同来源溪黄草药材中8个水溶性成分的含量[J]. 药物分析杂志, 2015, 35(2): 228. TANG HM, CHEN JN, ZHANG Y, et al. Simultaneous determination of eight water-soluble compositions in Isodon serra from different origins by HPLC[J]. Chin J Pharm Anal, 2015, 35(2): 228. |
| [8] |
张扬, 唐海明, 黎爱, 等. 狭基线纹香茶菜水溶性总黄酮中6种碳苷黄酮的含量测定和抗肿瘤活性研究[J]. 中国中药杂志, 2015, 40(8): 1543. ZHANG Y, TANG HM, LI A, et al. Determination of six C-glycoside flavones and antitumor activity of water-soluble total flavonoids from Isodon lophanthoides var. gerardianus[J]. China J Chin Mater Med, 2015, 40(8): 1543. |
| [9] |
卢琴. 线纹香茶菜中咖啡酸、新西兰牡荆苷2、异夏佛塔苷的含量动态变化研究[J]. 中国药房, 2015, 26(30): 4271. LU Q. Study on the dynamic content changes of caffeic acid, vicenin-2 and isoschaftoside in Rabdosia lophanthoides[J]. China Pharm, 2015, 26(30): 4271. DOI:10.6039/j.issn.1001-0408.2015.30.34 |
| [10] |
周子力, 肖峰, 杨静, 等. RP-HPLC同时测定广金钱草中的vicenin-1、夏佛塔苷和vicenin-3[J]. 华西药学杂志, 2013, 28(6): 609. ZHOU ZL, XIAO F, YANG J, et al. Determination of vicenin-1, schaftoside and vicenin-3 in Desmodium styracifolium by RP-HPLC[J]. West China J Pharm Sci, 2013, 28(6): 609. |
| [11] |
GOBBO-NETO L, SANTOS MD, KANASHIRO A, et al. Evaluation of the anti-inflammatory and antioxidant activities of di-Cglucosylflavones from Lychnophora ericoides(Asteraceae)[J]. Planta Med, 2005, 71(1): 3. DOI:10.1055/s-2005-837742 |
| [12] |
VERSPOHL EJ, FUJⅡ H, HOMMA K, et al. Testing of Perilla frutescens extract and Vicenin 2 for their antispasmodic effect[J]. Phytomedicine, 2013, 20(5): 427. DOI:10.1016/j.phymed.2012.12.018 |
| [13] |
MARRASSINI C, DAVICINO R, ACEVEDO C, et al. Vicenin-2, a potential anti-inflammatory constituent of Urtica circularis[J]. J Nat Prod, 2011, 74(6): 1503. DOI:10.1021/np100937e |
| [14] |
WADA S, HE P, WATANABE N, et al. Suppression of D-galactosamineinduced rat liver injury by glycosidic flavonoids-rich fraction from green tea[J]. Biosci Biotechnol Biochem, 1999, 63(3): 570. DOI:10.1271/bbb.63.570 |
| [15] |
ORHAN DD, ASLAN M, AKTAY G, et al. Evaluation of hepatoprotective effect of Gentiana olivieri herbs on subacute administration and isolation of active principle[J]. Life Sci, 2003, 72(20): 2273. DOI:10.1016/S0024-3205(03)00117-6 |
| [16] |
HOFFMANN-BOHM K, LOTTER H, SELIGMANN O, et al. Antihepatotoxic C-glycosylflavones from the leaves of Allophyllus edulis var. edulis and gracilis[J]. Planta Med, 1992, 58(6): 544. DOI:10.1055/s-2006-961546 |
| [17] |
LI H, SONG ZJ, DAI YP, et al. Antioxidative activity of flavonoids from Abrus cantoniensis against ethanol-induced gastric ulcer in mice[J]. Planta Med, 2015, 81(10): 784. DOI:10.1055/s-00000058 |
| [18] |
中国药典2015年版. 四部[S]. 2015: 9101 ChP 2015. Vol Ⅳ[S]. 2015:9101 |
 2017, Vol. 37
2017, Vol. 37 
