吡罗昔康是昔康类非甾体消炎镇痛药,广泛用于类风湿性关节炎、骨关节炎、急性痛风等疾病,对痛经、牙痛、术后疼痛、骨骼肌肉疾病和运动损伤等引起的疼痛有很好的镇痛效果[1]。目前已不再作为首选药物使用[2]。吡罗昔康原料及片剂质量标准收载于中国药典2015年版二部[3],BP 2015[4]及JP 16[5]亦有收载。据文献报道[6],吡罗昔康至少存在PⅠ、PⅡ和PM这3种晶型,吡罗昔康的不同晶型可通过不同溶剂重结晶而得到[7]。从吡罗昔康原料生产厂家提供的资料及文献[8]了解,目前吡罗昔康原料合成工艺使用了重结晶工艺。由于药物的晶型与药品质量等特性相关[9-12],鉴于目前吡罗昔康片在我国的使用率仍较高(2015年国家抽验评价在全国31个省市均能抽到样品),且目前对吡罗昔康晶型与疗效等的关系研究较少,故本文参照仿制药晶型研究的技术指导原则[13]及药品晶型研究及晶型质量控制指导原则[14]拟使用红外光谱、粉末X-射线衍射、差示扫描量热分析测定吡罗昔康原料的晶型,通过近红外光谱,利用相关系数模型快速筛查吡罗昔康片的原料晶型,考察晶型与溶出度的关系等,为吡罗昔康的质量控制提供科学依据。
1 样品、试药和仪器、方法 1.1 样品、试药吡罗昔康原料及片剂均来自2015年国家抽验评价收集到的样品,其中原料来自3个原料生产厂家共7批,吡罗昔康片来自于14个制剂厂家共138批。样品信息见表 1、2。实验中使用的溴化钾为光谱纯,水为纯化水,其余试剂均为分析纯。
|
|
表 1 吡罗昔康原料信息 Table 1 Piroxicam raw material information |
|
|
表 2 吡罗昔康片剂信息表 Table 2 Information sheet for piroxicam tablets |
仪器:德国Bruker XRD Phaser 2型粉末X射线衍射仪。测定条件:CuKα辐射,石墨单色器,管压40 kV,管流40 mA,扫描范围6~45°,扫描时间0.2 s,步长0.05°,发散狭缝0.6 mm,接收狭缝8 mm。
1.3 傅里叶红外光谱(FTIR)分析仪器:美国Thermo Nicolet FT-IR 6700傅立叶变换红外光谱仪,溴化钾压片法测定,扫描范围为4 000~400 cm-1。
1.4 差示扫描量热(DSC)分析仪器:美国TA Q200差示扫描量热仪。测定条件:氮气流50 mL·min-1,40 μL铝坩埚,升温速率为5 ℃·min-1,升温范围45~250 ℃。
1.5 近红外建模快速筛查原料和片剂的晶型仪器:德国布鲁克Matrix-F,测定光谱时所用仪器的自检方法(XPM)与SFDA的药品检验XPM一致,光谱扫描范围为12 000~4 000 cm-1,分辨率为8 cm-1,扫描次数32次。
1.6 原料固有溶出速率的测定参照美国药典 < 1087 > 中原料溶出速率的测定[15],使用普通口服固体制剂溶出度实验技术指导原则[16]中溶出介质条件开展原料固有溶出速率测定工作。仪器:富科思FODT-101光纤药物溶出度实时测定仪;溶出介质:水、pH 4.0醋酸盐缓冲液(参照溶出度一致性评价指导原则中的相关方法介质配制)、pH 1.0盐酸溶液、pH 6.8磷酸盐缓冲液(参照美国药典配制),介质体积700 mL;压模规格:直径8 mm;压模条件:压力150 kg,每次压2 min,压3次;溶出条件:转盘法,转速300 r·min-1,温度37.0 ℃;检测波长:水355 nm,醋酸盐362 nm,pH 1.0盐酸溶液335 nm,磷酸盐354 nm;参比波长:550 nm;探头规格:1 mm;对照品溶液质量浓度:用相应介质制成32 μg·mL-1;记录时间1 200 min。
1.7 片剂溶出速率的测定仪器:富科思FODT-601FX光纤溶出度测定仪,中国药典2015年版第二法(桨法);介质:水900 mL;转速50 r·min-1,温度37.0 ℃;测定波长335 nm;参比波长550 nm;测定时间点:5、10、15、30、45、60 min,探头规格:2 mm;对照品溶液浓度:11 μg·mL-1。
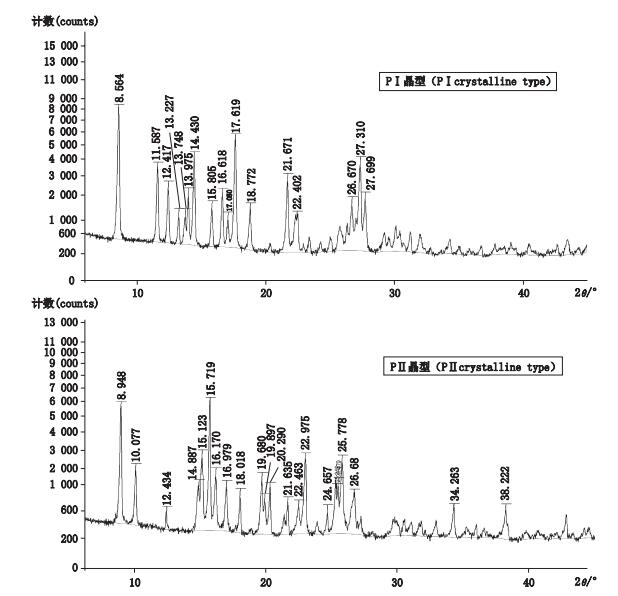
2 结果 2.1 粉末X射线衍射分析采用粉末X射线衍射法对7批吡罗昔康原料测定分析,通过与参考文献[6]对比,6批为PⅠ晶型,1批为PⅡ晶型。结果见图 1,表明,PⅠ和PⅡ晶型样品的粉末X射线衍射图存在明显差异:PⅠ晶型的特有2θ角峰为11.587°、13.227°、17.619°、18.772°、27.310°、27.699°,PⅡ晶型的特有2θ角峰为10.077°、19.680°、19.897°、20.290°、22.976°、34.263°、38.222°。
|
图 1 吡罗昔康粉末X射线衍射分析图谱 Figure 1 PXRD spectrograms of piroxicam |
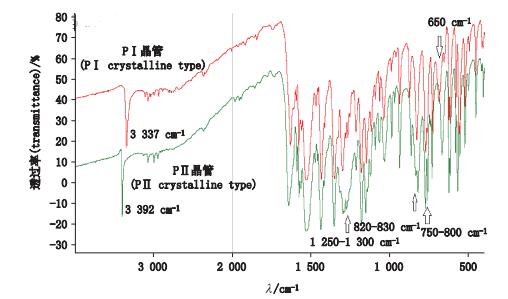
2种晶型样品的测定图谱见图 2,表明两晶型在4 000~440 cm-1内的吸收峰位置及强度存在差异:PⅠ晶型样品峰3 337 cm-1、1 250~1 300 cm-1为较尖锐峰,820~830 cm-1为单峰;PⅡ晶型样品峰3 392 cm-1、1 250~1 300 cm-1为较钝峰,820~830 cm-1为双峰,750~800 cm-1两峰相对强度与PⅠ不同;PⅠ晶型在650 cm-1,PⅡ晶型在630 cm-1各有一峰
|
图 2 吡罗昔康傅里叶红外光谱图谱 Figure 2 FTIR spectrograms of piroxicam |
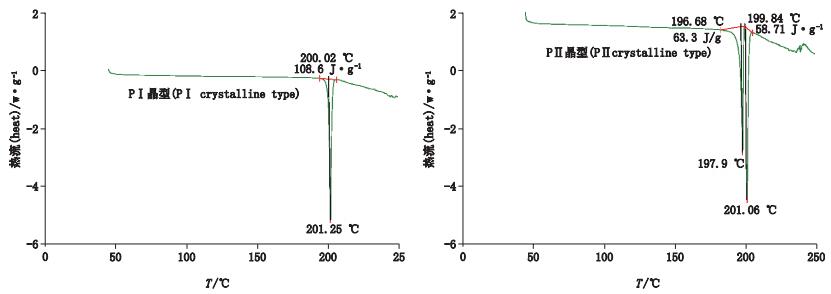
PⅠ晶型和PⅡ晶型的差示扫描量热分析曲线也明显不同(图 3),PⅠ晶型为单吸热峰,峰顶点温度201.25 ℃,熔融焓108.6 J·g-1;PⅡ晶型为2个吸热峰,峰顶点温度分别为197.90、201.06 ℃,熔融焓为63.31、58.71 J·g-1。
|
图 3 吡罗昔康差示扫描量热图谱 Figure 3 DSC spectrograms of piroxicam |
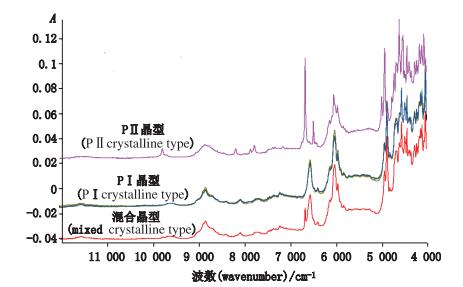
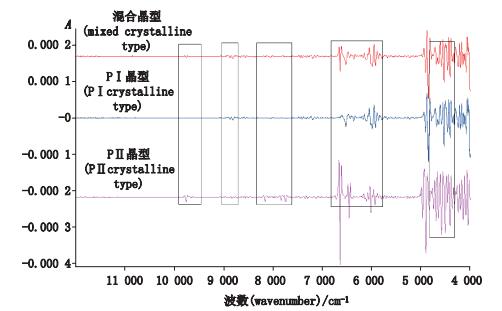
结合原料的X射线衍射图谱,利用OPUS软件对7批吡罗昔康原料进行聚类分析,确认1批为PⅡ晶型;5批为PⅠ晶型;1批原料光谱兼有2种晶型的特征峰,以PⅠ晶型特征峰为主,其性质特点也接近PⅠ晶型样品,推测该批原料为在PⅠ晶型中混有少部分PⅡ晶型的样品。原料红外测定图谱见图 4。原料二阶导数处理图谱见图 5,不同晶型光谱经二阶导数处理后在9 900~9 600、9 200~8 700、8 300~7 600、6 850~6 300、4 900~4 450 cm-1处看到明显差异。
|
图 4 吡罗昔康原料近红外光谱图 Figure 4 NIR spectrograms of piroxicam |
|
图 5 吡罗昔康原料近红外光谱图(经二阶导数处理) Figure 5 NIR spectrograms of piroxicam(processed by the second derivative) |
经过比较吡罗昔康原料、片剂的近红外图谱,结合吡罗昔康原料晶型研究的结果,可将吡罗昔康片的NIR图谱大致分为3类:A类为使用PⅠ晶型原料的制剂,B类为使用PⅡ晶型原料的制剂,C类为使用混晶原料的片剂。3类图谱片剂与原料共同特征谱段见表 3。
|
|
表 3 吡罗昔康原料和片剂的共同特征谱段 Table 3 Common characteristic spectrum of piroxicam and its tablets |
鉴于图谱明显的峰形差异,用相关系数法,建立2个模型配合筛查制剂中的原料晶型,建模参数见表 2。
模型的验证:用剩余企业的样品去验证模型的可靠性,结果显示,采用混晶原料以及PⅠ晶型的样品,在6 700~6 600 cm-1处都有1个小峰,模型1能够成功筛选出来;而模型2则能够成功识别PⅡ晶型的药物。因此,可以看出这2个模型质量很好,能准确识别样品的晶型。
利用以上2个模型,对138批片剂进行区分,预测结果表明:使用PⅠ晶型原料的片剂有109批,使用PⅡ晶型原料的片剂有10批,使用混晶原料的片剂有19批。
2.5 原料固有溶出速率的测定经测定,来自同一厂家生产的不同晶型原料固有溶出速率曲线见图 6,结果表明,PⅠ晶型溶出速率小于PⅡ晶型。
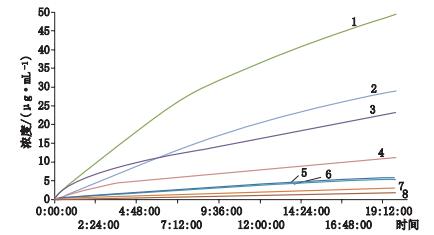
|
PⅡ晶型(crystalline type PⅡ):1.磷酸盐缓冲液(phosphate buffer)2.0.1 mol·L-1盐酸溶液(hydrochloric acid solution)5.醋酸盐缓冲液(acetate buffer)6.水(water) PⅠ晶型(crystalline type PⅠ):3.磷酸盐缓冲液(phosphate buffer)4.0.1 mol·L-1盐酸溶液(hydrochloric acid solution)7.水(water)8.醋酸盐缓冲液(acetate buffer) 图 6 吡罗昔康原料固有溶出速率溶出曲线图谱 Figure 6 Profile of intrinsic dissolution rate of different crystallinetype of piroxicam |
|
|
表 4 吡罗昔康片相关系数模型参数 Table 4 Parameters of correlation coefficient model of piroxicam tablets |
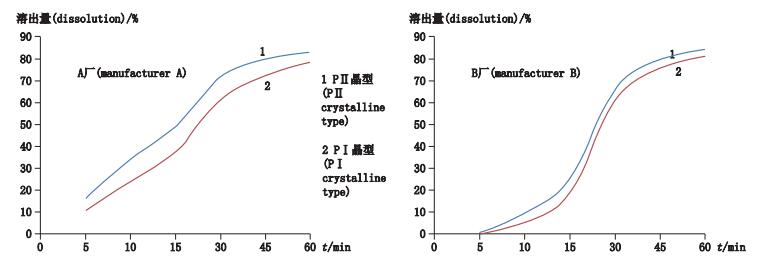
根据近红外光谱筛选结果,对A(山西省临汾健民制药厂)、B(上海金不换兰考制药有限公司)厂的PⅠ、PⅡ晶型原料的片剂各3批测定溶出曲线,将各晶型的测定结果取均值后绘制时间-溶出量曲线图,见图 7;结果表明PⅠ晶型片剂溶出速率小于PⅡ晶型,A厂两晶型之间的差距大于B厂,具体见表 5,原因可能与B厂的处方中使用了十二烷基硫酸钠、聚山梨酯80等表面活性剂的助溶作用有关。
|
图 7 不同晶型片剂溶出曲线图谱 Figure 7 dissolution profile map of different crystalline types of tablets |
在实验过程中,发现中国食品药品检定研究院提供的吡罗昔康对照品(批号100177-200603)与对照图谱(药品红外光谱集第一卷(1995))188图)不一致,对照品为PⅠ晶型,对照图谱为PⅡ晶型;中国药典2015年版吡罗昔康红外光谱鉴别仍规定与对照的图谱(药品红外光谱集第一卷(1995)188图)一致;而BP 2015[4]及JP 16[5]红外图谱的鉴别项中均规定应与对照品图谱一致,如有差异,样品和对照品分别用二氯甲烷溶解,于水浴上蒸干后试验;故建议中国药典进行修订。
|
|
表 5 不同晶型片剂溶出度测定结果(%) Table 5 The test results of dissolution of different crystalline types of piroxicam tablets |
在对吡罗昔康原料药的残留溶剂进行研究时,发现1批晶型为PⅡ的原料药中检出一类溶剂1,2-二氯乙烷。利用上述模型对138批吡罗昔康片的预测结果,对10批使用PⅡ晶型原料的片剂及19批使用混晶原料的片剂进行残留溶剂测定并使用气质联用法进行确证。方法:使用公司安捷伦6890N气相色谱仪(配备安捷伦5975C质谱检测器、安捷伦化学工作站、COLINTECH顶空进样装置),DB-225毛细管柱(30 m×0.25 mm×0.25 μm);柱温:程序升温(40 ℃维持2 min,以2 ℃·min-1的升温速率升至70 ℃,再以60 ℃·min-1升温速率升至200 ℃维持3 min);进样口温度:210 ℃;分流比:10:1;载气:氮气,流速1.0 mL·min-1;顶空瓶平衡温度及平衡时间:90 ℃,30 min;进样量:1.0 mL;离子源温度:230 ℃;四极杆温度:150 ℃;质子进样口温度:280 ℃;1,2-二氯乙烷特征离子:m/z 62、49、98、27。对照品溶液:使用二甲基亚砜配制质量浓度为0.26、0.52、1.30、2.60、3.90 μg·mL-1的溶液,即得,精密量取1 mL置于20 mL顶空瓶中,加盖密封;原料供试品溶液:取吡罗昔康原料0.1 g,置于20 mL顶空瓶中,加入二甲基亚砜1.0 mL,加盖密封,摇匀,即得;片剂供试品溶液:取相当于吡罗昔康50 mg的药品粉末,置于20 mL顶空瓶中,加入二甲基亚砜1.0 mL,加盖密封,摇匀,即得。结果使用PⅡ晶型原料的片剂中均检出一类溶剂1,2-二氯乙烷,使用混晶原料的片剂中有3批检出1,2-二氯乙烷,检测结果较好地验证了近红外模型的筛查结果。
3.3 结论本文经使用X射线衍射等方法测定,确定了目前市场上使用的吡罗昔康原料存在PⅠ、PⅡ 2种晶型,主要为PⅠ晶型。将PⅠ晶型与PⅡ晶型进行比较,固有溶出速率较低,熔点较高,说明PⅠ晶型应为吡罗昔康的稳定型晶型。本文的研究为吡罗昔康的质量控制提供了科学依据。
| [1] |
徐积恩, 刘松林. 昔康(Oxicam)类非甾体消炎镇痛药的现状和动向[J]. 药学进展, 1992, 16(1): 20. XU JN, LIU SL. Situation and trends of non-steroidal antiinflammatory analgesicof meloxicam(Oxicam)[J]. Prog Pharm Sci, 1992, 16(1): 20. |
| [2] |
国家食品药品监督管理局修订吡罗昔康全身给药制剂说明书[J]. 中国药事, 2009, 23(3): 213 Revised instructions for systematic adminstration of piroxicamloy the stute food and drug udminstration. [J]. Chin Pharm Aff, 2009, 23(3):213 |
| [3] |
中国药典2015年版. 二部[S]. 2015: 469 ChP 2015. Vol Ⅱ[S]. 2015:469 |
| [4] |
BP 2015. Vol Ⅱ[S]. 2015:603
|
| [5] |
JP 16[S]. 2011:1261
|
| [6] |
刘巍. 固体核磁技术在药物多晶型研究中的作用[D]. 兰州: 兰州大学化学化工学院, 2011 LIU W. Structural Studies of Polymorphs of Pharmaceutical Compound Using Solid-State NMR Spectroscopy[D]. Lanzhou: College of Chemistry and Chemical Engineering, Lanzhou University, 2011 |
| [7] |
赵会英, 苏德森, 胡愈, 等. 吡罗昔康多晶型的制备及其热稳定性[J]. 沈阳药科大学学报, 2000, 17(2): 101. ZHAO HY, SU DS, HU Y, et al. Preparation and thermal stability of the crystalline form of piroxicam[J]. J Shenyang Pharm Univ, 2000, 17(2): 101. |
| [8] |
付金广. 吡罗昔康工艺的改进[J]. 山东化工, 2013, 42(9): 19. FU JG. Improvement of piroxicam synthesis[J]. Shandong Chem Ind, 2013, 42(9): 19. |
| [9] |
陈桂良, 李君婵, 彭兴盛, 等. 药物晶型及其质量控制[J]. 药物分析杂志, 2012, 32(8): 1503. CHEN GL, LI JC, PENG XS, et al. Drug polymorphism and its quality control[J]. Chin J Pharm Anal, 2012, 32(8): 1503. |
| [10] |
陈华, 赵文, 毛睿, 等. 2种晶型利福平制剂之间溶出曲线的差异[J]. 药物分析杂志, 2013, 33(5): 881. CHEN H, ZHAO W, MAO R, et al. Differences of dissolution profiles between two crystalline types of fixed dose combinations of rifampin[J]. Chin J Pharm Anal, 2013, 33(5): 881. |
| [11] |
王建, 曾红霞, 陈悦. 罗红霉素晶型分析与溶解速率、溶出度的关系[J]. 中国现代应用药学, 2013, 30(10): 1094. WANG J, ZENG HX, CHEN Y. Relationship of roxithromycin crystal types, dissolution rates and dissolution[J]. Chin J Mod Appl Pharm, 2013, 30(10): 1094. |
| [12] |
郝甜媛, 刘欢, 陈常青. 晶型转化对药物稳定性的影响研究进展[J]. 现代药物与临床, 2013, 28(3): 457. HAO TY, LIU H, CHEN CQ. Advances in study on influence of crystal transformation on drug stability[J]. Chin J Mod Appl Pharm, 2013, 28(3): 457. |
| [13] |
仿制药晶型研究的技术指导原则[EB/OL]. [2009-6] [2015-8-16]. http://www.cde.org.cn/guide.do?method=showGuide&id=210 Technical Guidelines for the Study of Generic Drug Crystal Forms[EB/OL].2009-6[2015-8-16].http://www.cde.org.cn/guide.do?method=showGuide&id=210 |
| [14] |
中国药典2015年版. 四部[S]. 2015: 371 ChP 2015.Vol Ⅳ[S].2015:371 |
| [15] |
USP 34-NF 29[S].2011:609
|
| [16] |
普通口服固体制剂溶出度试验技术指导原则[EB/OL]. [2015-2-5] [2015-8-15] Technical Guidelines for Dissolution Testing of Common Oral Solid Preparations[EB/OL].2015-2-5[2015-8-15].http://www.cde.org.cn/zdyz.do?method=largePage&id=236 |
 2017, Vol. 37
2017, Vol. 37 