2. 大连工业大学国家海洋食品工程技术研究中心, 大连 116034
2. National Engineering Research Center of Seafood, Dalian Polytechnic University, Dalian 116034, China
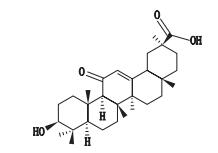
甘草为豆科植物甘草Glycyrrhiza uralensis Fisch.、胀果甘草Glycyrrhiza inflata Bat.或光果甘草Glycyrrhiza glabra L.的干燥根及根茎[1],具有补脾益气、祛痰止咳、清热解毒、缓急止痛、调和药性等功效[2],在临床上有着广泛的使用。虽然曾经有报道称甘草中含有多种黄酮类化合物、三萜化合物以及多种生物碱和有机酸,然而现代药理学研究表明,甘草主要有效成分甘草酸经胃酸水解为甘草次酸进入小肠[3],所以甘草次酸才是甘草最终发挥药效的活性成分。甘草次酸(glycyrrhetinic acid,GA)又名甘草亭酸,是一种五环三萜类化合物(见图 1),具有广泛的生物活性,包括抗炎[4-8]、抗溃疡[9]、抗过敏[10-11]、抗病毒[7, 12-13]、保肝[14]、抗肿瘤[15-16]等。
|
图 1 甘草次酸的化学结构 Figure 1 Chemical structure of glycyrrhetinic acid |
然而,甘草次酸存在着水中溶解度低的缺陷,以致生物利用度低下,大大限制了其在医药行业中的应用。因此,目前国内外市售的与甘草次酸相关的制剂中大多含有的是甘草次酸衍生物,如甘珀酸钠胶囊、胃仙U片等。合成甘草次酸衍生物只是解决甘草次酸水溶性差的一种手段,考虑到衍生物药效及副作用,从根本上解决甘草次酸溶解度问题才是关键。本文利用乳化法将甘草次酸粒径减小到纳米级,大大提高了水溶性。
1 仪器与设备WG500CY型连续式实验室乳化机(上海路诺流体设备制造有限公司);AH-100D型高压均质机(上海ATS工业系统有限公司);Scientz-18N型冷冻干燥机(宁波新芝生物科技股份有限公司);S4800扫描电镜(Hitachi公司);ZetaPALS激光粒度仪(布鲁克海文仪器公司);2795型高效液相色谱仪(Waters公司);Dikma钻石二代色谱柱(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶;迪马科技有限公司)。
2 材料与试剂甘草次酸由上海融禾医药科技有限公司提供,纯度为98%以上。三氯甲烷、乙醇为色谱纯,甘露醇为分析纯。
3 实验方法 3.1 甘草次酸粗乳的制备将甘草次酸溶于三氯甲烷和乙醇(11:1)中组成油相,与甘草次酸同等质量的甘露醇溶于三氯甲烷饱和的水溶液组成水相,使用高速匀浆器对其乳化获得甘草次酸粗乳。
3.2 单因素法优化甘草次酸粗乳制备工艺在制备水溶性甘草次酸冻干粉之前,考虑到第1步使用高速匀浆器乳化对甘草次酸粒径影响最大,单因素法被用来优化此次乳化工艺条件。将高速匀浆器转速固定在6 000 r×min-1,对油相与水相体积比、甘草次酸浓度以及乳化次数这3个因素进行优化。它们的优化范围分别是1%~15%、20~200 mg·mL-1、3~23。
3.3 水溶性甘草次酸冻干粉的制备将在最佳工艺条件下获得的甘草次酸粗乳迅速转至高压均质机内进行高压乳化,压力在8×107 Pa,循环6次。最后将得到的亚微乳使用旋转蒸发仪除去有机溶剂后在-40 ℃下冷冻干燥48 h获得水溶性甘草次酸冻干粉。
3.4 分析测试方法将100 mg水溶性甘草次酸冻干粉用3 mL去离子水分散,轻轻摇晃使其分散均匀后置入比色皿中,采用激光粒度分析仪平行测定粒径3次。
使用扫描电镜进行形貌检测,用导电胶将样品粘接到样品座上,在氩气保护下进行喷金即可进行形貌观察。
称取1 g的甘草次酸原粉或水溶性甘草次酸冻干粉分散在10 mL 37 ℃水中,100 r·min-1搅拌48 h,取上清1 000 r·min-1离心10 min后再取上清注入高效液相色谱仪检测。色谱条件参考杨文远等的研究[17]:采用Dikma钻石二代色谱柱(250 mm×4.6 mm,5 μm),以3.6%磷酸水溶液-甲醇(15:85)为流动相,流速1 mL·min-1,检测波长为254 nm,柱温25 ℃,进样量10 μL。
4 结果与分析 4.1 单因素优化乳化是指2种互不相容的液体,其中一种(分散相)以细小的液滴分散到另一种液体中(连续相),从而形成乳状液。本研究利用溶解有高浓度的甘草次酸的三氯甲烷和乙醇溶液作为油相即分散相,三氯甲烷饱和的甘露醇水溶液作为水相即连续相,乳化过程未使用表面活性剂。乳化过程中,高速匀浆器带来的高剪切力将不断滴入的油相破碎细化为微米级粒度的微团,这时就被大团粒水所吞噬包裹。水分子间氢键的静电作用力使得水分子团形成近程有序的连接,从而形成大团粒水。水相经三氯甲烷饱和后等于在水相和油相界面处设置了一道屏障,减缓了油相向水相的扩散速度,增加了乳液稳定性,从而避免了乳化剂的使用。所以本研究没有考虑乳化剂种类及其浓度的优化,而是将优化因素限制在油相和水相体积比、甘草次酸在油相中浓度、乳化次数。
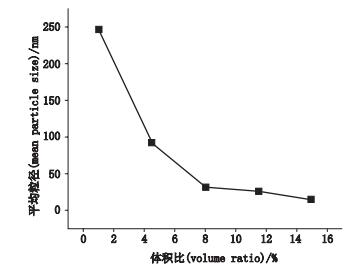
油相与水相体积比在乳化过程中起着重要作用,如图 2所示。平均粒径随着油相和水相的体积比增大呈减小趋势。当体积比从8增到大15时,甘草次酸粗乳的平均粒径变化很小,在25 nm范围内。所以选择最大体积比15%作为最佳体积比条件。
|
图 2 体积比与平均粒径的关系 Figure 2 The relationship between volume ratio and mean particle size |
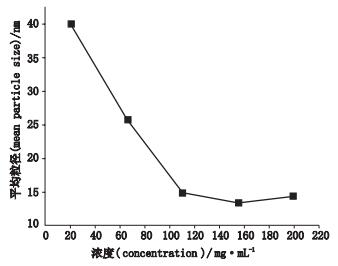
甘草次酸浓度是考量的第2个因素,如图 3所示。甘草次酸粗乳的平均粒径基本上随甘草次酸浓度增大而减小,其中在155 mg·mL-1时所得粒径最小,所以将这个浓度作为最佳甘草次酸浓度条件。
|
图 3 浓度与平均粒径的关系 Figure 3 The relationship between concentration and mean particle size |
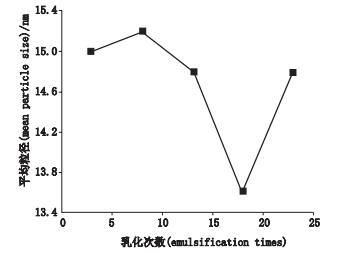
乳化次数的延长有助于获得更加均匀的微观混合体系,这有助于形成细小的乳滴,然而随着时间延长乳滴之间出现了聚集长大。当乳化次数为18时是最佳的乳化次数条件(见图 4)。
|
图 4 乳化次数与平均粒径的关系 Figure 4 The relationship between emulsification times and mean particle size |
综上,制备甘草次酸粗乳的最佳工艺条件为:油相和水相体积比15%;甘草次酸浓度155 mg·mL-1;乳化次数18次。在此基础上,将制得的粗乳迅速转移至高压均质机内在8×107Pa条件下进行乳化,循环6次。将获得的亚微乳在40 ℃下减压除去氯仿和乙醇再经冷冻干燥制得水溶性甘草次酸冻干粉。后面测试均在此基础上进行。
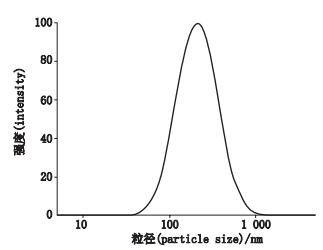
4.2 粒径分布在最佳工艺条件下制得的水溶性甘草次酸冻干粉粒径分布见图 5,从图中可以看出粒子基本上都在1 000 nm以下,通过激光粒度仪测得平均粒径为241.1 nm。
|
图 5 水溶性甘草次酸冻干粉粒径分布 Figure 5 Particle size distribution of water-soluble glycyrrhetinic acid freeze-dried powder |
甘草次酸原粉和水溶性甘草次酸冻干粉扫描电镜检测结果见图 6。从图中可以看出,甘草次酸原粉呈不规则的片状,粒径在1~5 μm范围内变化。水溶性甘草次酸冻干粉形貌规则,呈棒状,宽度在200 nm左右。

|
图 6 甘草次酸原粉(a)与水溶性甘草次酸冻干粉(b)扫描电镜检测 Figure 6 Scanning electron microscope images of raw glycyrrhetinic acid(a)and water-soluble glycyrrhetinic acid freeze-dried powder(b) |
甘草次酸原粉和水溶性甘草次酸冻干粉高效液相色谱图见图 7,从图中可以看出,两者均在15 min左右出峰,图 7-b峰高明显高于图 7-a。经外标一点法计算,甘草次酸原粉和水溶性甘草次酸冻干粉在37 ℃水中溶解度分别为3.84 μg·mL-1和23.08 μg·mL-1,溶解度提高了大约5倍。

|
图 7 甘草次酸原粉(a)与水溶性甘草次酸冻干粉(b)高效液相色谱图 Figure 7 HPLC chromatograms of raw glycyrrhetinic acid(a)and water-soluble glycyrrhetinic acid freeze-dried powder(b) |
根据Ostwald-Freundlich方程,固体颗粒的饱和溶解度取决于其粒子半径和晶格结构:
| $\ln (S/{S_0}) = 2v\gamma /rRT = 2M\gamma /\rho rRT$ | (1) |
式中,S是药物在温度T下的溶解度,S0是r=∞时的溶解度,M是化合物的相对分子质量,v是分子体积,γ是界面张力,ρ是化合物的密度。
从方程(1)可以推断药物的溶解度随着粒子半径的减小而增大,但这种效应不适用于较大粒径的粒子。由此可以说明水溶性甘草次酸冻干粉平均粒径进入了纳米范畴后直接导致了溶解度的增大。
4.5 再分散性测试甘草次酸原粉和水溶性甘草次酸冻干粉的外观及水溶性见图 8所示。甘草次酸原粉和水溶性甘草次酸冻干粉都为白色粉末,但水溶性甘草次酸冻干粉更为蓬松,而且由于密度小的缘故,有很多粘贴到瓶壁上面。根据Ostwald-Freundlich方程(1)可知,物质密度越小,溶解度就越大,从这一角度也解释了水溶性甘草次酸冻干粉溶解度增大的原因。密度减小可能跟乳化、冻干带来的药物结晶度减弱有关。从图 8-c、d比较来看,甘草次酸原粉由于溶解度低,大部分漂浮在上层,而水溶性甘草次酸冻干粉在水中分散均匀,呈乳光,没有肉眼可见颗粒。

|
a.甘草次酸原粉(raw paclitaxel)b.水溶性甘草次酸冻干粉(water soluble glycyrrhetinic acid freeze-dried powder)c.甘草次酸原粉在水中(raw paclitaxel in water,5 mg·mL-1)d.水溶性甘草次酸冻干粉在水中(water soluble glycyrrhetinic acid freeze-dried powder in water,5 mg·mL-1) 图 8 甘草次酸原粉与水溶性甘草次酸冻干粉外观和在水中的分散性 Figure 8 Appearance and dispersion appearance in water of raw paclitaxel and water-soluble glycyrrhetinic acid freeze-dried powder |
本研究借助高速匀浆器和高压均质机2种机械手段,运用乳化法制备水溶性甘草次酸冻干粉,并借助单因素法优化了第1步乳化过程。在最佳工艺条件获得的水溶性甘草次酸冻干粉扫描电镜显示呈规则棒状,平均粒径减小到了241.1 nm。根据Ostwald-Freundlich方程(1),粒径的减小直接导致甘草次酸溶解度的增大。高效液相色谱测定结果也证实,水溶性甘草次酸冻干粉比起原粉溶解度提高了大约5倍。水溶性甘草次酸冻干粉粒径进入纳米范畴后会带来比表面积的增加,根据Noyes-Whitney方程,表面积的增加会增加溶出速率。因此,水溶性甘草次酸冻干粉不仅具有较高的溶解度,溶出速率也会增加,这些将有助于药物在体内的迅速吸收和药效的发挥,为甘草次酸在医药行业上的应用带来积极性的影响。
| [1] |
中国药典2015年版. 一部[S]. 2015: 附录86 ChP 2015. Vol Ⅰ[S]. 2015:Appendix 86 |
| [2] |
江苏新医学院. 中药大辞典[M]. 上海: 上海人民出版社, 1977: 52 New Medical College of Jiangsu. Dictionary of Medicinal Plant[M]. Shanghai:Shanghai People's Press, 1977:52 |
| [3] |
胡志厚. 甘草酸类药物的研制及应用[J]. 药学学报, 1988, 23(7): 553. HU ZH. Development and application of glycyrrhizic acid drugs[J]. Acta Pharm Sin, 1988, 23(7): 553. |
| [4] |
KU CM, LIN JY. Anti-inflammatory effects of 27 selected terpenoid compounds tested through modulating Th1/Th2 cytokine secretion profiles using murine primary splenocytes[J]. Food Chem, 2013, 141(2): 1104. DOI:10.1016/j.foodchem.2013.04.044 |
| [5] |
YANG MH, KIM J, KHAN IA, et al. Nonsteroidal anti-inflammatory drug activated gene-1(Nag-1)modulators from natural products as anti-cancer agents[J]. Life Sci, 2014, 100(2): 75. DOI:10.1016/j.lfs.2014.01.075 |
| [6] |
SONG J, KO HS, SOHN EJ, et al. Inhibition of protein kinase C alpha/beta li and activation of C-Jun Nh2-terminal kinase mediate glycyrrhetinic acid induced apoptosis in non-small cell lung cancer Nci-H460 cells[J]. Bioorg Med Chem Lett, 2014, 24(4): 1188. DOI:10.1016/j.bmcl.2013.12.111 |
| [7] |
BORDBAR N, KARIMI MH, AMIRGHOFRAN Z. Phenotypic and functional maturation of murine dendritic cells induced by 18 alphaand beta-glycyrrhetinic acid[J]. Immunopharm Immunot, 2014, 36(1): 52. DOI:10.3109/08923973.2013.864670 |
| [8] |
SALOMATINA OV, MARKOV AV, LOGASHENKO EB, et al. Synthesis of novel 2-cyano substituted glycyrrhetinic acid derivatives as inhibitors of cancer cells growth and no production in ipsactivated J-774 cells[J]. Bioorgan Med Chem, 2014, 22(1): 585. DOI:10.1016/j.bmc.2013.10.049 |
| [9] |
ISBRUCKER RA, BURDOCK GA. Risk and safety assessment on the consumption of licorice root(Glycyrrhiza sp.), its extract and powder as a food ingredient, with emphasis on the pharmacology and toxicology of glycyrrhizin[J]. Regul Toxicol Pharm, 2006, 46(3): 167. DOI:10.1016/j.yrtph.2006.06.002 |
| [10] |
SHIN YW, BAE EA, LEE B, et al. In vitro and in vivo antiallergic effects of Glycyrrhiza glabra and its components[J]. Planta Med, 2007, 73(3): 257. DOI:10.1055/s-2007-967126 |
| [11] |
PARK HY, PARK SH, YOON HK, et al. Anti-allergic activity of 18 beta-glycyrrhetinic acid-3-O-beta-D-glucuronide[J]. Arch Pharm Res, 2004, 27(1): 57. DOI:10.1007/BF02980047 |
| [12] |
ZHAO CH, XU J, ZHANG YQ, et al. Inhibition of human enterovirus 71 replication by pentacyclic triterpenes and their novel synthetic derivatives[J]. Chem Pharm Bull, 2014, 62(8): 764. DOI:10.1248/cpb.c14-00088 |
| [13] |
PADUCH R, KANDEFER-SZERSZEN M. Antitumor and antiviral activity of pentacyclic triterpenes[J]. Mini Rev Org Chem, 2014, 11(3): 262. DOI:10.2174/1570193X1103140915105240 |
| [14] |
JIA J, SUN XH, SHAO TF, et al. Synthesis of novel caffeyl triterpenic esters and their hepatic protective effect[J]. Chin J Org Chem, 2012, 32(4): 760. DOI:10.6023/cjoc1108291 |
| [15] |
HUANG LR, LUO H, YANG XS, et al. Enhancement of antibacterial and anti-tumor activities of pentacyclic triterpenes by introducing exocyclic alpha, beta-unsaturated ketone moiety in ring A[J]. Med Chem Res, 2014, 23(11): 4631. DOI:10.1007/s00044-014-1031-z |
| [16] |
TIAN JL, WANG L, WANG L, et al. A wogonin-loaded glycyrrhetinic acid-modified liposome for hepatic targeting with anti-tumor effects[J]. Drug Deliv, 2014, 21(7): 553. DOI:10.3109/10717544.2013.853850 |
| [17] |
杨文远, 熊楚明, 张金国. 反相高效液相色谱法测定甘草中甘草次酸含量[J]. 宁夏工程技术, 2003, 2(3): 246. YANG WY, XIONG CM, ZHANG JG. Determination of glycyrrhetic acid in Glycyrrhiza by high performance liquid chromatography[J]. Ningxia Eng Technol, 2003, 2(3): 246. |
 2017, Vol. 37
2017, Vol. 37 
