2. 中药生产过程控制与质量评价北京市重点实验室, 北京 100029;
3. 河北医科大学 药学院, 石家庄 050017;
4. 北京康仁堂药业有限公司, 北京 101301
2. Beijing Key Laboratory for Production Process Control and Quality Evaluation of Traditional Chinese Medicine, Beijing 100029, China;
3. School of Pharmacy, Hebei Medical University, Shijiazhuang 050017, China;
4. Beijing Tcmages Pharmaceutical Co., Ltd., Beijing 101301, China
近年来,近红外(near infrared,NIR)光谱法以其独特的优势,广泛地应用于农业[1]、食品[2]、药品[3]等行业。越来越多的NIR分析方法被开发和应用,NIR方法预测结果的质量也受到越来越多研究者和实验室的关注。
按照ISO17025定义,完整的定量分析方法包括优化选择(经验选择)、实验设计、方法开发、实验室内方法验证、实验室间方法验证、方法不确定度分析、日常使用、定期重新方法验证8个步骤,其中,分析方法的验证和不确定度研究是分析领域的热点难点问题。方法验证和测量结果不确定度评估是为了保证分析结果的有效性和可靠性,对于符合国际标准ISO17025的实验室这2个概念是强制性的[4]。
验证的目的是证明采用的方法适合于相应检测的要求。对于NIR分析方法的验证,主要有ICH Q2(R1)验证和决策方法验证[5]。其中,决策方法验证中包含的准确度曲线(accuracy profile,AP)[6-8]的方法相对于其他验证方法更加简单、全面、有效,能够给出分析方法在不同浓度下的准确度和在实际应用中的预测能力,现已被应用于制剂中水分、活性成分的NIR定量分析方法的验证[9-11]。而通过引入β-CTI代替β-ETI构建AP,完成对NIR方法的验证,为分析方法验证提供了新的思路[12]。
测量结果不确定度评估作为一种科学、合理的验证手段及质量控制方法,正越来越多地被引入药学领域,是和方法验证同样重要的内容。随着各种规范分析方法验证法规的相继颁布和国内实验室认可工作的开展,建立并应用不确定度评估程序成为评价分析方法的必要步骤。相对于传统的自下而上(Bottom-up)[13]和自上而下(Top-down)方法[14],基于β-期望容忍区间(β-expectation tolerance interval,β-ETI)[15]和β-容度容忍区间(β-content tolerance interval,β-CTI)[16]来计算分析方法的测量不确定度更加方便有效,为基于验证数据的不确定度测算提供了便捷途径。由于β-CTI可以更加充分地对NIR的测量不确定度进行评估[17],因此,目前多用β-CTI来评估中药NIR定量分析方法的不确定度[18]。
本文以NIR快速测定中药陈皮提取物粉末中辅料糊精的定量方法为载体,通过引入β-CTI同时完成对NIR定量分析方法的AP验证和不确定度评价,保证分析方法的有效性和可靠性,降低分析方法在日常应用中的风险,以期为其他分析方法的评价提供参考。
1 实验部分 1.1 仪器与试剂Antaris近红外光谱仪(Thermo Nicolet公司),Sartorius BS 124电子天平(Sartorius公司),XW-80A涡旋仪(海门市其林贝尔仪器制造有限公司)。陈皮提取物粉末(北京康仁堂药业有限公司,批号131204),糊精(北京康仁堂药业有限公司,批号14070114062)。
1.2 光谱采集采用Antaris傅里叶变换近红外光谱仪,积分球附件采集漫反射光谱,采集前将样品置于涡旋仪上充分混合均匀,采集时使用Sample Cup Spinner配件旋转样品杯,每个样品扫描32次。以仪器内置背景做参比,分辨率8 cm-1,波数范围10 000 ~ 4 000 cm-1。
1.3 实验设计 1.3.1 校正实验设计精密称取一定量糊精和陈皮提取物粉末,混合均匀,使混合物中糊精含量为1%~10%共20个样品;11%~20%共20个样品;21%~ 30%共20个样品;31%~40%共20个样品;41%~50%共20个样品,每份样品的总重为5.000 0 g。
1.3.2 验证实验设计设定5个糊精辅料浓度水平的样品(1%、3%、5%、7%、10%)对方法进行验证。选取3×5×3的析因实验设计方案,即实验分3 d进行,每天1次,每次实验包含5个浓度水平,每个浓度水平进行3次平行实验,共45个验证样品。
1.4 数据处理采用SIMCA-P 11.5(Umetrics公司)及Unscrambler 7.0(CAMO公司)软件对光谱进行预处理,采用Matlab 7.0(Mathwork公司)软件进行样本集划分、数据预处理、变量筛选、准确度曲线构建和不确定度计算。
2 结果与讨论 2.1 定量模型建立 2.1.1 样本划分采用K-S(Kennard-Stone)法将100个样本划分为校正集(66个)和验证集(34个)。
2.1.2 光谱预处理对“陈皮提取物粉末-糊精”样品的近红外光谱使用以下预处理方法进行校正:考察采用多元散射校正(multiplicative signal correction,MSC)和标准正则变换(standard normal variate,SNV)消除各批次间样品粒度分布不均匀及粉末颗粒大小不同产生的散射对其光谱的影响;对光谱数据进行小波去噪(wavelet denoising,WDS)和卷积平滑(Savitzky-Golay,S-G)处理以消除噪音对光谱的影响;对光谱数据进行一阶导数(1std)和二阶导数(2nnd)处理以消除光谱基线漂移,强化谱带特征,克服谱带重叠。各预处理方法建模结果见表 1。由表 1可以看出,SNV处理方法结果最好,光谱经预处理后,潜变量因子数(latent variables,LVs)为8时,校正集相关系数(rcal)和验证集相关系数(rval)分别为0.999 3和0.999 0,校正集误差均方根(the root mean squared error of calibration,RMSEC)、交叉验证误差均方根(the root mean squared error of cross-validation,RMSECV)和预测集误差均方根(the root mean squared error of prediction,RMSEP)分别为0.568%、0.719%和0.584%,校正集偏差(BIAScal)和验证集偏差(BIASval)分别为0.437和0.466,定量模型性能(the ratio of performance to deviation,RPD)由20.0增加到22.1,因此采用SNV预处理方法作为光谱预处理方法。
|
|
表 1 不同预处理方法的建模结果 Table 1 PLS results with different preprocessing methods |
光谱经过SNV预处理之后,为了更好地提高模型的性能,提高所建方法的预测准确性,本文采用无用信息删除(uninformative variables elimination,UVE)[19]、连续投影算法(successive projections algorithm,SPA)[20]以及自适应重加权取样(competitive adaptive reweighted sampling,CARS)[21] 3种方法来进行光谱变量筛选。并将筛选后的变量用于PLS建模,建模结果如表 2所示。由表 2可以看出,经过SPA和CARS变量筛选后,模型性能并没有提高反而降低,可能是由于经过SPA和CARS变量筛选后保留的变量数较少,信息缺失,无法完整准确地关联陈皮提取物粉末中辅料糊精的含量。而经过UVE变量筛选后所建模型性能最优,与未经变量筛选所建模型相比较,各项评价参数都有所提高。RMSEC和RMSECV由0.568和0.719降低为0.277和0.487,模型性能指数RPD由22.1升高至27.1。表明UVE对于所建NIR定量分析方法是一种有效的变量筛选方法,能够简化预测模型,提高模型性能。
|
|
表 2 不同变量筛选方法的建模结果 Table 2 PLS results with different variable selection methods |
验证实验所得数据对NIR分析方法进行验证。由于β-CTI可以更加充分地估计总误差,即随机误差和系统误差之和,并且方便不确定度的计算,完成方法的全局评价。本文采用β-CTI来构建AP对NIR分析方法进行验证,具体原理与算法参见文献[12]。对于β-CTI的计算,选择β=66.7%,γ=90% [22-23],表示总体的66.7%有90%的可能性落入β-CTI范围内。NIR分析方法验证的可接受限设为±20%[18, 24]。验证结果如表 3和图 1所示。
|
|
表 3 验证试验结果 Table 3 Validation results |
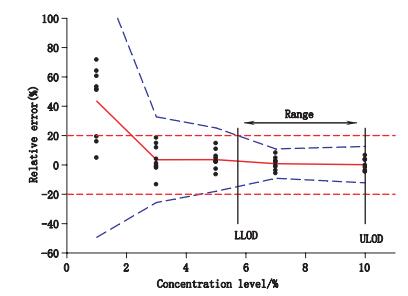
|
红色实线是相对偏差,蓝色中等虚线是β-容度容许区间上下限,红色短虚线是可接受限(±20%),9个黑色点为各个浓度水平下每个测量值的相对偏差 (the red line is the relative bias, the blue medium dashed lines are the β-content, γ-confidence tolerance intervals (γ=90%)and the red short dashed lines are the acceptance limits (±20%), the 9 black points at each concentration level are relative bias for each predictive value) 图 1 准确度曲线 Figure 1 Accuracy profile |
真实性表示真实值(本文为称量参考值)与实验平均值(本文为近红外预测值)之间的接近程度,由系统误差造成。各浓度水平验证结果的真实性分别用相对误差、回收率表示。如表 3所示。由表 3得出,糊精含量浓度在1%时,真实性较差,相对偏差为43.5%;而随着浓度的增加,相对偏差有逐渐减小的趋势,在浓度为3%、5%、7%、10%时,相对偏差分别为3.6%、3.6%、0.86%、0.19%。
2.2.2 精密度精密度表示一系列实验值(本文为近红外预测值)之间的接近程度,由随机误差造成。如表 3所示,由重复性和中间精密度表示。随着分析浓度的降低,精密度逐渐变大。在浓度水平为1%和3%时,重复性和中间紧密度较差,分别为8.3%、27.2%和8.4%、10.4%;而随着浓度的提高,方法的精密度也在不断提高,在浓度水平为5%,7%,10%时,精密度相对较好。
2.2.3 准确度准确度是系统误差和随机误差的总和的表示,在本文中以β-CTI表示。在图 1中,浓度水平为1%、3%、5%时,β-CTI上下限超过了可接受限(±20%),表示在这些浓度水平下准确度较低,NIR分析方法不可接受。在浓度水平7%、10%时,β-期望容许区间上下限未超过可接受限±20%,表示在这些浓度水平下准确度较高,NIR分析方法可接受。
2.2.4 可接受限β-CTI上下限和可接受限的交点定义为方法的最低定量限(lower limit of quantification,LLOQ)和最高定量限(upper limit of quantification,ULOQ)。如果β-CTI上下限和可接受限没有交点,那么所研究浓度水平的最低浓度水平即为LLOQ,所研究浓度水平的最高浓度即为ULOQ。由图 1可以计算得到,LLOQ为5.73%,ULOQ为10%。
2.2.5 范围最低定量限和最高定量限给出了该NIR定量分析方法能够准确定量的范围,因此有效的定量范围为5.73%~10%。
2.2.6 线性分析方法的线性是指分析样品在某一指定范围获得的结果与浓度(或含量)成正比关系的能力。近红外预测值和理论实际值之间的线性方程为:
y=0.961 1x+0.362 4,R2=0.989 2。
表明近红外预测值和理论实际值之间线性关系良好。如图 2所示,在浓度范围为5.73%~10%时,β-容度容许区间上下限在可接受范围内,因此在此范围的线性关系得到有效证明。
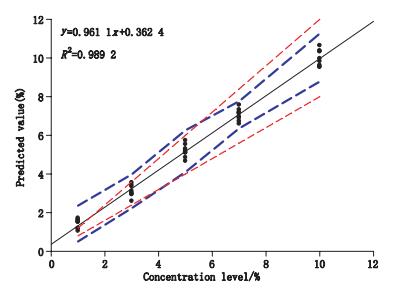
|
蓝色短虚线是绝对β-容度容许区间,红色短虚线为可接受限± 20%。连续的黑线为标示线y=x (the blue medium dashed lines are absolute β-CTI intervals (γ=90%), and red short dashed lines represent the accepted limits at ± 20%. The continuous line is the identity line y=x) 图 2 线性曲线 Figure 2 Linear profile |
不确定度是与测量本身相关用来表征测量结果分散程度的参数[25-26]。不确定度的计算过程如下[16, 27]:
| $u\left( Y \right) = \frac{{h - l}}{{2{t_v}}}$ | (1) |
公式(1)中h是β-CTI的上限,l是β-CTI的下限。tν是在自由度为ν时Student’s t分布的(1+γ)/2分位数。对于对称数据,ν可以通过萨特思韦特公式计算得到[28]。
分析方法的扩展不确定度U(Y)可由公式(2)给出:
| $U\left( Y \right) = p \times u\left( Y \right)$ | (2) |
p是覆盖因子,和置信水平相关。当置信水平为95%时,p约等于2,扩展不确定度表示测量值落在±U(Y)的概率为95%。
表 4展示了NIR分析方法在各个浓度水平的不确定度。从表 4可以看出浓度较低时(1%),相对扩展不确定度较大(68.88%)。随着浓度的升高,相对扩展不确定度在逐渐降低。当浓度水平为7%时,相对扩展不确定度最小,为10.69%,表示在该浓度水平下,有95%的置信水平,测量值落在±10.69%范围内。
|
|
表 4 NIR方法的不确定度 Table 4 Uncertainty of NIR method |
本文建立了准确快速分析中药陈皮提取物粉末中糊精含量的NIR定量分析方法,通过引入β-CTI提出了同时对NIR分析方法进行验证和不确定度评估的全局评价策略。该策略可以有效保障分析方法的有效性和可靠性,降低在日常应用中的风险,为其他分析方法的评估提供有益的参考。
| [1] |
孙通, 耿响, 刘木华. 基于近红外光谱和变量优选的棉麻混纺织物棉含量快速检测[J]. 光谱学与光谱分析, 2014, 34(12): 3257. SUN T, GENG X, LIU MH. Determination of cotton content in cotton/ramie blended fabric by NIR spectra and variable selection methods[J]. Spectrosc Spect Anal, 2014, 34(12): 3257. DOI:10.3964/j.issn.1000-0593(2014)12-3257-05 |
| [2] |
PIERNA JAF, ABBAS O, LECLER B, et al. NIR fingerprint screening for early control of non-conformity at feed mills[J]. Food Chem, 2015, 189: 2. DOI:10.1016/j.foodchem.2014.09.105 |
| [3] |
CARDENAS V, CORDOBES M, BLANCO M, et al. Strategy for design NIR calibration sets based on process spectrum and model space:An innovative approach for process analytical technology[J]. J Pharm Biomed Anal, 2015, 114: 28. DOI:10.1016/j.jpba.2015.05.002 |
| [4] |
ISO/DIS 17025, General requirements for the competence of calibration and testing laboratories[S]. 2005 https://www.nist.gov/document-16609
|
| [5] |
BLEYE CD, CHAVEZ PF, MANTANUS J, et al. Critical review of near-infrared spectroscopic methods validations in pharmaceutical applications[J]. J Pharm Biomed Anal, 2012, 69: 125. DOI:10.1016/j.jpba.2012.02.003 |
| [6] |
HUBERT P, NGUYEN-HUU JJ, BOULANGER B, et al. Harmonization of strategies for the validation of quantitative analytical procedures:A SFSTP proposal-part I[J]. J Pharm Biomed Anal, 2004, 36(3): 579. |
| [7] |
HUBERT P, NGUYEN-Huu JJ, BOULANGER B, et al. Harmonization of strategies for the validation of quantitative analytical procedures:A SFSTP proposal-Part Ⅱ[J]. J Pharm Biomed Anal, 2007, 45(1): 70. DOI:10.1016/j.jpba.2007.06.013 |
| [8] |
HUBERT P, NGUYEN-HUU JJ, BOULANGER B, et al. Harmonization of strategies for the validation of quantitative analytical procedures:A SFSTP proposal-Part Ⅲ[J]. J Pharm Biomed Anal, 2007, 45(1): 82. DOI:10.1016/j.jpba.2007.06.032 |
| [9] |
MANTANUS J, ZIÉ MONS E, LEBRUN P, et al. Moisture content determination of pharmaceutical pellets by near infrared spectroscopy:method development and validation[J]. Anal Chim Acta, 2009, 642(1/2): 186. |
| [10] |
WU Z, XU B, DU M, et al. Validation of a NIR quantification method for the determination of chlorogenic acid in Lonicera japonica solution in ethanol precipitation process[J]. J Pharm Biomed Anal, 2012, 62: 1. DOI:10.1016/j.jpba.2011.12.005 |
| [11] |
SCHAEFER C, CLICQ D, LECOMTE C, et al. A Process Analytical Technology(PAT)approach to control a new API manufacturing process:Development, validation and implementation[J]. Talanta, 2014, 120: 114. DOI:10.1016/j.talanta.2013.11.072 |
| [12] |
XUE Z, XU B, YANG C, et al. Method validation for the analysis of licorice acid in the blending process by near infrared diffuse reflectance spectroscopy[J]. Anal Methods, 2015, 7(14): 5830. DOI:10.1039/C5AY01289A |
| [13] |
Joint Committee for Guides in Metrology. Guide to the Expression of Uncertainty in Measurement[S]. 2008 http://www.evs.ee/eelvaade/iso-iec-guide-98-3-2008-en.pdf
|
| [14] |
Analytical Method Committee. Uncertainty of mea-surement:implications of its use in analytical science[J]. Analyst, 1995, 120: 2303. DOI:10.1039/an9952002303 |
| [15] |
FEINBERG M, BOULANGER B, DEWÈ W, et al. New advances in method validation and measurement uncertainty aimed at improving the quality of chemical data[J]. Anal Bioanal Chem, 2004, 380(3): 502. DOI:10.1007/s00216-004-2791-y |
| [16] |
SAFFAJ T, IHSSANE B. Uncertainty profiles for the validation of analytical methods[J]. Talanta, 2011, 85: 1535. DOI:10.1016/j.talanta.2011.06.042 |
| [17] |
徐冰, 薛忠, 罗赣, 等. 基于β-容度容忍区间的血塞通注射液近红外定量分析不确定度评估[J]. 中草药, 2015, 46(6): 832. XU B, XUE Z, LUO G, et al. Quantitative analysis on uncertainty evaluation using near infrared spectroscopy based on β-content tolerance interval[J]. Chin Tradit Herb Drugs, 2015, 46(6): 832. DOI:10.7501/j.issn.0253-2670.2015.06.009 |
| [18] |
薛忠, 徐冰, 刘倩, 等. 不确定度评估在中药近红外定量分析中的应用[J]. 光谱学与光谱分析, 2014, 34(10): 2657. XUE Z, XU B, LIU Q, et al. Application of uncertainty assessment in NIR quantitative analysis of traditional Chinese medicine[J]. Spectrosc Spect Anal, 2014, 34(10): 2657. DOI:10.3964/j.issn.1000-0593(2014)10-2657-05 |
| [19] |
CENTNER V, MASSART DL, de NOORD OE, et al. Elimination of uninformative variables for multivariate calibration[J]. Anal Chem, 1996, 68(21): 3851. DOI:10.1021/ac960321m |
| [20] |
ARAÙ JO MCU, SALDANHA TCB, GALVAO RKH. The successive projections algorithm for variable selection in spectroscopic multicomponent analysis[J]. Chemometr Intell Lab Syst, 2001, 57: 65. DOI:10.1016/S0169-7439(01)00119-8 |
| [21] |
LI H, LIANG Y, XU Q, et al. Key wavelengths screening using competitive adaptive reweighted sampling method for multivariate calibration[J]. Anal Chim Acta, 2009, 648(1): 77. DOI:10.1016/j.aca.2009.06.046 |
| [22] |
HOFFMAN D, KRINGLE R. A total error approach for the validation of quantitative analytical methods[J]. Pharm Res, 2007, 24(6): 1157. DOI:10.1007/s11095-007-9242-3 |
| [23] |
HOFFMAN D. Statistical considerations for assessment of bioanalytical incurred sample reproducibility[J]. AAPS J, 2009, 11(3): 570. DOI:10.1208/s12248-009-9134-z |
| [24] |
International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use(ICH). Harmonized Tripartite Guideline. Validation of Analytical Procedure:Text and Methodology Q2(R1). US, 1994-10-27[EB/OL].(2005-11)[2017-01-04]. http://www.ich.org/fileadmin/Public_Web_Site/ICHProducts/Guidelines/Quality/Q2R1/Step4/Q2R1Guideline.pdf
|
| [25] |
BIPM, IEC, IFCC, et al. International Vocabulary of Basic and General Terms in Metrology(VIM)[S]. 1993
|
| [26] |
BIPM, IEC, IFCC, et al. Guide to the Expression of Uncertainty in Measurement(GUM)[S]. 1993 https://physics.nist.gov/cuu/Uncertainty/international2.html
|
| [27] |
SAFFAJ T, IHSSANE B, JHILAL F, et al. Concentration, detection and discrimination of Bacillus anthracis spores in orange juice using aptamer based surface enhanced Raman spectroscopy[J]. Analyst, 2013, 138(16): 4677. DOI:10.1039/c3an00519d |
| [28] |
MEE R. β-Expectation and β-content tolerance limits for balanced one-way ANOVA Random Model[J]. Technometrics, 1984, 26(26): 251. |
 2017, Vol. 37
2017, Vol. 37 
