桃花来源于蔷薇科植物桃Prunus persica(L.)Batsch.或山桃Prunus davidiana(Carr.)Franch.[1]的花。3~4月间桃花将开放时采摘,阴干,放干燥处。桃花味苦,性平;归心、肝、大肠经;有利水通便,活血化瘀[2]之功效。桃花的功效在各中医典籍中有所记载,且有一定的药用历史。近年来对桃花的化学成分[3]研究表明:桃花中含有桃花精油[4]、桃花红色素[5-6]、桃花多糖[7-8]、多酚[9]及黄酮[10]类物质,同时含有氨基酸、维生素及多种微量元素[11-12],同时对其提取工艺也进行了相应探究,对桃花的药用价值[13]及生药学[14]也有相应研究报道,但桃花未收载于任何质量标准中,其质量难以有效控制。本文建立了桃花中绿原酸、芦丁、金丝桃苷和异槲皮苷的薄层色谱鉴别及高效液相色谱指纹图谱分析方法,为桃花的质量控制提供了科学依据,也为桃花质量标准的制定提供了数据支持。
1 仪器与试药 1.1 仪器岛津LC-2010A型高效液相色谱仪,包括二元泵、在线脱气机、PDA二极管阵列检测器等(岛津公司);Waters SunFire C18色谱柱(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶;Waters公司);CP225D型十万分之一精密电子天平(赛多利斯集团);Millipore超纯水机(Millipore公司);C9860A型超声波清洗仪(250 W,50 kHz;天津科贝尔光电技术有限公司);硅胶GF254预制薄层板(50 mm×100 mm;青岛谱科分离材料有限公司)。
1.2 对照品与试剂对照品绿原酸(批号110753-201415,含量96.6%)、芦丁(批号100080-201409,含量91.9%)、阿魏酸(批号110773-201012,含量96.6%)、金丝桃苷(批号111521-201406,含量92.5%)、异槲皮苷(批号111809-201403,含量92.9%),中国食品药品检定研究院;桃花对照药材(山东,批号501004797W);乙腈、磷酸为色谱纯,甲醇为分析纯,水由Milli-Q纯化系统制备。
1.3 药材桃花药材采购于安国及亳州药材市场;所有样品由河北省药品检验研究院段吉平老师鉴定,均为蔷薇科植物桃Prunus persica(L.)Batsch.的干燥花。
2 方法与结果 2.1 薄层色谱鉴别 2.1.1 薄层色谱条件称取桃花样品粉末1.0 g,置具塞锥形瓶中,加甲醇10 mL,超声处理10 min,滤过,取续滤液作为供试品溶液;另取桃花对照药材1.0 g,同法制成对照药材溶液;以甲醇制备每1 mL含0.5 mg的绿原酸对照品溶液,以甲醇制成每1 mL各含0.5 mg的芦丁、金丝桃苷、异槲皮苷混合对照品溶液。照薄层色谱法(中国药典2010年版一部附录Ⅵ B)试验,吸取对照药材溶液、绿原酸对照品溶液与供试品溶液各2 μL,芦丁、金丝桃苷、异槲皮苷混合对照品溶液1 μL,分别点于同一硅胶GF254薄层板上,以乙酸乙酯-甲酸-水(30:3:2)为展开剂,展开,取出,晾干,喷以5%三氯化铝乙醇溶液,在105 ℃加热至斑点显色清晰,置紫外光灯(365 nm)下检视;样品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点。结果见图 1。
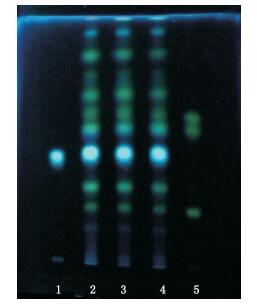
|
1.绿原酸对照品(chlorogenic acid reference substance)2.S004号样品(No.S004 sample)3.S010号样品(No.S010 sample)4.S001号样品(No.S001 sample)5.芦丁、金丝桃苷、异槲皮苷混合对照品,按Rf值由小到大分别为芦丁、金丝桃苷、异槲皮苷(reference substance of rutin,hyperin and isoquercitrin,according to the Rf values respectively from rutin,hyperin and isoquercitrin) 图 1 桃花的薄层色谱图 Figure 1 TLC chromatogram of peach blossom |
分别考察了烟台硅胶GF254板(50 mm×100 mm)、青岛谱科分离材料有限公司GF254板(50 mm×100 mm)、德国Merck高效GF254板(50 mm×100 mm);结果表明,各斑点清晰可见,分离度较好。
2.1.3 不同温度条件的耐用性考察分别考察了相对湿度为65%和温度为7 ℃,相对湿度为60%和温度为26 ℃,以及相对湿度为22%和温度为42 ℃时的耐用性;结果表明,不同温度时各斑点均可较好分离,并清晰可见。
2.1.4 不同相对湿度条件的耐用性考察分别考察了环境温度为26 ℃,相对湿度为22%和相对湿度为88%时的耐用性,结果表明,不同相对湿度时斑点清晰,可较好分离。
2.2 高效液相色谱指纹图谱研究 2.2.1 色谱条件色谱柱:Waters SunFire C18色谱柱(250 mm× 4.6 mm,5 μm);流动相:以乙腈为流动相A,以0.1%磷酸水溶液为流动相B,先以A-B(14:86)等度洗脱,待异槲皮苷峰洗脱完毕后进行线性梯度洗脱(0~20 min,14%A→20%A;20~40 min,20%A→ 60%A;40~45 min,60%A→14%A);流速:1.0 mL·min-1;检测波长:353 nm;柱温:30 ℃;进样量:20 μL。
2.2.2 混合对照品溶液的制备分别精密称取绿原酸、阿魏酸、芦丁、金丝桃苷和异槲皮苷的对照品适量,加甲醇制成每1 mL含绿原酸0.1 mg,阿魏酸0.01 mg,芦丁0.02 mg,金丝桃苷0.02 mg和异槲皮苷0.06 mg的混合溶液,用0.45 μm微孔滤膜滤过,取续滤液,即得。
2.2.3 供试品溶液的制备取桃花粉末(过4号筛)约2.0 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇50 mL,密塞,称量,超声(250 W,50 kHz)处理20 min,放冷,再称量,用70%甲醇补足减失的量,摇匀,用0.45 μm微孔滤膜滤过,取续滤液,即得。
2.2.4 方法学考察 2.2.4.1 精密度试验取桃花样品(批号S010)粉末制备供试品溶液,连续进样5次,各主要共有峰相对保留时间的RSD为0.14%~1.36%,经相似度软件处理,相似度均大于0.999,表明精密度良好。
2.2.4.2 重复性试验取桃花样品(批号S010)粉末,混匀,精密称取粉末1.6、2.0、2.4 g各3份,按“2.2.3”项下方法制备供试品溶液,进样分析,各主要共有峰相对保留时间的RSD为0.07%~0.62%,经相似度软件处理,相似度均大于0.989,结果表明,该方法重复性好,试验可靠。
2.2.4.3 稳定性试验取桃花样品(批号S010)粉末,混匀,精密称取粉末2.0 g,按“2.2.3”项下方法制备供试品溶液,分别在制备后0、1.5、3、5、12、24 h进样测定。各主要共有峰相对保留时间的RSD为0.14%~1.36%,经相似度软件处理,相似度均大于0.999,结果表明,供试品溶液在室温下24 h内稳定。
2.2.5 桃花指纹图谱的建立及分析 2.2.5.1 桃花指纹图谱共有峰的标定取桃花样品11批,按“2.2.3”项下的方法制备供试品溶液,按“2.2.1”项下色谱条件进样分析,记录峰面积。采用“中药色谱指纹图谱相似度评价系统2.0版”软件,以中位数法作为指纹图谱的生成方法,对11批桃花样品的指纹图谱进行分析。11批桃花药材的色谱叠加图见图 2。经分析,共标定了18个共有峰,见图 3。经与对照品色谱图保留时间相对照,并结合二极管阵列检测器分析验证,指认了第3、6、7、8号色谱峰分别对应为绿原酸、芦丁、金丝桃苷和异槲皮苷。色谱图中,因异槲皮苷峰前后无杂质峰干扰,分离度良好,峰面积相对稳定,故选择此峰为参照峰。
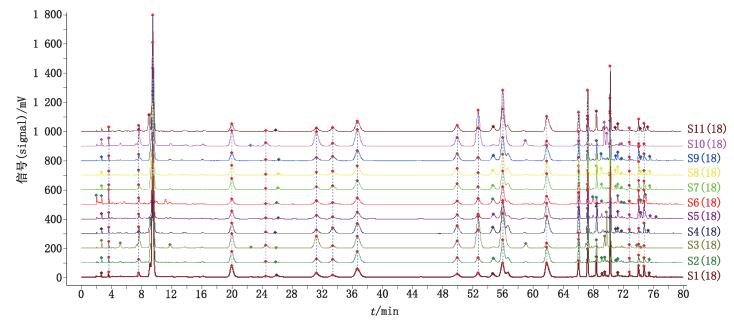
|
图 2 11批桃花样品的HPLC色谱图叠加图 Figure 2 HPLC overlay chromatogram of 11 batches of peach blossom |

|
3.绿原酸(chlorogenic acid)6.芦丁(rutin)7.金丝桃苷(hyperin)8.异槲皮苷(isoquercitrin) 图 3 桃花HPLC指纹图谱及共有峰标定 Figure 3 Fingerprint of peach blossom and mark of common peaks |
对11批桃花样品进行相似度评价,计算各样品图谱与对照图谱的整体相似度,相似度计算结果分别为0.981、0.993、0.834、0.980、0.985、0.944、0.993、0.988、0.993、0.773、0.997,相似度由0.773至0.997变化幅度较大,其中S003和S010与对照图谱相似度差别较大,其余9批样品指纹图谱相似度均大于0.94,相关性较好。
2.2.5.3 桃花指纹图谱差异分析由桃花基源可知,桃花分为植物桃花和山桃花2类。S003和S010为山桃花样品,其余均为植物桃花样品。单独对9批植物桃花样品建立指纹图谱并进行分析,共标定了22个共有峰,见图 4;计算各样品图谱与对照图谱之间的相似度,结果分别为0.979、0.992、0.981、0.988、0.943、0.995、0.989、0.994、0.996。单独对2批山桃花样品建立指纹图谱并分析,共标定了23个共有峰,见图 5;计算各样品图谱与对照图谱之间的相似度,结果分别为0.995、0.996。比较桃花对照图谱、植物桃花对照图谱和山桃花对照图谱,以桃花共有峰(图 3)中标示的峰号为基准,由图可知,山桃花中6号峰(芦丁)和8号峰(异槲皮苷)、10号峰和11号峰远高于植物桃花;12号峰、14号峰和15号峰却远低于植物桃花。而植物桃花对照图谱中的6号峰(阿魏酸)和17号峰是山桃花中的缺失峰;山桃花中的14号峰、18号峰和19号峰是植物桃花中的缺失峰。结果表明,植物桃花和山桃花的成分和含量存在一定差异,其指纹图谱也略有不同,本文分别给出植物桃花和山桃花的指纹图谱,以便更好地对桃花质量进行控制。
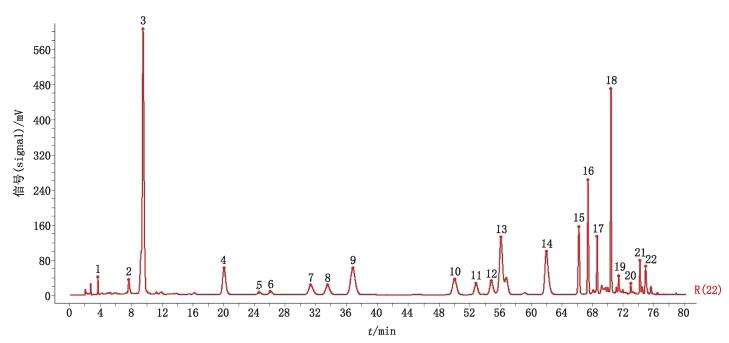
|
图 4 植物桃花HPLC指纹图谱及共有峰标定 Figure 4 Fingerprint of flower of Prunus persica and mark of common peaks |
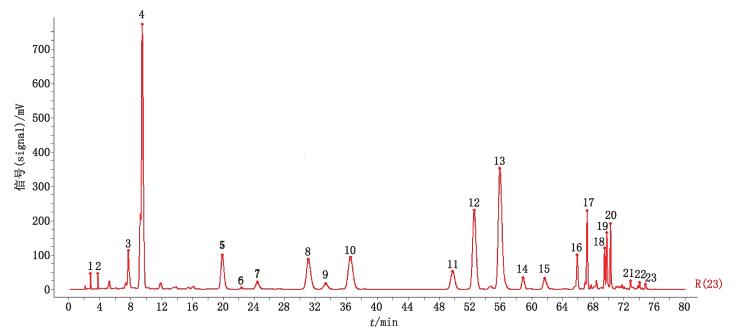
|
图 5 山桃花HPLC指纹图谱及共有峰标定 Figure 5 Fingerprint of flower of Prunus davidiana and mark of common peaks |
吸附剂比较了聚酰胺薄膜、硅胶G薄层板和硅胶GF254薄层板,结果显示硅胶GF254薄层板的分离效果最佳。
3.2 薄层色谱鉴别展开剂的考察查阅相关文献[15]215,294,51,70,展开剂分别比较了正丁醇-醋酸-水系统、乙醇-丙酮-水系统、乙酸乙酯-丁酮-甲酸-水系统和乙酸乙酯-甲酸-水系统,结果显示以乙酸乙酯-甲酸-水(30:3:2)为展开剂展开时效果最佳。
3.3 薄层色谱鉴别显色剂的考察查阅相关文献[15]215,70,分别比较了显色剂10%硫酸乙醇和5%三氯化铝乙醇溶液,结果显示以5%三氯化铝乙醇溶液显色效果最佳。
3.4 小结本文建立的桃花中绿原酸、芦丁、金丝桃苷和异槲皮苷的薄层色谱鉴别,可快速、准确地对桃花质量进行定性控制;高效液相色谱指纹图谱分析方法可更进一步为桃花的质量控制提供依据,为桃花的质量标准制定提供数据支持。
| [1] |
江苏新医学院. 中药大辞典[M]. 上海: 上海科学技术出版社, 1986, 3666. Jiangsu New Medical College. Dictionary of Medicinal Plant[M]. Shanghai: Shanghai Science and Technology Publishers, 1986, 3666. |
| [2] |
国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1999, 2557. Chinese Herbalism Editorial Board, State Administration of Traditional Chinese Medicine. Chinese Herbalism[M]. Shanghai: Shanghai Science and Technology Publishers, 1999, 2557. |
| [3] |
杨谦谦, 孙芳玲. 桃花化学成分的研究进展[J]. 中国药理学与毒理学杂志, 2012, 26(3): 425. YANG QQ, SUN FL. Research progress on chemical constituents of peach blossom[J]. Chin J Pharmacol Toxicol, 2012, 26(3): 425. |
| [4] |
耿明江, 刘振岭. 正交法优选桃花精油的提取工艺[J]. 新乡医学院学报, 2007, 24(4): 364. GENG MJ, LIU ZL. Optimize the extraction technology of essential oil from peach blossom by orthogonal design[J]. J Xinxiang Med Coll, 2007, 24(4): 364. |
| [5] |
耿明江, 程迪. 正交法优选桃花红色素提取工艺[J]. 食品科技, 2008, 33(1): 185. GENG MJ, CHENG D. Optimize the extraction technology of red pigment from peach blossom by orthogonal design[J]. Food Sci Technol, 2008, 33(1): 185. |
| [6] |
李丽峰, 梁逸曾. 桃花红素的制备研究[J]. 广东化工, 2009, 36(5): 24. LI LF, LIANG YZ. Research on peach blossom erythrocyte endothelin preparation[J]. Guangdong Chem Ind, 2009, 36(5): 24. |
| [7] |
耿明江, 席荣英. 响应面法优化桃花多糖提取工艺[J]. 食品研究与开发, 2012, 33(12): 29. GENG MJ, XI RY. Optimization of extraction technology of polysaccharide from peach blossoms by response surface methodology[J]. Food Res Dev, 2012, 33(12): 29. |
| [8] |
蓝峻峰, 赖红芳. 超声波辅助半仿生法提取地桃花多糖[J]. 湖北农业科学, 2014, 53(2): 401. LAN JF, LAI HF. Semi-bionic extraction of polysaccharide from Urena lobata L[J]. Hubei Agric Sci, 2014, 53(2): 401. |
| [9] |
袁建梅, 耿明江. 超声提取桃花多酚的工艺优化及抗氧化活性研究[J]. 食品科技, 2012, 37(12): 179. YUAN JM, GENG MJ. Optimization of ultrasonic-assisted extraction on polyphenols from peach blossom and antioxidant activity evaluation[J]. Food Sci Technol, 2012, 37(12): 179. |
| [10] |
刘杰超, 张春岭. 桃花中总酚和总黄酮的提取及抗氧化活性研究[J]. 食品安全质量检测学报, 2013, 4(6): 1750. LIU JC, ZHANG CL. Extraction of total phenolics and flavanoids from peach blossoms and their antioxidant activity[J]. J Food Qual, 2013, 4(6): 1750. |
| [11] |
柳琪, 滕葳. 桃花营养元素的分析与开发探讨[J]. 氨基酸和生物资源, 1996, 18(4): 31. LIU Q, TENG W. Analysis of nutrition elements in peach blossom and its potential application[J]. Amino Acids Biotic Resour, 1996, 18(4): 31. |
| [12] |
刘杰超, 杨文博. 桃花中营养及功能性成分分析[J]. 食品安全质量检测学报, 2016, 7(9): 3745. LIU JC, YANG WB. Analysis of nutritional and functional constituents in the petals of peach blossom[J]. J Food Saf Qual, 2016, 7(9): 3745. |
| [13] |
马建中, 张有成. 桃花的药用价值研究[J]. 中医学报, 2013, 28(7): 1020. MA JZ, ZHANG YC. Medicinal value of peach blossom[J]. China J Chin Med, 2013, 28(7): 1020. |
| [14] |
殷丹, 朱莹光. 桃花的生药学研究[J]. 亚太传统医药, 2013, 9(10): 34. YIN D, ZHU YG. Pharmacognostic identification of peach blossom[J]. Asia-Pac Tradit Med, 2013, 9(10): 34. DOI:10.3969/j.issn.1673-2197.2013.10.013 |
| [15] |
中国药典2010年版. 一部[S]. 2010: 215, 294, 51, 70 ChP 2010. Vol Ⅰ[S]. 2010:215, 294, 51, 70 http://www.doc88.com/p-6903130276544.html |
 2017, Vol. 37
2017, Vol. 37 