注射用门冬酰胺酶为一线抗肿瘤化疗药物,属国家基本药物[1],其有效成分门冬酰胺酶是来源于大肠埃希菌或欧文氏菌中具有酰氨基水解活性作用的酶[2]。临床上,注射用门冬酰胺酶主要用于治疗急性淋巴细胞性白血病(ALL)和晚期非霍杰金淋巴瘤(NHL),同时对急性粒细胞型白血病、急性单核细胞白血病、恶性淋巴瘤也有一定疗效[3]。1994年,美国FDA批准上市的门冬酰胺酶注射剂(ELSPAR),来源于大肠埃希菌;中国于2009年批准上市的门冬酰胺酶制剂,来源于欧文菌[4]。目前国内有4家生产企业生产注射用门冬酰胺酶制剂,现行执行标准为中国药典2015年版二部[5],国外药典未见收载。临床上,注射用门冬酰胺酶制剂的不良反应主要有过敏及超敏反应、急性胰腺炎[6]、抑制凝血因子合成抑制[7]、骨髓抑制等[8]。
门冬酰胺酶系来源于大肠杆菌的酶类药物,其生产过程包括细菌培养、蛋白质分离纯化等步骤,但没有涉及大肠杆菌核苷酸的去除步骤[9-10]。文献报道发现大肠杆菌基因组DNA富含CpG(CpG岛,基因组内富含胞嘧啶和鸟嘌呤的区域)且非甲基化程度较高,所以大肠杆菌的残留核苷酸导致蛋白药物产品产生免疫原性的风险极其高[11-13]。因此来源于大肠杆菌的蛋白类药物,其对大肠杆菌残留核苷酸的控制是产品安全性的重要质控指标[14]。在注射用门冬酰胺酶的现行标准中,并没有对大肠杆菌的残留核苷酸进行控制[5]。
本文利用荧光定量PCR(Real-time PCR)技术对大肠杆菌来源的注射用门冬酰胺酶制剂的残留核苷酸进行测定,并对该方法进行了方法学验证。
1 材料与仪器 1.1 供试样品注射用门冬酰胺酶2批(均来源于大肠埃希菌),分别为企业A(规格为5 000 U)、企业B(规格为10 000 U)生产。
1.2 试剂及仪器DNeasy Blood & Tissure Kit(Qiagen,USA);Power SYBR Green PCR Master Mix(ABI,USA);大肠杆菌23S核糖体RNA基因特异性引物,上游引物(5’-GTC TGG AAA GGC GCG CGA-3’)和下游引物(5’-GTG TCC CGC CCT ACT CA-3’),由TakaRa大连宝生物工程有限公司合成。
荧光定量PCR扩增仪(AB 7500FAST,Applied Biosystem);5424型离心机(Eppendorf)。
2 实验方法 2.1 大肠杆菌基因组DNA标准品制备取大肠杆菌菌种接种于5 mL LB培养基中,37 ℃振荡培养过夜。6 000 r·min-1离心10 min收菌集体,用DNeasy Blood & Tissure Kit提取大肠杆菌基因组DNA,利用紫外分光光度法(600 nm波长处)测得质量浓度为93 500 ng·mL-1。无菌水稀释大肠杆菌基因组DNA,制成不同质量浓度的标准品溶液(93 500、9 350、935、93.5、9.35、0.935、0.093 5、0.009 35 ng·mL-1)。
2.2 供试品溶液制备精密移取门冬酰胺酶制剂250 μL置2 mL灭菌离心管内,按照DNeasy Blood & Tissure Kit方法提取制剂中的DNA,即得。
2.3 Real-time PCR检测取1 μL各浓度的大肠杆菌基因组DNA标准品溶液或供试品溶液作为模板,以上游引物和下游引物作为引物,在AB 7500 FAST荧光定量PCR扩增仪上进行扩增并实时检测荧光强度。Real-time PCR反应体系:Power SYBR Green PCR Master Mix(2×)5 μL,上游引物(10 μm)1 μL,下游引物(4 μm)1 uL,基因组标准品DNA2 μL,ddH2O(sterilized)1 μL。Real-time PCR反应条件:95 ℃ 10 min;95 ℃ 15 s和60 ℃ 30 s,40个循环。熔解曲线条件:0.7 ℃·s-1从60 ℃到95 ℃。
2.4 定量限测定取1 μL大肠杆菌基因组DNA标准品溶液作为模板(0.009 35 ng·mL-1),进行Real-time PCR扩增反应,平行试验3孔,并测定其回收率(回收率=实际测定浓度值/理论浓度值×100%)来评估定量限。
2.5 精密度测定无菌水稀释大肠杆菌基因组DNA标准品,制成不同质量浓度的标准品溶液(93 500、9 350、935、93.5、9.35、0.935、0.093 5、0.009 35 ng·mL-1),进行Real-time PCR扩增反应,每个浓度平行做3孔,重复3次试验,测定回收率(回收率=实际测定浓度值/理论浓度值×100%)并计算RSD来表示其精密度。
2.6 加标样品回收率测定将质量浓度为935、9.35、0.093 5 ng·mL-1的大肠杆菌基因组DNA标准品溶液分别加入门冬酰胺酶制剂内,精密移取250 μL上述溶液置2 mL灭菌离心管内,按照DNeasy Blood & Tissure Kit方法提取溶液中的DNA,进行Real-time PCR扩增反应,每个浓度平行做3孔,重复3次试验,测定回收率[回收率=(加标溶液浓度值-不加标溶液浓度值)/理论加标浓度×100%]并计算RSD。
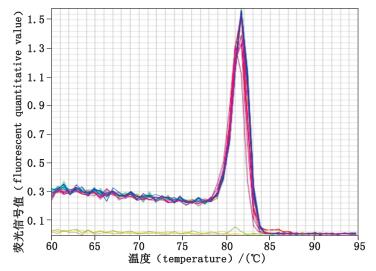
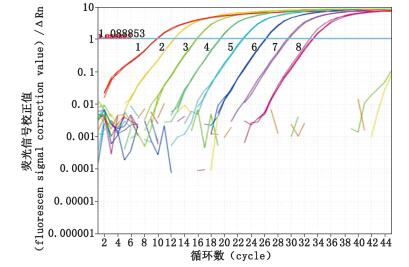
3 实验结果 3.1 Real-time PCR引物特异性以无菌水稀释大肠杆菌基因组DNA标准品并按照“2.3”项下方法进行试验,结果如图 1、2所示。图 1为DNA标准品实时荧光定量的熔解曲线,从图中可以看出所有浓度下均可检测到明显的特异峰值,且无非特异性扩增杂峰及引物二聚体峰出现,由此可证明PCR产物的特异性。图 2为Real-time PCR扩增曲线,由图中可见曲线光滑平稳,峰值较高,扩增效率较高,且扩增的各个时期曲线明显,符合定量检测的要求。
|
图 1 熔解曲线分析 Figure 1 Analysis of dissociation curves |
|
DNA标准品溶液质量浓度(the mass concentration of DNA standard solution):1. 93 500 ng·mL-1 2. 9 350 ng·mL-1 3. 935 ng·mL-1 4. 93.5 ng·mL-1 5. 9.35 ng·mL-1 6. 0.935 ng·mL-1 7. 0.093 5 ng·mL-1 8. 0.009 35 ng·mL-1 图 2 Real-time PCR扩增曲线图 Figure 2 Amplification curves for Real-time PCR |
图 2显示的Real-time PCR扩增曲线中,在0.009 35 ng·mL-1浓度下曲线完好,表明应用本方法可检测大肠杆菌基因组DNA残留量得最低准确定量浓度可达到0.009 35 ng·mL-1。同时,应用“2.4”项下方法进一步确证0.009 35 ng·mL-1为该方法的定量限的浓度,3孔平行试验结果显示平均回收率为99.8%,RSD为2.40%。
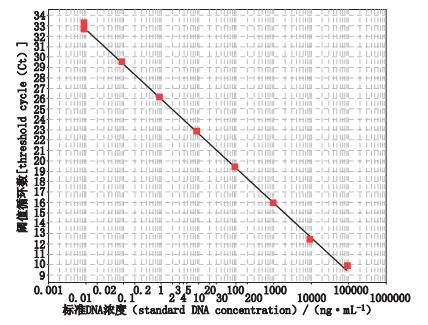
3.3 Real-time PCR定量检测标准曲线以无菌水稀释大肠杆菌基因组DNA标准品,制成不同质量浓度的线性定量标准品溶液(93 500、9 350、935、93.5、9.35、0.935、0.093 5、0.009 35 ng·mL-1),按照“2.3”项下方法进行PCR扩增反应,以Ct(y轴)对log标准DNA浓度(x轴)作标准曲线,结果如图 3所示,质量浓度在0.009 35~93 500 ng·mL-1范围内线性良好,R2=0.999。
|
图 3 Real-time PCR定量检测标准曲线图 Figure 3 Standard curve of Real-time PCR quantitation detection |
按照“2.5”项下方法进行Real-time PCR扩增反应,以扩增反应得到的Ct值代入标准曲线求得样品的浓度,并计算回收率和RSD。结果如表 1所示,质量浓度在0.009 35~93 500 ng·mL-1范围内,回收率均值为98.9%,RSD为7.2%。
|
|
表 1 精密度(n=3) Table 1 Precision |
按照“2.6”项下方法分别对2个样品(经该法方法检验,未检测到大肠杆菌核苷酸残留)进行加标回收率实验,结果见表 2。2个样品在3个不同浓度的加样回收实验中,回收率均值分别为86.4%和93.7%,RSD分别为8.0%和6.2%。
|
|
表 2 2个样品的加标回收率(n=3) Table 2 Recovery of two samples |
应用本文方法对企业A和企业B的2批样品进行大肠杆菌残留核苷酸检测,均未检测到大肠杆菌核苷酸残留。
4 讨论 4.1 Real-time PCR技术在大肠杆菌残留核苷酸检测上的应用目前已有多种技术手段被用于重组蛋白药物产品中残留宿主DNA的质量控制[15-16]。比如PicoGreen直接染色法、杂交法、Threshold技术及Real-time PCR法。PicoGreen直接染色法和杂交法灵敏度较低,当DNA浓度低于pg级时都无法检测;Threshold技术原理类此于ELISA,具有较高灵敏度,但小于600 bp的DNA则无法被检测;Real-time PCR法可同时解决上述3种的缺陷,也是美国药典推荐的检测方法。2010年版中国药典三部附录中关于外源性DNA残留量的测定法有2种,DNA探针杂交法和荧光染色法[5]。荧光染色法虽可对DNA进行定量,但其灵敏度低,不适用于重组药物中微量DNA的检测。DNA探针杂交法虽灵敏度较高,但操作烦琐且不能对DNA进行定量。近年来,已有多篇文章研究Real-time PCR技术在外源性DNA残留测定上的应用,并都取得了较好的结果[14, 17],美国药典已把Real-time PCR法作为宿主DNA残留的标准检验方法[18]。
4.2 注射用门冬酰胺酶制剂中大肠杆菌残留核苷酸量的控制注射用门冬酰胺酶制剂中的主要成分门冬酰胺酶来源于大肠杆菌,该制剂的生产过程包括细菌培养、蛋白质分离纯化等步骤,但不涉及大肠杆菌核苷酸的去除。大肠杆菌基因组DNA富含CpG且非甲基化程度较高,因此大肠杆菌的残留核苷酸可能导致蛋白药物产品产生免疫原性。对于来源于大肠杆菌的蛋白类药物,产品中大肠杆菌核苷酸残留量的控制是产品安全性控制的重要指标。而在注射用门冬酰胺酶制剂的现行标准中,并没有对大肠杆菌的残留核苷酸进行控制,从而导致注射用门冬酰胺酶制剂质量的不可控性。
Real-time PCR法具有灵敏度高、操作简便、高效高通量、定量结果准确等特点。可在质量标准中增加对大肠杆菌核苷酸残留量的检测,从而进一步控制注射用门冬酰胺酶制剂的安全性。
| [1] |
HOLCLEANBERG J. Optimal asparaginase therapy[J]. J Pediatr Hematol Onco1, 2004, 26(5): 273. DOI:10.1097/00043426-200405000-00001 |
| [2] |
王华, 耿其荣, 吕跃. 不同菌种来源左旋门冬酰胺酶及不同用法不良反应的观察[J]. 广东医学, 2011, 32(24): 3260. WANG H, GENG QR, LÜ Y. Side effects of L-asparaginase with different sources and administrations[J]. Guangdong Med J, 2011, 32(24): 3260. DOI:10.3969/j.issn.1001-9448.2011.24.043 |
| [3] |
罗学群. 不同类型左旋门冬酰胺酶的特点及临床应用[J]. 中国小儿血液与肿瘤杂志, 2013, 18(1): 1. LUO XQ. The characteristics and clinical application about different types of L-asparaginase[J]. J China Pediatr Blood Cancer, 2013, 18(1): 1. |
| [4] |
谢育媛, 孙允芳, 郭江红. 注射用门冬酰胺酶蛋白质杂质研究[J]. 中国药师, 2016, 0(8): 1486-1489. XIE YY, SUN YF, GUO JH. Analysis of protein impurities in asparaginase for injection[J]. China Pharm, 2016, 0(8): 1486-1489. |
| [5] |
中国药典2015年版. 二部[S]. 2015: 45 ChP 2015. Vol Ⅱ[S]. 2015: 45 |
| [6] |
邹亚伟, 吴梓梁, 叶铁真, 等. 对左旋门冬酰胺酶引起急性胰腺炎的一点看法[J]. 中华儿科杂志, 1999, 37(12): 762. ZOU YW, WU ZL, YE TZ, et al. Some opinions of L-asparaginase cause acute pancreatitis[J]. China J Pediatr, 1999, 37(12): 762. DOI:10.3760/j.issn:0578-1310.1999.12.024 |
| [7] |
毛小红. 左旋门冬酰胺酶的不良反应及其诊治[J]. 药物流行病学杂志, 2008, 17(3): 181. MAO XH. Adverse reactions, diagnosis and treatment of L-asparaginase[J]. Chin J Pharmacoepidemiol, 2008, 17(3): 181. |
| [8] |
王亚, 卢愿, 孙立荣. 两种不同剂型门冬酰胺酶治疗急性淋巴细胞白血病的不良反应比较及其对策[J]. 实用儿科临床杂志, 2012, 27(15): 1193. WANG Y, LU Y, SUN LR. Comparision of side-effects and countermeasures for two different preparations of asparaginase in treatment of acute lymphoblastic leukemia[J]. J Appl Clin Pediatr, 2012, 27(15): 1193. DOI:10.3969/j.issn.1003-515X.2012.15.022 |
| [9] |
韦玉军, 陈建华, 吴梧桐. E. coli L-天冬酰胺酶结构与功能及其纯化工艺[J]. 药学进展, 2005, 29(9): 397. WEI YJ, CHEN JH, WU YT. Reasearches on the structure and function of E. coli-ASP and its purification technology[J]. Prog Pharm Sci, 2005, 29(9): 397. |
| [10] |
吴敬, 赖龙生, 刘景晶, 等. 重组L-门冬酰胺酶Ⅱ的提取纯化工艺[J]. 中国医药工业杂志, 2000, 3(2): 50. WU J, LAI LS, LIU JJ, et al. Extraction and purification of recombinant L-asparaginase Ⅱ[J]. Chin J Pharm, 2000, 3(2): 50. |
| [11] |
ALARFAJ AS, RAUFCHOWDHARY A, KHALIL N, et al. Immunogenicity of singlet oxygen modified human DNA:implications for anti-DNA antibodies in systemic lupus erythematosus[J]. Clin Immunol, 2007, 124(1): 83. DOI:10.1016/j.clim.2007.03.548 |
| [12] |
BASTIAN D, BOREL H, SASAKI T, et al. Immune response to nucleic acid antigens and native DNA by human peripheral blood lymphocytes in vitro[J]. J Immunol, 1985, 135(3): 1772. |
| [13] |
PISETSKY DS. Specificity and immunochemical properties of antibodies to bacterial DNA[J]. Methods, 1997, 11(1): 55. DOI:10.1006/meth.1996.0387 |
| [14] |
WOLTER T, RICHTER A. Assays for controlling host-cell in purities in biopharmaceuticals[J]. Bio Process Int, 2005, 3(2): 40. |
| [15] |
AHN SJ, COSTA J, EMANUEL JR. PicoGreen quantitation of DNA:effective evaluation of samples pre-or psost-PCR[J]. Nucl Acids Res, 1996, 24(13): 2623. DOI:10.1093/nar/24.13.2623 |
| [16] |
JI X, LEE K, DIPAOLO B. Short technical report high-sensitivity hybridization assay for quantitation of residual E. coli DNA[J]. Biotechniques, 2002, 32: 1162. |
| [17] |
饶春明, 赵阳, 李永红, 等. 应用荧光法测定重组细胞因子中残余DNA含量[J]. 药物分析杂志, 2005, 25(12): 1417. RAO CM, ZHAO Y, LI YH, et al. Determination of residual DNA in recombinant cytokines by fluorescence method[J]. Chin J Pharm Anal, 2005, 25(12): 1417. |
| [18] |
USP 35-NF 30[S]. 2012:755
|
 2017, Vol. 37
2017, Vol. 37 
