2. 新疆维吾尔自治区药物研究所, 乌鲁木齐 830004
2. Xinjiang Institute of Materia Medica, Urumqi 830004, China
复方一枝蒿速释微丸原处方为复方一枝蒿颗粒,由板蓝根、大青叶、一枝蒿3味药组成,收载于《国家中成药标准汇编(中成药地方标准上升国家标准部分)》,主要用于邪毒所致的感冒发烧,咽喉肿痛,病毒性感冒,疗效确切[1]。
复方一枝蒿颗粒工艺为全方水提取。处方中板蓝根能够通过多种化学成分、多靶点发挥抗流感病毒作用,其水提物在细胞膜上的作用位点与病毒一样,通过细胞膜表面的唾液酸与细胞结合,以包被细胞的方式作用于细胞[2-4];大青叶水提取物可从细胞免疫、体液免疫两方面调节免疫功能,发挥间接抗病毒作用[5-7];一枝蒿中黄酮类化合物具有直接抗病毒作用,一枝蒿醇提取有效部位能增强免疫功能,发挥间接抗病毒作用[8-9]。依据现代中药研制要求,本文课题组前期已对原工艺进行了优化,进行了体外抗流感试验研究[1],表明优选工艺在Hep-2细胞上抗甲型流感病毒的作用效果优于原工艺,并制备服用方便、生物利用度高、吸收快的复方一枝蒿速释微丸,针对流感起病迅速的特点,通过快速崩解、发挥药效进行治疗,为研制高效、安全、稳定的口服固体速释制剂奠定基础。
本实验研究建立了高效液相色谱法同时测定复方一枝蒿速释微丸中(R,S)-告依春、一枝蒿酮酸、靛玉红的含量,各色谱峰均得到很好的分离。测定方法准确,专属性好,操作简单,可为复方一枝蒿速释微丸的质量控制提供依据。
1 仪器与试药PE公司200型高效液相色谱仪;岛津Shim-pack ODS(250 mm×4.6 mm,5 μm;填料:硅胶颗粒)色谱柱;AB135-S梅特勒-托利多电子天平;四川沃特尔科技发展有限公司WP-UP-Ⅳ-10型Water Purifier实验室专用超纯水机;昆山市超声仪器有限公司KQ-100 DE型数控超声波清洗器。
复方一枝蒿速释微丸,新疆药物研究所,批号130416、130418、130501;对照品(R,S)-告依春(批号111753-201103)和靛玉红(批号110717-200204)购自中国食品药品检定研究院,对照品一枝蒿酮酸(批号20110420,纯度 > 97%)购自中国科学院新疆理化技术研究所。乙腈为色谱纯,磷酸为优级纯,水为重蒸水,其余试剂均为分析纯。
2 方法与结果 2.1 溶液的制备 2.1.1 供试品溶液精密称取复方一枝蒿速释微丸约3 g,置100 mL量瓶中,加50%乙醇水溶液约95 mL,超声处理(功率40 W,频率100 kHz)40 min使其完全溶解,加入50%乙醇水溶液定容至刻度,摇匀,经0.45 μm微孔滤膜过滤,取续滤液,即得,4 ℃冷藏备用。
2.1.2 阴性样品溶液按复方一枝蒿速释微丸的处方,因为大青叶和板蓝根药材中均含有靛玉红,因此首先称取不含大青叶和板蓝根的药材,再分别取不含一枝蒿、不含板蓝根的复方药材,按“2.1.1”项下方法制成相应的阴性样品溶液,4 ℃冷藏备用。
2.1.3 对照品储备溶液分别精密称取(R,S)-告依春、靛玉红、一枝蒿酮酸的对照品适量,分别置25 mL量瓶中,加入甲醇,分别制成每1 mL含(R,S)-告依春195.2 μg、靛玉红153.2 μg、一枝蒿酮酸363.2 μg的溶液,即得,4 ℃冷藏备用。
2.1.4 系列混合对照品溶液分别精密吸取“2.1.2”项下的各对照品储备液0.5、1.0、3.0、5.0、7.0 mL,分别按由低到高的次序依次加入至5个25 mL量瓶中,再分别加甲醇稀释至刻度,摇匀,即得。
2.2 色谱条件[10-13]采用Shim-pack ODS(250 mm×4.6 mm,5 μm)色谱柱,以乙腈(A)-0.5 %磷酸水溶液(B)为流动相,梯度洗脱(0~15 min,3%A→10%A;15~20 min,10%A→35%A;20~35 min,35%A),检测波长为245 nm(0~20 min,检测(R,S)-告依春)和289 nm(25~35 min,检测靛玉红和一枝蒿酮酸),流速1.0 mL·min-1,柱温30 ℃。在上述色谱条件下,取混合对照品溶液及供试品溶液各10 μL进样。供试品溶液中的3个化学成分与其相邻峰均能达到很好的分离,且分离度大于1.5,色谱图见图 1。
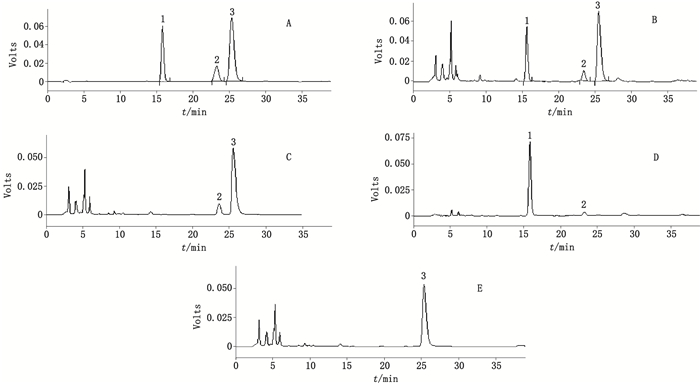
|
A.混合对照品(mixed reference substances)B.供试品(sample)C.缺板蓝根阴性样品(negative sample without Isatidis Radix)D.缺一枝蒿阴性样品(negative sample without Herba Artemisiae Rupestridis)E.缺大青叶和板蓝根阴性样品(negative sample without Isatidis Folium and Isatidis Radix) 1.(R,S)-告依春[(R,S)-epigoitrin] 2.靛玉红(indirubin)3.一枝蒿酮酸(rupestonic acid) 图 1 复方一枝蒿速释微丸HPLC色谱图 Figure 1 HPLC chromatograms of Yizhihao immediate-release pellets |
取系列混合对照品溶液各10 μL,按“2.2”项下色谱条件进行分析,以对照品浓度X(μg·mL-1)为横坐标,峰面积Y为纵坐标,绘制标准曲线并进行回归计算,得3种指标成分的回归方程,结果见表 1。
|
|
表 1 3种指标成分的线性关系 Table 1 Linearity of determination of 3 components |
取复方一枝蒿速释微丸(批号130501),按“2.1.1”项下方法制备供试品溶液,室温下放置,分别于0、2、4、6、8、12 h按“2.2”项下色谱条件进样分析,测定其峰面积,分别计算0~12 h各成分色谱峰峰面积的RSD(n=5),结果(R,S)-告依春为1.87%,靛玉红为1.76%,一枝蒿酮酸为1.53%,表明供试品溶液中上述3个成分于室温放置12 h内均稳定。
2.5 精密度试验取复方一枝蒿速释微丸(批号130501),按“2.1.1”项下方法制备供试品溶液,精密吸取10 μL,按上述“2.2”项下色谱条件连续进样5次,测定峰面积,其RSD分别为(R,S)-告依春为1.11%,靛玉红为1.05%,一枝蒿酮酸为1.59%。结果表明,仪器精密度良好。
2.6 重复性试验取复方一枝蒿速释微丸(批号130501),按“2.1.1”项下方法平行制备5份供试品溶液,精密吸取10 μL,按上述“2.2”项下色谱条件进样测定3种指标成分的峰面积,并计算其含量。结果(R,S)-告依春、靛玉红、一枝蒿酮酸的平均含量分别为0.347、0.192、0.894 mg·g-1,RSD分别为1.35%、1.90%、1.66%。结果表明,重复性良好。
2.7 回收率试验精密称取已知含量的复方一枝蒿速释微丸(批号130501)约1.5 g,共9份,置100 mL量瓶中,平均分为3组,每组分别精密加入195.2 μg·mL-1的(R,S)-告依春对照品储备溶液1、3、5 mL,153.2 μg·mL-1的靛玉红对照品储备溶液1.5、2.0、4.5 mL,363.2 μg·mL-1的一枝蒿酮酸对照品储备溶液2、4、6 mL,再加50%乙醇水溶液溶解定容至刻度,按“2.1.1”项下方法制备供试溶液,按“2.2”条色谱条件进样分析,记录峰面积。以外标法计算加样回收率。结果见表 2。
|
|
表 2 回收率试验结果 Table 2 Results of recovery |
取复方一枝蒿速释微丸(批号130501)约3.0 g,精密称定,按“2.1.1”项下方法制备供试溶液,分别用Purospher® STAR LP RP-18 Endcapped(250 mm×4.6 mm,5 μm)、Diamonsil C18(250 mm×4.6 mm,5 μm)和Shim-pack ODS(250 mm×4.6 mm,5 μm)3种品牌的色谱柱,按“2.2”项色谱条件测定各成分的峰面积,并分别计算峰面积的RSD,结果(R,S)-告依春为1.22%,靛玉红为1.57%,一枝蒿酮酸为1.67%,表明无明显差别。
2.9 样品含量的测定取复方一枝蒿速释微丸3批(批号130416、130418、130501),按“2.1.1”项下方法制备供试品溶液,精密吸取供试品溶液10 μL,按上述“2.2”项下色谱条件进行分析,测定峰面积,按外标法计算各样品中各成分的量,结果见表 3。
|
|
表 3 样品测定结果(mg·g-1,n=2) Table 3 Results of sample determination |
文献报道[10-13],以HPLC法测定一枝蒿酮酸、(R,S)-告依春、靛玉红时,多采用甲醇-0.2%甲酸水溶液、甲醇-水、乙腈-0.5%磷酸水溶液等系统为流动相。本文分别考察以甲醇-0.2%甲酸水溶液、乙腈-0.5%甲酸水溶液(10:90)、乙腈-0.5%磷酸水溶液梯度洗脱系统,结果表明,乙腈-0.5%磷酸水溶液梯度洗脱时,3个指标成分的分离效果较好,故选择乙腈(A)-0.5%磷酸水溶液(B)为流动相,梯度洗脱(0~15 min,3%A→10%A;15~20 min,10%A→35%A;20~35 min,35%A)。
3.2 供试品制备方法的考察本实验采用超声法制备供试品溶液,考察了浓度分别为20%、30%、40%、50%、60%乙醇水溶液对(R,S)-告依春、靛玉红、一枝蒿酮酸提取率的影响,发现50%的乙醇水溶液提取效果最好;同时考察了超声时间15、30、40、60 min对3个有效成分提取率的影响,发现超声40 min含量达到最高,40 min之后,超声时间对各成分提取率影响不大,所以选择超声时间为40 min。
3.3 小结使用本法对3批复方一枝蒿速释微丸中(R,S)-告依春、靛玉红和一枝蒿酮酸3个成分进行含量测定,结果3批样品中各成分含量波动不大,表明本方法能够在同一色谱条件下测定复方一枝蒿速释微丸中多个主要成分的含量,有利于控制产品的质量。
| [1] |
姜雯, 姚华, 薛桂蓬, 等. 复方一枝篙速释微丸的提取工艺优选[J]. 中国实验方剂学杂志, 2013, 19(5): 66. JANG W, YAO H, XUE GP, et al. Optimization of extraction technology for compound Yizhihao immediate-release pellets by orthogonal test[J]. Chin J Exp Tradit Med Form, 2013, 19(5): 66. |
| [2] |
孙东东, 李祥, 陈建伟, 等. 板蓝根化学成分研究(Ⅰ)[J]. 华西药学杂志, 2007, 22(5): 487. SUN DD, LI X, CHEN JW, et al. Isolation and identification of chemical constituents from Radix Isatidis (Ⅰ)[J]. West China J Pharm Sci, 2007, 22(5): 487. |
| [3] |
左丽, 李建北, 徐景, 等. 板蓝根的化学成分研究[J]. 中国中药杂志, 2007, 32(8): 688. ZUO L, LI JB, XU J, et al. Studies on chemical constituents in root of Isatis indigotica[J]. China J Chin Mater Med, 2007, 32(8): 688. |
| [4] |
刘盛, 陈万生, 乔传卓, 等. 不同种质板蓝根和大青叶的抗甲型流感病毒作用[J]. 第二军医大学学报, 2000, 21(3): 204. LIU S, CHEN WS, QIAO CZ, et al. Antiviral action of Radix Isatidis and Folium Isatidis from different germplasm against influenza A virus[J]. Acad J Second Mil Med Univ, 2000, 21(3): 204. |
| [5] |
武彦文, 高文远, 肖小河. 大青叶的研究进展[J]. 中草药, 2006, 37(5): 793. WU YW, GAO WY, XIAO XH. Advances in studies on Folium Isatidis[J]. Chin Tradit Herb Drugs, 2006, 37(5): 793. |
| [6] |
张连同, 邱世翠, 吕俊华, 等. 大青叶体外抑菌作用研究[J]. 时珍国医国药, 2002, 13(5): 282. ZHANG LT, QIU SC, LÜ JH, et al. The in vitro growth inhibition effect of Isatis indigotica Fort.(IIF)on Bacteria[J]. Lishizhen Med Mater Med Res, 2002, 13(5): 282. |
| [7] |
柳继锋, 张雪梅, 薛多清, 等. 大青叶的化学成分研究)[J]. 中国中药杂志, 2006, 31(23): 1961. LIU JF, ZHANG XM, XUE DQ, et al. Studies on chemical constituents from leaves of Isatis indigotica[J]. China J Chin Mater Med, 2006, 31(23): 1961. DOI:10.3321/j.issn:1001-5302.2006.23.012 |
| [8] |
杨建波, 吉腾飞, 宋卫霞, 等. 新疆一枝蒿化学成分的研究[J]. 中草药, 2008, 39(8): 1125. YANG JB, JI TF, SONG WX, et al. Chemical constituents from herb of Artemisia rupestris in Xinjiang[J]. Chin Tradit Herb Drugs, 2008, 39(8): 1125. |
| [9] |
秦子茹, 贺金华, 顾政一, 等. 一枝蒿不同溶剂提取物抗病毒作用的谱效关系研究[J]. 中国药房, 2015, 26(7): 889. QING ZR, HE JH, GU ZY, et al. Study on the spectrum-effect relationship of anti-virus effect of Artemisia rupestris extracts from different solvents[J]. China Pharm, 2015, 26(7): 889. DOI:10.6039/j.issn.1001-0408.2015.07.08 |
| [10] |
张洁, 顾政一, 何承辉. HPLC法同时测定新疆一枝蒿中木犀草素和一枝蒿酮酸的含量[J]. 中国实验方剂学杂志, 2009, 15(4): 1. ZHANG J, GU ZY, HE CH. Determination of luteolin and rupestonic acid in Artemisia rupestris by high performance liquid chromatography[J]. Chin J Exp Tradit Med Form, 2009, 15(4): 1. |
| [11] |
郑娟, 茅纯. HPLC波长转换法同时测定小儿咳喘灵颗粒中(R, S)-告依春、绿原酸和甘草苷的含量[J]. 中国现代应用药学, 2015, 32(6): 727. ZHENG J, MAO C. Simultaneous determination of epigoitrin, chlorogenic acid and liquiritin in child Kechuanling granules by wavelength conversion HPLC[J]. Chin J Mod Appl Pharm, 2015, 32(6): 727. |
| [12] |
蔡晓翠, 贺金华, 顾政一, 等. HPLC-MS/MS法同时测定新疆一枝蒿药材中5个成分的含量[J]. 药物分析杂志, 2013, 33(10): 1672. CAI XC, HE JH, GU ZY, et al. Simultaneous determination of 5 constituents in Artemisia rupestris L.by HPLC-MS/MS[J]. Chin J Pharm Anal, 2013, 33(10): 1672. |
| [13] |
马莉, 孙琴, 李友, 等. HPLC法测定板蓝根药材及制剂中靛蓝和靛玉红含量[J]. 药物分析杂志, 2010, 30(9): 1642. MA L, SUN Q, LI Y, et al. HPLC determination of indigo and indirubin in Radix Isatidis and Banlangen granules[J]. Chin J Pharm Anal, 2010, 30(9): 1642. |
| [14] |
李元圆, 何玉铃, 张永勋. HPLC法同时测定台湾市售女贞子中红景天苷、女贞子苷的含量[J]. 药物分析杂志, 2013, 33(2): 230. LI YY, HE YL, ZHANG YX. HPLC simultaneous determination of salidroside, nuezhenide in Fructus Ligustri Lucidi from Taiwan market[J]. Chin J Pharm Anal, 2013, 33(2): 230. |
 2017, Vol. 37
2017, Vol. 37 
