2. 广东天然药物研究与开发重点实验室, 湛江 524023
2. Guangdong Key Laboratory for Research and Development of Natural Drugs, Guangdong Medical University, Zhanjiang 524023, China
卵巢癌(ovarian carcinoma)是严重威胁女性生命健康的恶性肿瘤之一,其死亡率高居妇科肿瘤之首[1]。卵巢癌预后差与其起病隐匿、易发生腹腔性转移密切相关[2-4]。近年来研究发现,卵巢癌的侵袭转移与溶血磷脂酸(lysophosphatidic acid,LPA)/Gα13(LPA-Gα13)信号通路活化有关,LPA可通过G蛋白偶联受体抑制癌细胞凋亡,促进其增殖和侵袭、转移等生物学行为[5-6],而Gα13能特异介导LPA信号传递,激活Rho,促进卵巢癌细胞增殖、抑制凋亡、降低顺铂敏感性;同时上调组织促血管生成因子(vascular endothelial growth factor,VEGF)的表达,促进肿瘤血管生成间接刺激肿瘤生长和转移[7-9]。为进一步研究Gα13与卵巢癌侵袭迁移的关系,采用siRNA技术(small interfering RNA,siRNA)沉默卵巢癌细胞株HO-8910PM中Gα13的表达,观察沉默Gα13表达后,HO-8910PM细胞生物学行为变化,为卵巢癌靶向药物治疗提供参考。
1 材料与方法 1.1 主要实验材料与试剂HO-8910PM细胞株购自上海细胞生物所;RPMI 1640培养基(Gibco);小牛血清(杭州四季青工程有限公司);Amiloride、Dimethyl Amiloride(Sigma公司);Matrigel(BD公司);Gα13山羊IgG单抗(Santa Cruz公司);ECL试剂(Santa Cruz公司);辣根过氧化物酶标记山羊抗兔和抗小鼠IgG、辣根过氧化物酶标记兔抗山羊IgG(北京中杉公司);琼脂糖(Amresco公司);RT-PCR试剂盒(Qiagen公司);Trizol(上海生工生物工程技术公司);其余试剂均为国产分析纯。
1.2 细胞培养HO-8910PM细胞培养于含10%小牛血清,100 U·mL-1青霉素和100 μg·mL-1链霉素的RPMI-1640完全培养基中,37 ℃、5% CO2饱和湿度孵箱培养。取对数生长期细胞用于实验。
1.3 重组质粒的构建、鉴定和稳定转染株的筛选 1.3.1 重组质粒构建、鉴定以Shuttle Vector 1.0-CMV(cytomegalovirus,CMV)为载体,构建针对Gα13的shRNA重组表达质粒,由上海生物工程有限公司构建和鉴定(共构建了4个,分别命名为Shuttle Vector 1.0-CMV Gα13 A、B、C、D)。Gα13 A:上游引物为5′-TCGAGCCTCAAGCAGCTTATGCTATTCAAGAGATAGCATAAGCTGCTTGAGGTT A-3′,下游引物为5′-CTAGTAACCT CAAGCAGCTTATGCTATCTCTTGAATAGCATAAGCTGCTTGAGG C-3′;Gα13 B:上游引物为5′-TCGAGCAAG ATATTCTGCTTGCCATTCAAGAGATGGCAAGCAGAATATCTTGTTA-3′,下游引物为5′-CTAGTAACAAGATATTCTGCTTG CCATCTCTTGAATGGCAAGCAGAATATCTTG C-3′;Gα13 C:上游引物为5′-TCGAGGACCTATGTGAAGCGGC TGTTCAAGAGACAGCCGCTTCACATAGGTCTTA-3′,下游引物为5′-CTAGTAAGACCTATGTGAAGCGGCTGTCTCT TGAACAGCCGCTTCACATAGGTCC-3′;Gα13 D:上游引物为5′-TCGAGGTCCAAGGAGATCGACAAATTCAAGAG ATTTGTCGATCTCCTTGGACTT A-3′,下游引物为5′-CTAGTAAGTCCAAGGAGATCGACAAATCTCTTGAATTTGTCGATCTCCTTGGAC C-3′。根据分子克隆提供的操作步骤进行细菌转化,挑选阳性转化细菌,抽提质粒,并经公司测序鉴定正确后用于实验。质粒的抽提按照质粒抽提试剂盒说明书操作。
1.3.2 建立稳定低表达Gα13基因的人卵巢癌细胞HO-8910PM细胞株具体步骤按Lipofectamine 2000转染HO-8910PM细胞的标准化操作流程进行,在荧光显微镜下观察分析转染率。RT-PCR、Western Blot鉴定阳性克隆Gα13干扰效果。
1.4 MTT法检测细胞增殖能力每孔约8×103个细胞接种至96孔板,在37 ℃、5% CO2饱和湿度条件下过夜,实验干扰组转染重组质粒,同时设立阴性(空载体)对照组、空白(脂质体)组,每组设8个平行孔,并设PRMI 1640完全培养基调零孔,置培养板于孵箱中24、48 h,每孔加入MTT(5 mg·mL-1)10 μL,继续培养4 h。倾去培养液,每孔加入100 μL DMSO溶解,用微量振荡器摇振15 min,于酶标仪上以测定波长为570 nm,参考波长为450 nm,测定其吸光度。实验重复3次。
1.5 Matrigel检测HO-8910PM细胞侵袭能力将PVPF滤膜用manicure贴在Transwell小室上,风干;在膜的外表面涂Fibronectin 4.5 μg(10 μL,置超净台内风干,膜内表面涂Matrigel 5 μg(10 μL),干燥,形成人工重组基底膜;在24孔板内加入0.1%BSA-RPMI 1640,每孔600 μL;收集对数生长期的HO-8910PM细胞,悬浮于含0.1% BSA-RPMI 1640培养基中,终浓度为1×106个·mL-1;将Transwell小室浸于24孔板的条件培养基中,将细胞悬液加到Transwell小室中,每小室100 μL,并同时转染重组质粒,对照组加入等量的PBS。37 ℃、5% CO2温箱内孵育6 h。将Transwell小室取出,滤膜用甲醇固定1 min,苏木精染色3 min,水洗,伊红染色10 s,水洗,用PBS浸湿的棉签擦去滤膜内表面的细胞;用封片胶将滤膜封于载玻片上,于200×显微镜下计数穿过PVPF滤膜的细胞数。每膜计数上下左右中5个随机不同视野,每组平行设3个滤膜。
1.6 Transwell检测HO-8910PM细胞迁移能力Transwell实验不铺Matrigel胶,37 ℃、5% CO2温箱内孵育6 h取出小室,其余步骤参照“1.5”项下侵袭实验。
1.7 流式细胞术检测细胞的周期转染重组质粒48 h后,收集HO-8910PM细胞,1 000 r·min-1低速离心5 min,弃上清,PBS清洗1次,离心去PBS,加入预冷的70%乙醇,4 ℃固定24 h以上。3 000 r·min-1离心5 min除去乙醇,PBS清洗1次,3 000 r·min-1离心5 min弃PBS,加0.5 mL 50 μg·mL-1 PI(含100 μg·mL-1 RNase A)于避光处染色30 min,用Coulter EPTCSXL-31240流式细胞仪进行检测。每组均设3个平行管。
1.8 HO-8910PM细胞膜上Rho GTPases与[α-32P]GTP结合活性分析 1.8.1 细胞蛋白的提取以2.5×105个·mL-1细胞数密度接种,处理48 h后,常规收获各组细胞,在1×107个·mL-1细胞中加入100 μL预冷至0 ℃的NP 40裂解液裂解,冰上放置30 min,4 ℃、12 000×g离心15 min,将上清收集至另一微量离心管。
1.8.2 蛋白质浓度测定按Lowry比色法,以BSA为标准蛋白,用Ependorf Biophotometer仪测定样品蛋白浓度。
1.8.3 GTP结合活性的分析15 μL样品(60 μg细胞蛋白)中加入2×SDS加样缓冲液15 μL,沸水中煮沸5 min,经15% SDS PAGE电泳后电转移至NC膜,而后在缓冲液(25 mmol·L-1 Tris,192 mmol·L-1甘氨酸)中复性并孵育过夜,换成结合缓冲液(50 mmol·L-1 Tris PH 7.5,0.3% Tween 20,5 mmol·L-1 MgCl2,1 mmol·L-1 EGTA)室温孵育20 min后,加入[α-32P]GTP室温孵育90 min,用结合缓冲液洗NC膜3次,每次10 min,最后放射自显影观察定位于膜上的Rho GTPases与[α-32P]GTP的结合。
1.9 统计学分析本实验数据资料用x±s表示,采用SPSS13.0统计软件,单因素方差分析或t检验进行统计学处理。P < 0.05表示差异有显著性,P < 0.01表示数据有非常大的显著性差异。
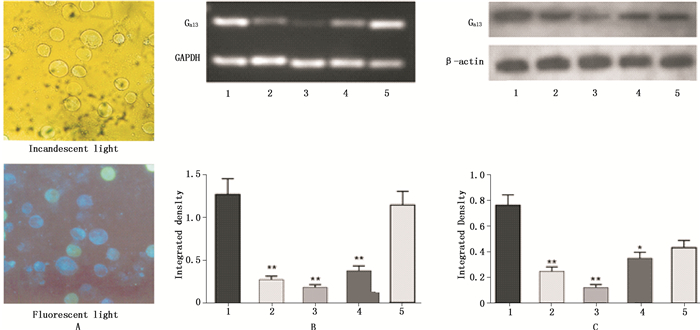
2 结果 2.1 沉默Gα13亚基的Shuttle Vector 1.0-CMV Gα13/ShRNA/HO-8910PM细胞系的建立和鉴定构建的Gα13亚基干扰质粒(Shuttle Vector 1.0-CMV Gα13 A、B、C、D)在脂质体的介导下转染人卵巢癌细胞HO-8910PM,作用48 h后,可见大量绿色荧光表达,表明Gα13亚基干扰质粒已成功转染入细胞中(图 1-A)。
|
A.阳性细胞克隆筛选和扩增(the positive cell clone was screened and amplified)B. RT-PCR法检测Gα13亚基的沉默效果(the silence effect of Gα13 was detected by RT-PCR)C. Western blot法检测Gα13亚基的沉默效果(the silence effect of Gα13 was detected by Western blot) 1. Shuttle Vector 1.0-CMV2. Shuttle Vector 1.0-CMV Gα13A3. Shuttle Vector 1.0-CMV Gα13B4. Shuttle Vector 1.0-CMV Gα13C5. Shuttle Vector 1.0-CMV Gα13D 注(note):与Shuttle Vector 1.0-CMV比较(compared to Shuttle Vector 1.0-CMV):*P < 0.05,**P < 0.01 图 1 稳定低表达Gα13亚基的HO8910PM细胞系的建立和鉴定 Figure 1 Construction and identification of stable low expression of Gα13 gene in HO8910PM cell lines |
用RT-PCR的方法检测HO-8910PM细胞中干扰效率显示,Shuttle Vector 1.0-CMV Gα13 A、B、C、D各组较对照载体(试剂盒提供)组Gα13 mRNA表达明显下调,而Shuttle Vector 1.0-CMV Gα13B组干扰效率可达90%以上(图 1-B)。Western blot检测也显示,Shuttle Vector 1.0-CMV Gα13 A、B、C、D各组较对照载体组Gα13蛋白表达明显减少,且以Shuttle Vector 1.0-CMV Gα13B组干扰效果最明显,与RT-PCR结果一致(图 1-C)。因此,选取Shuttle Vector 1.0-CMV Gα13B干扰组作为有效干扰组进行后续实验研究。
2.2 沉默Gα13亚基对HO-8910PM细胞增殖的影响HO-8910细胞转染的Shuttle Vector 1.0-CMV Gα13B质粒,分别培养24 h和48 h,用MTT法测定其对细胞生长的影响,与空白(脂质体)组、穿梭载体1.0-CMV组相比,Gα13B穿梭载体1.0-CMV组(Shuttle Vector 1.0-CMV Gα13B)可明显抑制HO-8910PM细胞的增殖(P < 0.01),而空白组与穿梭载体1.0-CMV组之间无明显差异(P > 0.05),见表 1。
|
|
表 1 沉默Gα13B对HO-8910PM细胞的增殖抑制作用 Table 1 Inhibition of HO-8910PM cells proliferation by silencing Gα13B |
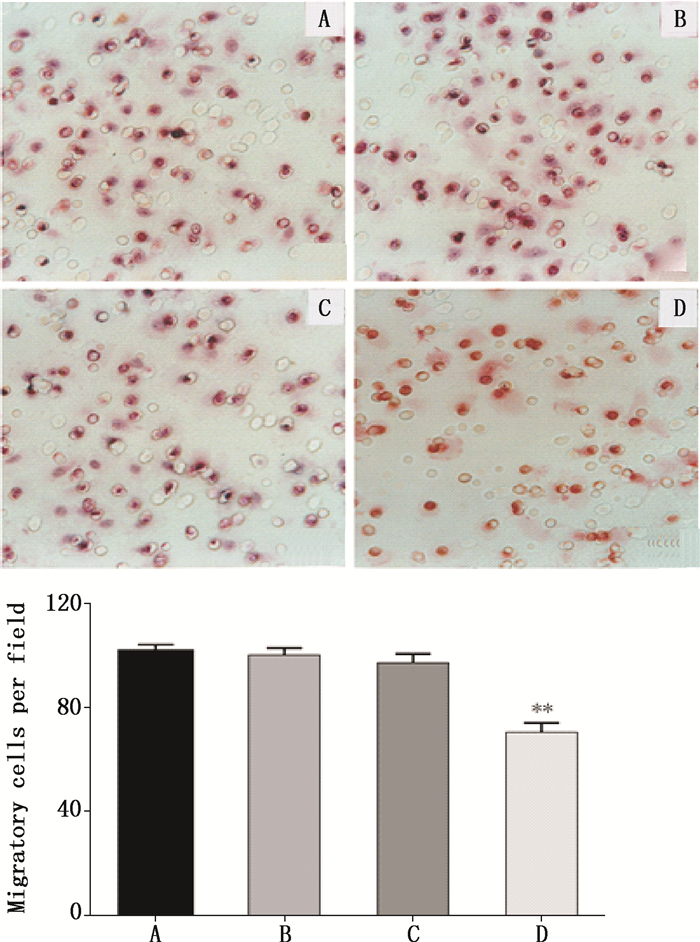
siRNA转染48 h后,显微镜下计数空白组、穿梭载体1.0-CMV组和Gα13B穿梭载体1.0-CMV组穿过Transwell上室的细胞数,并进行统计分析。结果显示,与空白组和穿梭载体1.0-CMV组相比,Gα13B穿梭载体1.0-CMV组穿过小室的细胞数明显减少(P < 0.01),而空白组和穿梭载体1.0-CMV组的细胞数无明显差异(P > 0.05)。说明Gα13亚基被沉默后,HO-8910PM细胞的迁移能力明显下降,见图 2。
|
A.空白组(control)B.脂质体组(liposome)C穿梭载体1.0-CMV组(Shuttle Vector 1.0-CMV)D. Gα13B穿梭载体1.0-CMV组(Shuttle Vector 1.0-CMV Gα13B) 注(note):Gα13B穿梭载体1.0-CMV组与穿梭载体1.0-CMV/脂质体组/空白组比较(Shuttle Vector 1.0-CMV Gα13B group compared to control/Lip/Shuttle Vector 1.0-CMV group):**P < 0.01 图 2 沉默Gα13亚基对HO8910PM细胞迁移能力的影响 Figure 2 Effect of Gα13B gene silencing on migration of HO-8910PM cells |
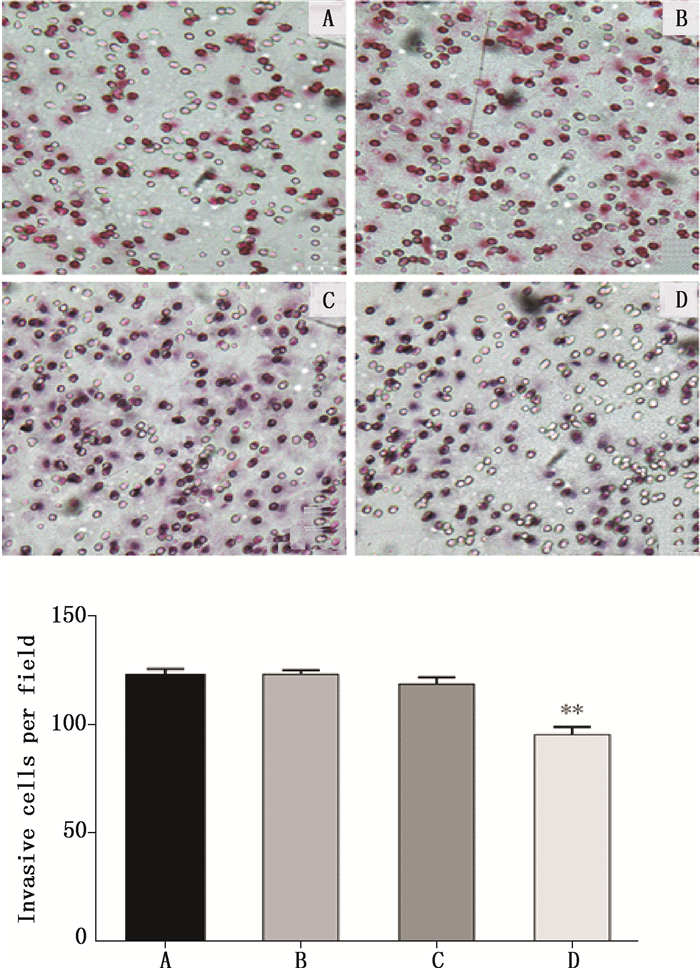
siRNA转染48 h后,显微镜下计数空白组、穿梭载体1.0-CMV组和Gα13B穿梭载体1.0-CMV组穿过基底膜的细胞数,并进行统计分析。结果显示,与空白组和穿梭载体1.0-CMV组相比,Gα13B穿梭载体1.0-CMV组穿过基底膜的细胞数明显减少(P < 0.01),而空白组和穿梭载体1.0-CMV组的细胞数无明显差异(P > 0.05)。说明Gα13亚基被沉默后,HO-8910PM细胞侵袭能力下降,见图 3。
|
A.空白组(control)B.脂质体组(liposome)C.穿梭载体1.0-CMV组(Shuttle Vector 1.0-CMV)D. Gα13B穿梭载体1.0-CMV组(Shuttle Vector 1.0-CMV Gα13B) 注(note):Gα13B穿梭载体1.0-CMV组与穿梭载体1.0-CMV/脂质体组/空白组比较(Shuttle Vector 1.0-CMV Gα13B group compared to control/Lip/Shuttle Vector 1.0-CMV group):**P < 0.01 图 3 沉默Gα13亚基对HO8910PM细胞侵袭能力的影响 Figure 3 Effect of Gα13 B gene silencing on HO-8910PM cells invasion |
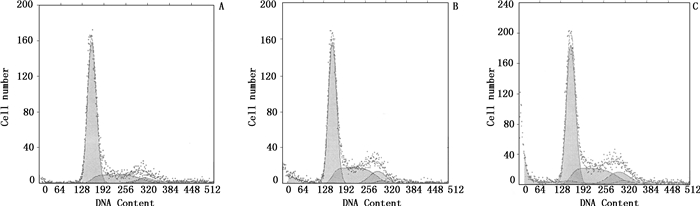
HO-8910PM细胞转染重组质粒Shuttle Vector 1.0-CMV Gα13B细胞48 h后,收集各组细胞,流式细胞仪检测发现,与空白组和穿梭载体1.0-CMV组相比,Gα13B穿梭载体1.0-CMV组G0/G1期细胞数增多,S期和G2/M期细胞数减少,统计分析具有明显差异(P < 0.05);而空白组和穿梭载体1.0-CMV组的细胞数无明显差异(P > 0.05),见图 4。
|
A.空白组(control)B.穿梭载体1.0-CMV组(Shuttle Vector 1.0-CMV)C. Gα13 B穿梭载体1.0-CMV组(Shuttle Vector 1.0-CMV Gα13B) 图 4 沉默Gα13亚基对HO8910PM细胞细胞周期的影响 Figure 4 Effect of Gα13 B gene silencing on HO-8910PM cell cycle |
放射自显影结果显示,HM-8910PM细胞转染重组质粒12、24和48 h后,Rho GTPases结合的GTP量明显低于对照组。以下结果提示转染质粒后12 h可诱导Rho GTPases与GTP结合能力的下降,24 h后效果更明显,48 h与24 h差别不大,提示Gα13亚基被沉默后,HO-8910PM细胞膜上Rho GTPases与GTP结合活性下降,见图 5。

|
1.空白组(control)2.穿梭载体1.0-CMV组(Shuttle Vector 1.0-CMV)3. Gα13 B穿梭载体1.0-CMV组12 h(Shuttle Vector 1.0-CMV Gα13 B for 12 h)4. Gα13 B穿梭载体1.0-CMV组24 h(Shuttle Vector 1.0-CMV Gα13 B for 24 h)5. Gα13 B穿梭载体1.0-CMV组48 h(Shuttle Vector 1.0-CMV Gα13 B for 48 h) 图 5 沉默Gα13亚基对对HO8910PM细胞的Rho GTPases与GTP结合活性的影响 Figure 5 Effect of Gα13 B gene silencing on the GTP-binding activity of Rho GTPases in HO-8910PM cells |
肿瘤转移的关键因素是肿瘤细胞获得迁移和侵袭能力,抑制肿瘤细胞的迁移侵袭能力已经成为近年研究肿瘤的热点,靶向抑制参与肿瘤细胞迁移侵袭过程的基因为治疗肿瘤提供了新思路。研究发现,异源三聚体G蛋白是影响G蛋白偶联信号传导的关键分子,其中Gα亚基被认为是影响G蛋白信号传导的主要因素,其家族成员主要包括Gαs、Gαi、Gαq和Gα12/13[10-11]。Gα13是Gα12/13家族的2个成员之一,活化的Gα13能直接与Rho特异性的鸟苷酸交换因子(RhoGEFs)相互作用来激活Rho[12-14],影响细胞增殖、细胞骨架重构、细胞迁移与侵袭等一系列的生理过程。
Gα13被认为和受体酪氨酸激酶一样能调控G蛋白偶联受体特异性刺激细胞迁移[15-17]。有证据指出,Gα13特异介导LPA信号传递,通过激活Rho,促进卵巢癌细胞增殖和抑制凋亡;同时上调组织促血管生成因子VEGF的表达,促进肿瘤血管生成间接刺激肿瘤生长和转移[9, 18-20]。也有资料显示,沉默Gα13能特异性消除LPA刺激所引起的胰腺癌细胞侵袭转移[21]。那么,沉默Gα13是否能同样消除已形成高转移特性的卵巢癌细胞的侵袭转移等恶性生物学行为,需要针对Gα13基因设计siRNA序列,筛选出针对Gα13基因干扰效果最好的siRNA,研究Gα13基因被沉默后,高转移卵巢癌细胞株HO-8910PM生物学行为的变化。结果发现,Shuttle Vector 1.0-CMV Gα13B对Gα13基因干扰效果最为明显,并且,Gα13基因被沉默后,HO-8910PM细胞膜上Rho GTPases与GTP结合活性明显下降,细胞穿过基底膜细胞数明显减少,表明Gα13基因沉默后HO-8910PM细胞的侵袭、迁移能力明显下降,细胞被阻滞在G0/G1期,提示了干扰Gα13的表达能有效降低卵巢癌的侵袭转移能力。
尽管沉默Gα13能在一定程度上降低HO-8910PM细胞的侵袭、迁移能力,但其抑制效果并不十分理想。这也许与Gα13和Gα12/13的另一成员Gα12表达在不同类型肿瘤之间存在差异性有关。最近有研究报道,抑制Gα12的转录活性和沉默Gα12能显著抑制卵巢癌细胞的增殖与生长[9, 22],因此,进一步探讨Gα12/13不同家族成员在卵巢癌组织中的分布,阐明Gα12/13家族成员参与卵巢癌侵袭转移过程的相关机制,对指导卵巢癌的靶向治疗有更重要的临床意义。
| [1] |
SIEGEL RL, MILLER KD, JENAL A. Cancer statistics[J]. CA Cancer J Clin, 2015, 65(1): 5e29. |
| [2] |
朱银芳, 谭布珍. 卵巢癌相关转移基因的研究进展[J]. 肿瘤, 2014, 34(9): 875. ZHU YF, TANG BZ. Advance in research on ovarian cancer-related metastatic genes[J]. Tumor, 2014, 34(9): 875. |
| [3] |
ROOTH C. Ovarian cancer:risk factors, treatment and management[J]. Br J Nurs, 2013, 22(17): S23. |
| [4] |
HANSEN JM, COLEMAN RL, SOOD AK. Targeting the tumour microenvironment in ovarian cancer[J]. Eur J Cancer, 2016, 56(1): 131. |
| [5] |
SUGIMOTO N, TAKUWA N, YOSHIOKA K, et al. Rho-dependent, Rho kinase-independent inhibitory regulation of Rac and cell migration by LPA1 receptor in Gi-inactivated CHO cells[J]. Exp Cell Res, 2006, 312(10): 1899. DOI:10.1016/j.yexcr.2006.02.020 |
| [6] |
余雪琛, 张元珍, 陈慧君. 溶溶血磷脂酸溶溶血磷脂酸通过RAC的活化诱导卵巢癌细胞的侵袭转移[J]. 中华肿瘤杂志, 2015, 37(2): 95. YU XC, ZHANG YZ, CHEN HJ. Lysophosphatidic acid(LPA) stimulates invasion and metastatic colonization of ovarian cancer cells through Rac activation[J]. Chin J Oncol, 2015, 37(2): 95. |
| [7] |
MOERS A, NURNBERG A, GOBBELS S, et al. Galpha12/Galpha13 deficiency causes localized overmigration of neurons in the developing cerebral and cerebellar cortices[J]. Mol Cell Biol, 2008, 28(5): 1480. DOI:10.1128/MCB.00651-07 |
| [8] |
GOMATHINAYAGAM R, MURALIDHARAN J, HA JH, et al. Hax-1 is required for Rac1-Cortactin interaction and ovarian carcinoma cell migration[J]. Genes Cancer, 2014, 5(3-4): 84. |
| [9] |
HA JH, GOMATHINAYAGAM R, YAN M, et al. Determinant role for the gep oncogenes, Gα12/13, in ovarian cancer cell proliferation and xenograft tumor growth[J]. Genes Cancer, 2015, 6(7-8): 356. |
| [10] |
OLDHAM WM, HAMM HE. Heterotrimeric G protein activation by G-protein-coupled receptors[J]. Nat Rev Mol Cell Biol, 2008, 9(1): 60. DOI:10.1038/nrm2299 |
| [11] |
杨纪春, 施小凤, 奚晓东. G蛋白与整合素αⅡbβ3的双向信号转导[J]. 中国生物化学与分子生物学报, 2015, 31(3): 251. YANG JC, SHI XF, XI XD. G protein and integrin αIIbβ3 bidirectional signal transduction[J]. Chin J Biochem Mol Biol, 2015, 31(3): 251. |
| [12] |
GU JL, MULLER S, MANCINO V, et al. Interaction of Gα12 with Gα13 and Gαq signaling pathways[J]. Proc Natl Acad Sci USA, 2002, 99(14): 9352. DOI:10.1073/pnas.102291599 |
| [13] |
GONG H, SHEN B, FLEVARIS P, et al. G protein subunit Galpha 13 binds to integrin alphaⅡbbeta3 and mediates integrin "outside-in" signaling[J]. Science, 2010, 327(5963): 340. DOI:10.1126/science.1174779 |
| [14] |
FLEVARIS P, STOJANOVIC A, GONG H, et al. A molecular switch that controls cell spreading and retraction[J]. J Cell Biol, 2007, 179(3): 553. DOI:10.1083/jcb.200703185 |
| [15] |
CHOW CR, EBINE K, KNAB LM, et al. Cancer cell invasion in three-dimensional collagen is regulated differentially by Gα13 protein and discoidin domain receptor 1-Par3 protein signaling[J]. J Biol Chem, 2016, 291(4): 1605. DOI:10.1074/jbc.M115.669606 |
| [16] |
KELLY P, CASEY PJ, MEIGS TE. Biologic functions of the G12 subfamily of heterotrimeric g proteins:growth, migration, and metastasis[J]. Biochemistry, 2007, 46(23): 6677. DOI:10.1021/bi700235f |
| [17] |
GOLDSMITH ZG, HA JH, JAYARAMAN M, et al. Lysophosphatidic acid stimulates the proliferation of ovarian cancer cells via the gep proto-oncogene Gα12[J]. Genes Cancer, 2011, 2(5): 563. DOI:10.1177/1947601911419362 |
| [18] |
SUGIMOTO N, TAKUWA N, YOSHIOKA K. Rho-dependent, Rho kinase-independent inhibitory regulation of Rac and cell migration by LPA1 receptor in Gi-inactivated CHO cells[J]. Exp Cell Res, 2006, 312(10): 1899. DOI:10.1016/j.yexcr.2006.02.020 |
| [19] |
TKACHENKO E, SABORI-GHOMI M, PERTZ O, et al. Protein kinase A governs a RhoA-RhoGDI protrusion-retraction pacemaker in migrating cells[J]. Nat Cell Biol, 2011, 13(6): 660. |
| [20] |
CHANG F, LEMMON C, LIETHA D, et al. Tyrosine phosphorylation of Rac1:a role in regulation of cell spreading[J]. PLoS One, 2011, 6(12): e28587. DOI:10.1371/journal.pone.0028587 |
| [21] |
GARDNER JA, HA JH, JAYARMAN M, et al. The gep proto-oncogene Gα13 mediates lysophosphatidic acid mediated migration of pancreatic cancer cells[J]. Pancreas, 2013, 42(5): 819. DOI:10.1097/MPA.0b013e318279c577 |
| [22] |
HA JH, WARD JD, VARADARAJALU L, et al. The gep proto-oncogene Gα12 mediates LPA-stimulated activation of CREB in ovarian cancer cells[J]. Cell Signal, 2014, 26(1): 122. DOI:10.1016/j.cellsig.2013.08.012 |
 2017, Vol. 37
2017, Vol. 37 
