文章信息
- 卢巧玲, 万美云, 严志彬, 官德义, 何水林
- LU Qiaoling, WAN Meiyun, YAN Zhibin, GUAN Deyi, HE Shuilin
- 高温高湿下CaRPT2在辣椒抗青枯病中的作用
- Role of CaRPT2 in the resistance of pepper to bacterial wilt under high-temperature-high-humidity
- 亚热带农业研究, 2023, 19(3): 145-152
- Subtropical Agriculture Research, 2023, 19(3): 145-152.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2023.03.001
-
文章历史
- 收稿日期: 2023-07-03
辣椒(Capsicum annuum L.)是1年生或有限多年生植物,我国的播种面积与产量均位于世界前列,具有较高的经济效益[1]。辣椒富含Vc、辣椒红素和辣椒素,有着“蔬菜之冠”的美誉[2]。在大田生产中,辣椒极易遭受土传病害的胁迫,包括由青枯菌(Ralstonia solanacearum)侵染引起的青枯病(bacterial wilt)。青枯菌一般从植物根系入侵,在维管束木质部定殖,通过堵塞导管而导致地上部分缺水而引发“青枯”症状[3-4]。青枯病的爆发与环境温湿度关系密切,在温度较低且土壤含水量较少的环境下,青枯病发病较轻;而在高温高湿下,则发病严重[5]。
植物借由模式识别受体(pattern recognition receptors, PRRs)以及胞内免疫受体蛋白(nucleotide-binding site and leucine-rich repeat domain receptors, NLRs)构建起双重免疫应答模式,即病程相关分子模式激活的免疫反应(pathogen-associated molecular patterns triggered immunity, PTI)与效应子引发的免疫反应(effector-triggered immunity, ETI),用于抵御病原菌的入侵[6]。在高温环境下,植物的免疫系统会受到抑制,尤其是ETI介导的免疫反应以及水杨酸(salicylic acid, SA)模块[7-9]。Kim et al[7]研究发现,在拟南芥中提高CBP60g的表达以及翻译水平可以补偿高温对拟南芥造成的免疫损失。Yang et al[10]研究发现,辣椒等茄科植物在常温下主要启动SA和茉莉酸(jasmonic acid, JA)介导的免疫反应来提高抗病能力;而在高温高湿下,一般启动细胞分裂素(cytokinin, CK)介导的防御反应来提高抗病能力。因此,研究高温高湿下的抗病机制,对有效开展辣椒抗青枯病遗传改良具有重要意义。
NRL(NPH3/RPT2-Like)蛋白广泛存在于陆地植物中,在拟南芥中含有33个家族成员,其中根向光性(rootphototropism 2, RPT2)与非向光性下胚轴弯曲3(non-phototropichypocotyl 3, NPH3)属于家族创始成员。该蛋白家族成员含有3个保守的结构域,包括N末端的BTB/POZ(broad complex, tramtrack, bric abrac/pox virus and zinc finger)结构域、中间的NPH3结构域以及C末端的螺旋—螺旋结构域[11-12]。Christie et al[13]研究发现,RPT2是调控植物向光性生长以及叶片的定位和伸展所必须的,且RPT2与NPH3已被鉴定为专用于趋光性的信号转导,但在应答生物胁迫与非生物胁迫方面的研究还鲜见报道。本实验室前期通过分析高温高湿下应答青枯菌侵染的辣椒RNA-seq数据[10]关注到NRL蛋白家族成员CaRPT2,其表达可受高温高湿下青枯菌侵染的诱导,暗示该基因可能参与高温高湿下辣椒抗青枯病的过程。鉴于此,本研究进一步验证了CaRPT2在高温高湿下辣椒抗青枯病中的可能作用,旨在为开展茄科植物抗青枯病遗传改良提供依据。
1 材料与方法 1.1 供试材料 1.1.1 植物材料辣椒自交系HN42和本氏烟草的整个生长过程均在25 ℃、相对湿度70%、16 h光照/8 h黑暗的光周期条件下进行。本试验于2022年9月至2023年4月在福建农林大学辣椒逆境作物生物学试验室进行。
1.1.2 载体入门载体pDONR207,表达载体pEarleyGate101。
1.1.3 菌株大肠杆菌感受态DH5α和农杆菌感受态GV3101。
1.2 试验方法 1.2.1 CaRPT2基因的克隆及表达载体构建通过NCBI(https://www.ncbi.nlm.nih.gov/)在线网站查找CaRPT2的基因序列。选取该基因起始密码子后20 bp和终止密码子前20 bp左右加上对应的重组接头作为克隆基因引物,引物设计见表 1。利用RPT2特异性引物将其开放阅读框(full-length open reading frames, ORF)从辣椒均一化cDNA文库中克隆出来。利用Gateway技术将目的片段连接到pDONR207入门载体上,通过大肠杆菌转化筛选及菌液PCR验证,获得阳性菌株,经测序比对无突变,提取质粒,并通过LR反应将其连接到表达载体pEarleyGate101上,再次进行大肠杆菌转化筛选及菌液PCR验证,获得含有目标基因的重组质粒。
| 引物 | 序列(5′-3′) |
| CaRPT2-F | GGGGACAAGTTTGTACAAAAAAGCAGGCTTCATGGCTGCTCCTATCAAGAA |
| CaRPT2-R | GGGGACCACTTTGTACAAGAAAGCTGGGTCTTAAGAAATGGAAAATCTTC |
对35S∶CaRPT2-101重组质粒与空载35S∶00进行农杆菌转化获得阳性菌液后,在含有对应抗生素的培养基中进行扩繁。次日,在离心机上28 ℃、5 000 r·min-1离心10 min去上清液,使用诱导悬浮液(10 mmol·L-1 MES,10 mmol·L-1 MgCl2,200 mmol·L-1 AS,pH=5.0~5.4)悬浮菌体沉淀,利用分光光度计将菌液吸收掉的光密度值(D)调至0.8。然后将菌液放在28 ℃恒温摇床上缓慢孵育2 h,之后使用一次性无菌注射器将调好的农杆菌菌液注射到4~6叶期的辣椒或烟草叶片上。
1.2.3 亚细胞定位将农杆菌菌液注射至烟草叶片,置于生长室中继续培养48 h。将剪切成合适大小的叶片放置在载玻片上,通过激光共聚焦显微镜观察并拍照记录。
1.2.4 植物总蛋白提取及蛋白质印记实验(Western blot)采集农杆菌侵染过的植物叶片并在液氮环境下迅速研磨成粉末状,随后加入植物蛋白提取液,进行涡旋振荡,置于冰上1 h,4 ℃、12 000 r·min-1离心10 min,取上清液于新试管中。将获得的植物总蛋白进行变性,变性后的蛋白样品依次加入到聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)上进行垂直电泳。电泳完成后,将含有目的蛋白的分离胶割下,运用半干转法将分离胶上的目的蛋白转到聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)上。将该膜置于含5%脱脂奶粉的TBST缓冲液中封闭1 h。TBST缓冲液:三乙醇胺缓冲盐水溶液(tris buffered saline, TBS)+5%吐温-20(Tween 20)。接着将该膜置于目的蛋白对应标签抗体的稀释液中(V一抗∶V封闭缓冲液=1∶5 000),室温孵育1 h或4 ℃孵育过夜,用1×TBST缓冲液清洗PVDF膜,每次5 min,重复3次。随后将PVDF膜置于含有对应二抗的稀释液中(V二抗 ∶ VTBST缓冲液=1 ∶ 20 000),室温孵育1 h,用1×TBST缓冲液清洗PVDF膜,每次5 min,重复3次。清洗完毕将PVDF膜置于ECL显影液中反应1 min,在LAS4000显影仪中显影并拍照记录。
1.2.5 辣椒叶片总RNA提取及cDNA的逆转录取50~100 mg新鲜植物叶片于液氮下迅速研磨成粉末,加入800 μL Trizol试剂进行震荡。待样品与试剂充分混匀,再加入200 μL氯仿,剧烈震荡30 s。4 ℃、12 000 r·min-1离心10 min,取400 μL上清液于新的1.5 mL无RNA酶离心管中,再加入200 μL无水乙醇。颠倒混匀后,将所有混合物转移到RNA吸附柱中。4 ℃、12 000 r·min-1离心1 min,倒掉收集管中的废液,加入600 μL洗脱液(washing buffer)重复漂洗2遍,接着将柱子转移到新的1.5 mL无RNA酶离心管中,室温放置10 min,加入30 μL无RNA酶的水静置2 min充分溶解RNA,4 ℃、12 000 r·min-1离心2 min收集RNA。本研究使用HiScript Q RT SuperMix for qPCR试剂盒(诺唯赞公司)进行cDNA的逆转录,使用ChamQ SYBRⓇ qPCR Master Mix试剂盒(诺唯赞公司)进行实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)实验。qRT-PCR引物设计见表 2。
| 引物 | 序列(5′-3′) |
| qRT-CaRPT2-F | AGTTGCCTTGACCAGCCTTT |
| qRT-CaRPT2-R | GGTGGTGATCTGCTCGGAAA |
选取4~6叶期的辣椒植株进行青枯菌接种,并分别置于28 ℃和37 ℃、相对湿度70%的智能型光照培养箱中。待高温高湿接种青枯菌(R.solanacearum inoculation under the condition of high temperature and high humidity, RSHT)处理的辣椒植株地上部分出现萎蔫时采集根系,并同时采集高温胁迫(high temperature stress, HTS)、常温下接种青枯菌(R.solanacearum inoculation, RS)、常温(room temperature, RT)处理下的根系,提取上述不同处理下的植物总RNA。后续的样品建库以及测序分析均委托诺禾致远生物公司完成。
2 结果与分析 2.1 高温高湿下青枯菌侵染诱导CaRPT2表达FPKM(fragments per kilobase per million)值是一种用于衡量RNA-seq数据中基因表达量的单位。它考虑了RNA序列的长度和测序深度的影响,反映一个基因在RNA样本中的相对表达水平。本试验以FPKM值作为衡量表达水平的标准,对青枯菌处理后辣椒根部的RNA-seq数据进行分析,发现在高温高湿接种青枯菌处理下1个NRL蛋白家族成员RPT2被显著诱导表达上调(图 1)。通过NCBI在线网站对该基因编号进行检索,发现该基因为CaRPT2(XP_016557805.1)。

|
RT: 常温,RS: 常温下接种青枯菌, HTS: 高温胁迫, RSHT: 高温高湿接种青枯菌。不同大写字母表示差异达极显著水平(P < 0.01)。 图 1 不同处理下辣椒自交系HN42根中CaRPT2表达的FPKM值 Figure 1 FPKM value of CaRPT2 in root of pepper inbred line HN42 under different treatments |
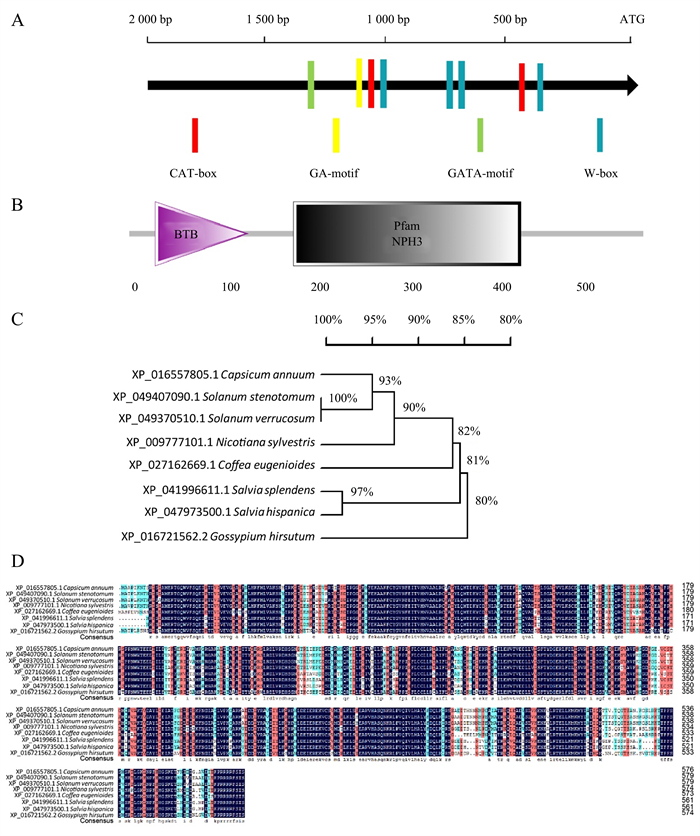
对CaRPT2序列进行分析发现,其cDNA全长为2 113 bp,包含一段长度为1 731 bp的ORF,编码576个氨基酸。通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线网站对CaRPT2的启动子进行分析发现,该启动子上含有多个与分生组织表达相关的顺式作用元件以及与非生物胁迫响应相关的顺式作用元件(图 2A),暗示其可能参与逆境胁迫应答。通过Smart(http://smart.embl-heidelberg.de/)在线网站分析CaRPT2的蛋白结构域,发现CaRPT2中存在BTB结构域以及NPH3结构域(图 2B)。通过NCBI在线网站对CaRPT2的氨基酸序列进行比对,并与其他几种植物的同源蛋白进行进化树分析和蛋白序列比对,结果显示,CaRPT2与狭叶茄(Solanum stenotomum, XP_049407090.1)、疣状茄(Solanum verrucosum, XP_049370510.1)、美花烟草(Nicotiana sylvestris, XP_009777101.1)、咖啡(Coffea eugenioides, XP_027162669.1)、一串红(Salvia splendens, XP_041996611.1)、鼠尾草(Salvia hispanica, XP_047973500.1)和棉花(Gossypium hirsutum, XP_016721562.2)有着较高的同源性(图 2C、2D)。
|
A.CaRPT2启动子上的顺式作用元件;B.结构域分布; C.系统进化树;D.氨基酸序列比对。 图 2 CaRPT2的氨基酸序列及其与其他物种同源蛋白的多重序列比对 Figure 2 Phylogenetic tree and sequence alignment of CaRPT2 in pepper and other species |
通过设计特异性引物,利用PCR扩增技术从辣椒cDNA文库中克隆出CaRPT2的CDS序列,并以琼脂糖凝胶电泳实验验证PCR反应结果,观察到在1 000~2 000 bp之间有条清晰的条带(图 3A),与数据库中CaRPT2的CDS序列长度基本相同。利用DNA纯化回收试剂盒对该特异性条带进行纯化回收,通过BP反应将该片段重组至入门载体pDONR207,进行大肠杆菌转化筛选及菌液PCR验证。结果显示,在1 500~2 000 bp之间出现清晰且单一的条带(图 3B),符合预期。随机挑选其中一管菌液,利用pDONR-F/R引物对插入片段进行测序,其测序结果与数据库中CaRPT2的CDS序列相一致。提取该测序菌液中的质粒并进行验证(图 3C),用于后续试验。通过LR反应将CaRPT2-pDONR207重组至表达载体pEarleyGate101中,进行大肠杆菌转化筛选,进一步通过菌液PCR验证在1 500~2 000 bp之间出现清晰的条带(图 3D),对菌液进行扩繁以及质粒提取,即获得后续试验所需的CaRPT2-pEarleyGate101重组表达载体(图 3E)。

|
A.CaRPT2琼脂糖凝胶电泳图;B.连接到入门载体pDONR207上的菌液PCR验证;C.重组pDONR207载体的CaRPT2基因质粒验证电泳图;D.连接到表达载体pEarleyGate101上的菌液PCR验证;E.重组pEarleyGate101载体的CaRPT2基因质粒验证电泳图。A、B、D中M为DNA Marker DL2 000;C、E中M为DNA Marker DL15 000。 图 3 CaRPT2基因相关载体构建的PCR验证电泳图 Figure 3 Verification of construction of CaRPT2 gene related vector by PCR |
蛋白质在植物细胞内的分布与其功能之间存在着密切的联系。为了分析CaRPT2的功能,进一步将前期构建的CaRPT2-pEarleyGate101重组表达载体转入农杆菌菌株GV3101中。以35S∶YFP为对照,配制农杆菌D600 nm=0.8的侵染液,并以无菌注射器注射侵染本氏烟草的成熟叶片。将侵染完成的烟草置于人工气候室培养48 h,利用激光共聚焦显微镜观察烟草表皮细胞的黄色荧光信号,发现CaRPT2-101农杆菌侵染过的本氏烟草叶片的表皮细胞中黄色荧光仅出现在细胞膜与细胞质上,而空载农杆菌侵染的本氏烟草叶片整个表皮细胞均检测到黄色荧光信号(图 4)。由此说明,CaRPT2可分布于细胞膜与细胞质中。

|
图 4 CaRPT2在本氏烟草叶片表皮细胞中的亚细胞定位 Figure 4 Subcellular localization of CaRPT2 in epidermal cell of Nicotiana benthamiana leaves |
为了初步验证CaRPT2是否在高温高湿下辣椒对抗青枯病过程中发挥作用,本研究构建了融合载体35S∶CaRPT2-GFP和空载对照35S∶GFP,分别进行农杆菌转化。通过无菌注射器将农杆菌注射入4~6叶期的辣椒叶片中,并分别置于28 ℃和37 ℃的恒温培养箱中进行处理,48 h后采样提取植物总蛋白并进行Western Blot实验,结果表明,CaRPT2-GFP与空载对照组均能够在辣椒叶片中表达(图 5A)。此外,本试验进一步通过qRT-PCR检测CaRPT2的转录表达水平,结果显示,CaRPT2瞬时过表达的辣椒叶片中CaRPT2的转录表达水平明显高于对照组(图 5B),由此说明CaRPT2在辣椒植株内的表达是成功的,可进行后续试验。Yang et al[10]研究发现,CaMgst3在高温高湿接种青枯菌的条件下起到了正调节的作用。本试验通过qRT-PCR检测发现,在高温高湿条件下,瞬时过表达CaRPT2能够引起免疫相关标记基因CaMgst3转录表达水平上调(图 5C)。根据上述数据初步证明,CaRPT2在辣椒应答青枯菌侵染的过程中起到了积极调节的作用。

|
A.Western Blot检测;B.CaRPT2表达水平;C.CaMgst3表达水平。anti-GFP为抗GFP的抗体;CBB为考马斯亮蓝;不同大写字母表示差异达极显著水平(P < 0.01)。 图 5 瞬时过表达CaRPT2对免疫相关标记基因的影响 Figure 5 Effect of transient overexpression of CaRPT2 on immune-related marker genes |
辣椒是目前世界范围内具有重要农业价值的茄科蔬菜。与水稻(Oryza sativa)、拟南芥(Arabidopsis thaliana)等模式植物不同的是,辣椒在大田生产中极易遭受青枯菌的危害而造成严重的经济损失。本研究对不同处理下辣椒根部的RNA-seq数据进行分析,发现在高温高湿接种青枯菌处理下有1个NRL蛋白家族成员表达量明显上调。NRL蛋白家族成员RPT2作为拟南芥向光性的信号转导蛋白,在植物的向光性生长、叶片定位及叶片伸展过程中发挥重要的作用[13-14],但在生物胁迫与非生物胁迫过程中的作用还鲜见报道。
本研究利用RPT2的特异性引物将RPT2的ORF从辣椒均一化cDNA文库中克隆出来,并通过Gateway技术将目的片段成功连接到表达载体中。对CaRPT2的氨基酸序列进行分析发现,该蛋白含有保守的BTB结构域及NPH3结构域,且与其他物种中的同源基因有着较高的同源性,表明该基因相对保守。在亚细胞定位实验中,发现CaRPT2定位于细胞质与细胞膜中。本实验室前期大量研究表明,茄科作物在高温高湿下启动CK介导的免疫反应机制,特异性激活Mgst3和PRP1等GST编码基因的表达上调,从而提高茄科植物在高温高湿下抗青枯病的能力[10, 15-17]。本研究在辣椒叶片中瞬时过表达CaRPT2能够激活辣椒等茄科植物高温高湿下抗青枯病的特异性相关基因CaMgst3[10]转录表达水平显著上调,初步证实CaRPT2在高温高湿下辣椒应答青枯菌侵染的防御反应中起正调节作用,但CaRPT2是如何从参与植物生长发育转而参与免疫过程,以及是否受上游信号的激活还有待进一步探索。
| [1] | 刘东辉, 张海旺, 李屹. 不同植物伴生对辣椒生长和根际土壤养分影响评价分析[J/OL]. 甘肃农业大学学报. (2023-03-10)[2023-07-03]. http://kns.cnki.net/kcms/detail/62.1055.S.20230310.1147.002.html. |
| [2] | 陶兴林, 朱惠霞, 王晓巍, 等. 5个不同产区地理标志辣椒营养成分分析[J]. 食品安全质量检测学报, 2023, 14(3): 303–310. |
| [3] | THERA A T, JACOBSEN B J, NEHER O T. Bacterial wilt of solanaceae caused by Ralstonia solanacearum race 1 biovar 3 in Mali[J]. Plant Disease, 2010, 94(3): 372. |
| [4] | ROBERTS D P, DENNY T P, SCHELL M A. Cloning of the egl gene of Pseudomonas solanacearum and analysis of its role in phytopathogenicity[J]. Journal of Bacteriology, 1988, 170(4): 1445–1451. DOI: 10.1128/jb.170.4.1445-1451.1988 |
| [5] | MANSFIELD J, GENIN S, MAGORI S, et al. Top 10 plant pathogenic bacteria in molecular plant pathology[J]. Molecular Plant Pathology, 2012, 13(6): 614–629. DOI: 10.1111/j.1364-3703.2012.00804.x |
| [6] | YUAN M H, NGOU B P M, DING P T, et al. PTI-ETI crosstalk: an integrative view of plant immunity[J]. Current Opinion in Plant Biology, 2021, 62: 102030. DOI: 10.1016/j.pbi.2021.102030 |
| [7] | KIM J H, CASTROVERDE C D M, HUANG S, et al. Increasing the resilience of plant immunity to a warming climate[J]. Nature, 2022, 607(7918): 339–344. DOI: 10.1038/s41586-022-04902-y |
| [8] | YUAN P G, POOVAIAH B W. Interplay between Ca2+/calmodulin-mediated signaling and AtSR1/CAMTA3 during increased temperature resulting in compromised immune response in plants[J]. International Journal of Molecular Sciences, 2022, 23(4): 2175. DOI: 10.3390/ijms23042175 |
| [9] | GANGAPPA S N, BERRIRI S, KUMAR S V. PIF4 coordinates thermosensory growth and immunity in Arabidopsis[J]. Current Biology, 2017, 27(2): 243–249. DOI: 10.1016/j.cub.2016.11.012 |
| [10] | YANG S, CAI W W, SHEN L, et al. Solanaceous plants switch to cytokinin-mediated immunity against Ralstonia solanacearum under high temperature and high humidity[J]. Plant, Cell & Environment, 2022, 45(2): 459–478. |
| [11] | WAKSMAN T, SUETSUGU N, HERMANOWICZ P, et al. Phototropin phosphorylation of ROOT PHOTOTROPISM 2 and its role in mediating phototropism, leaf positioning, and chloroplast accumulation movement in Arabidopsis[J]. The Plant Journal, 2023, 114(2): 390–402. DOI: 10.1111/tpj.16144 |
| [12] | LISCUM E, ASKINOSIE S K, LEUCHTMAN D L, et al. Phototropism: growing towards an understanding of plant movement[J]. The Plant Cell, 2014, 26(1): 38–55. DOI: 10.1105/tpc.113.119727 |
| [13] | CHRISTIE J M, SUETSUGU N, SULLIVAN S, et al. Shining light on the function of NPH3/RPT2-like proteins in phototropin signaling[J]. Plant Physiology, 2018, 176(2): 1015–1024. DOI: 10.1104/pp.17.00835 |
| [14] | KIMURA T, TSUCHIDA-MAYAMA T, IMAI H, et al. Arabidopsis ROOT PHOTOTROPISM2 is a light-dependent dynamic modulator of phototropin1[J]. The Plant Cell, 2020, 32(6): 2004–2019. DOI: 10.1105/tpc.19.00926 |
| [15] | YANG S, CAI W W, WU R J, et al. Differential CaKAN3-CaHSF8 associations underlie distinct immune and heat responses under high temperature and high humidity conditions[J]. Nature Communications, 2023, 14(1): 4477. DOI: 10.1038/s41467-023-40251-8 |
| [16] | CAI W W, YANG S, WU R J, et al. CaSWC4 regulates the immunity-thermotolerance tradeoff by recruiting CabZIP63/CaWRKY40 to target genes and activating chromatin in pepper[J]. PLoS Genetics, 2022, 18(2): e1010023. DOI: 10.1371/journal.pgen.1010023 |
| [17] | HUANG Y, CAI W W, LU Q L, et al. PMT6 is required for SWC4 in positively modulating pepper thermotolerance[J]. International Journal of Molecular Sciences, 2023, 24(5): 4849. DOI: 10.3390/ijms24054849 |
 2023,Vol. 19
2023,Vol. 19


