文章信息
- 颜沛沛, 叶炜, 江金兰, 王培育
- YAN Peipei, YE Wei, JIANG Jinlan, WANG Peiyu
- 金钗石斛花香气日变化规律
- Diurnal variation of floral scents emitted from Dendrobium nobile Lindl.
- 亚热带农业研究, 2021, 17(3): 179-183
- Subtropical Agriculture Research, 2021, 17(3): 179-183.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2021.03.006
-
文章历史
- 收稿日期: 2021-07-13
金钗石斛(Dendrobium nobile Lindl.)为兰科石斛属多年生附生草本植物[1],是我国传统名贵药材,具有滋阴清热、明目生津、润肺养胃等功效[2]。金钗石斛花色艳丽、花姿优美、花气清香,具有较高的观赏价值;其花味轻清,善疏达,可作茶饮[3]。香气是评价植物品质的重要指标之一。不同的植物香气包含的化学成分不同,这些成分具有抗炎、抗氧化[4]、抗菌驱虫[5]、抗癌[6]、镇静解郁等作用,已广泛应用于食品、化妆品、医药等领域[7]。有关石斛属植物香气成分的分析已见报道,主要为烯萜类、醛类、酯类等物质,如报春石斛花的主要香气成分是醋酸辛酯[8];细叶石斛和翅梗石斛花的主要香气成分是罗勒烯[9];美花石斛花主要香气成分是乙酸-2-乙基己酯[10]。近年来,无度挖采使野生石斛资源几近枯竭,提高石斛资源利用率,扩大其药用部位是当前亟待解决的问题。因此,本试验采用静态顶空气相色谱—质谱(GC-MS)联用技术,分别检测金钗石斛花盛开期一天内6个时间点的香气成分,探讨金钗石斛花香气释放的日变化规律,以期为花的采摘和开发利用提供参考。
1 材料与方法 1.1 材料金钗石斛花采自三明市农业科学研究院药用所石斛大棚。试验仪器包括Agilent 5977B-7890B气相色谱—质谱联用仪及Agilent 7697A进样器(美国Agilent Technologies公司)。
1.2 方法试验时间为2021年5月21日,选择当天的6:00、9:00、12:00、15:00、18:00、21:00共6个时间点采摘新鲜完整的花朵,放入顶空瓶,检测其香气成分。检测方法参考文献[5],每个时间点重复3次。通过NIST14谱库检索和人工解析图谱进行定性分析;根据离子流峰面积归一法计算香气成分的相对含量。
2 结果与分析 2.1 金钗石斛花不同时间点香气峰面积分析金钗石斛花香气成分总离子流色谱图见图 1。不同时间点金钗石斛花香气成分总峰面积差异明显,表明其香气释放量呈动态变化。总峰面积排序依次为:9:00(48.68%)>6:00(19.23%)>21:00(17.40%)>18:00(10.36%)>12:00(3.05%)>15:00(1.28%)。香气成分总峰面积在6:00~9:00间不断升高,9:00时达到最高,9:00~15:00开始下降,15:00时最低,15:00~21:00又逐渐回升。可见,金钗石斛花近50%的香气在12:00之前释放,12:00时香气释放量急剧降低,在15:00时达到最低。因此,金钗石斛花香气最浓郁的时间在早上9:00左右,是金钗石斛花最佳观赏、采摘时间。
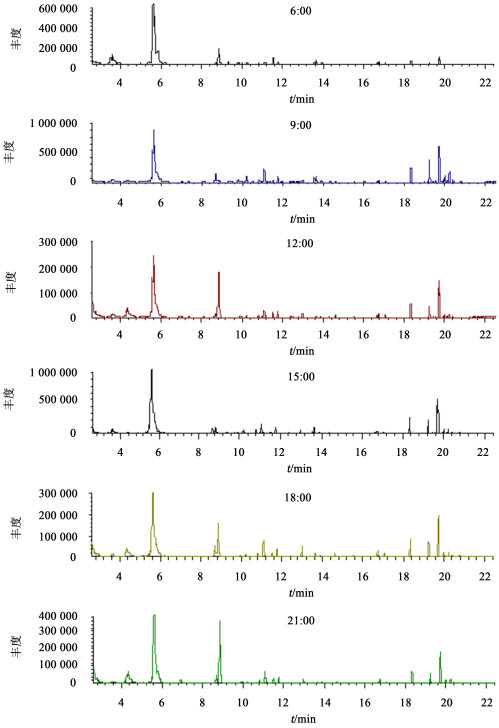
|
图 1 金钗石斛花不同时间点香气成分总离子流色谱图 Figure 1 Total ion chromatogram of volatile components from D.nobile at different time points |
从金钗石斛花6个时间点样品中共检测出104种香气成分,不同时间点样品香气成分组成及含量不同,表明其一天中释放的香气成分也呈动态变化。金钗石斛花不同时间点主要香气成分见表 1。(1)6:00。共检测出15种香气成分,其中醛类2种(74.34%)、烯类10种(22.38%)、烷类3种(3.28%);相对含量大于5%的香气成分包括己醛(60.01%)、戊醛(14.33%)、α-派烯(9.71%)。(2)9:00。共检测出36种香气成分,其中醛类3种(45.07%)、烯类15种(42.27%)、烷类3种(0.90%);相对含量大于5%的香气成分包括己醛(42.61%)、1H-3a, 7-甲基芴, 八氢-1, 9, 9-三甲基-4-亚甲基-, (1α, 3aα, 7α, 8aβ)-(8.03%)、(1R, 3As, 8aS)-1, 4, 4, 6-四甲基-1, 2, 3, 3a, 4, 5, 7, 8-八氢环戊[c]戊烯(7.87%)、α-愈疮木烯(5.17%)。(3)12:00。共检测出52种香气成分,其中醛类6种(52.97%)、烯类29种(36.80%)、醇类5种(4.63%);相对含量大于5%的香气成分包括己醛(48.13%)、绿叶烯(6.59%)、(1R, 3As, 8aS)-1, 4, 4, 6-四甲基-1, 2, 3, 3a, 4, 5, 7, 8-八氢环戊[c]戊烯(5.19%)。(4)15:00。共检测出45种香气成分,其中烯类23种(44.30%)、醛类2种(40.22%)、醇类7种(3.90%);相对含量大于5%的香气成分包括己醛(39.70%)、(1s)-2, 6, 6-三甲基双环[3.1.1]庚-2-烯(10.92%)、绿叶烯(6.69%)、2-甲基-1-丁醇(6.20%)、(1R, 3As, 8aS)-1, 4, 4, 6-四甲基-1, 2, 3, 3a, 4, 5, 7, 8-八氢环戊[c]戊烯(5.31%)。(5)18:00。共检测出14种香气成分,其中醛类1种(38.12%)、烯类11种(51.35%)、醇类1种(7.16%);相对含量大于5%的香气成分包括己醛(38.12%)、(1s)-2, 6, 6-三甲基双环[3.1.1]庚-2-烯(22.47%)、绿叶烯(9.12%)、2-甲基-1-丁醇(7.16%)、(1R,3As,8aS)-1, 4, 4, 6-四甲基-1, 2, 3, 3a, 4, 5, 7, 8-八氢环戊[c]戊烯(6.82%)。(6)21:00。共检测出43种香气成分,其中醛类3种(39.84%)、烯类22种(43.52%)、酯类5种(3.45%);相对含量大于5%的香气成分包括己醛(39.22%)、(1s)-2, 6, 6-三甲基双环[3.1.1]庚-2-烯(19.53%)、2-甲基-1-丁醇(8.04%)。6个时间点都检测出的化合物包括:己醛、γ-萜品烯、茶螺烷、双环[3.1.0]己-2-烯,2-甲基-5-(1-甲基乙基)-、(1R, 3As, 8aS)-1, 4, 4, 6-四甲基-1, 2, 3, 3a, 4, 5, 7, 8-八氢环戊[c]戊烯。
| 时间 | 化学成分 | 相对含量/% |
| 6:00 | 己醛 | 60.01 |
| 戊醛 | 14.33 | |
| α-派烯 | 9.71 | |
| 1, 3, 6-辛三烯, 3, 7-二甲基-, (Z) | 3.56 | |
| 9:00 | 己醛 | 42.61 |
| 1H-3a, 7-甲基芴, 八氢-1, 9, 9-三甲基-4-亚甲基-, (1α, 3aα, 7α, 8aβ)- | 8.03 | |
| (1R, 3As, 8aS)-1, 4, 4, 6-四甲基-1, 2, 3, 3a, 4, 5, 7, 8-八氢环戊[c]戊烯 | 7.87 | |
| α-愈疮木烯 | 5.17 | |
| D-柠檬烯 | 4.59 | |
| 双环[3.1.0]己-2-烯, 2-甲基-5-(1-甲基乙基)- | 3.97 | |
| 4, 7-甲基芴, 1, 2, 3, 4, 5, 6, 7, 8-八氢-1, 4, 9, 9-四甲基-, [1S-(1α, 4α, 7α)]- | 3.52 | |
| 12:00 | 己醛 | 48.13 |
| 绿叶烯 | 6.59 | |
| (1R, 3As, 8aS)-1, 4, 4, 6-四甲基-1, 2, 3, 3a, 4, 5, 7, 8-八氢环戊[c]戊烯 | 5.19 | |
| 戊醛 | 3.82 | |
| 4, 7-甲基芴, 1, 2, 3, 4, 5, 6, 7, 8-八氢-1, 4, 9, 9-四甲基-, [1S-(1α, 4α, 7α)]- | 3.32 | |
| D-柠檬烯 | 3.20 | |
| 2-甲基丁-3-烯-2-醇 | 3.05 | |
| 15:00 | 己醛 | 39.70 |
| (1s)-2, 6, 6-三甲基双环[3.1.1]庚-2-烯 | 10.92 | |
| 绿叶烯 | 6.69 | |
| 2-甲基-1-丁醇 | 6.20 | |
| (1R, 3As, 8aS)-1, 4, 4, 6-四甲基-1, 2, 3, 3a,4, 5, 7, 8-八氢环戊[c]戊烯 | 5.31 | |
| D-柠檬烯 | 4.47 | |
| 双环[3.1.0]己-2-烯,2-甲基-5-(1-甲基乙基)- | 3.33 | |
| 18:00 | 己醛 | 38.12 |
| (1s)-2, 6, 6-三甲基双环[3.1.1]庚-2-烯 | 22.47 | |
| 绿叶烯 | 9.12 | |
| 2-甲基-1-丁醇 | 7.16 | |
| (1R, 3As, 8aS)-1, 4, 4, 6-四甲基-1, 2, 3, 3a, 4, 5, 7, 8-八氢环戊[c]戊烯 | 6.82 | |
| 4, 7-甲基芴, 1, 2, 3, 4, 5, 6, 7, 8-八氢-1, 4, 9, 9-四甲基-, [1S-(1α, 4α, 7α)]- | 3.38 | |
| 21:00 | 己醛 | 39.22 |
| (1s)-2, 6, 6-三甲基双环[3.1.1]庚-2-烯 | 19.53 | |
| 2-甲基-1-丁醇 | 8.04 | |
| 1H-3a, 7-甲基芴, 八氢-1, 9, 9-三甲基-4-亚甲基-, (1α, 3aα, 7α, 8aβ)- | 4.81 | |
| (1R, 3As, 8aS)-1, 4, 4, 6-四甲基-1, 2, 3, 3a, 4, 5, 7, 8-八氢环戊[c]戊烯 | 3.62 |
综合来看,各时间点释放的香气成分中种类最多的是化学性质不稳定的烯类,主要包括α-蒎烯、D-柠檬烯、绿叶烯、2, 6, 6-三甲基双环[3.1.1]庚-2-烯等;含量最高的是醛类,主要是己醛。因此,己醛是金钗石斛花香气成分中的主要挥发性物质。
3 讨论与结论本研究表明,金钗石斛花香气释放量日变化呈先升高后降低再升高趋势。这与已报道的其他花香气的释放规律不同,如报春石斛花香气释放量呈先下降后升高趋势,6:00时释放量最高,后逐渐降低,18:00时最低,21:00则又升高[5];鼓槌石斛花香气总释放量日变化呈先上升后下降的趋势,14:00时达到最大值[11];山桃花香气的总体释放趋势与金钗石斛相似,均是先升高后降低再升高,但山桃花香气在15:00时达到最高,而金钗石斛花香气在15:00时最低[12]。植物香气释放规律多与其自身昼夜节律及环境因素有关,金钗石斛花香气释放在9:00左右达到最高,可能是由于该时间温度和光照最佳,随着温度持续升高及光照持续加强,其气孔逐渐关闭,香气释放随之减少,直到15:00达到最低水平,15:00之后气温和光照逐渐减弱,又达到适合香气释放的环境条件,释放量开始增加。因此,金钗石斛花香气释放在9:00~15:00急剧减少可能与光照强度和温度有关,而15:00后开始升高,则可能是因为气孔逐渐打开后释放量增加。
目前,有关金钗石斛花香气成分的检测结果存在明显差异。郑家欢等[13]采用水蒸气蒸馏法提取金钗石斛花挥发油成分,鉴定其主要挥发性成分为反式-2-庚烯醛(12.89%)、α-雪松醇(8.71%)、芳樟醇(7.60%)等,而这几种成分本研究均未检测出;宋小蒙等[14]利用顶空固相微萃取法检测表明,金钗石斛花的主要挥发性成分为柠檬烯(25.87%);水蒸气蒸馏法提取的主要挥发性成分为亚油酸(36.92%),而本研究6:00时未检测出柠檬烯,9:00时柠檬烯含量最高(为4.59%)。说明植物香气成分的化学性质不稳定,在检测过程中易受到检测方法、提取方法、采样时间等因素的影响。且不同传粉昆虫对花香具有不同的偏好[15],这也可能是不同地区金钗石斛花香气成分不同的原因。
金钗石斛花香气中的多种成分用途广泛。百分含量最高的己醛是许多植物的主要挥发性物质,可抑制植物病菌、保持果蔬贮藏品质[16],也可用于食用香料以及橡胶、树脂、杀虫剂的有机合成,是美国食品和药物管理局[17]及我国《食品添加剂使用标准》[18]批准使用的食品添加剂。α-蒎烯具有杀虫、抑菌、抗炎等功效,且对体外培养的HepG2、C6与SGC-7901肿瘤细胞均有较强的抑制作用[19]。D-柠檬烯可通过PPARQt、LxRD信号通路调节由高脂膳食诱导的肥胖小鼠的糖脂代谢紊乱[20],还具有免疫调节作用,可以缓解高脂饮食引起的脂肪肝[21-22]。此外,D-柠檬烯是具有天然杀虫活性的单萜化合物,在本研究中除6:00外所有时间点均检测出,因此其释放规律或与昆虫的活动有关[23]。α-萜品烯可在土荆芥中通过诱导氧化起化感作用[24],γ-萜品烯在体内外均表现出一定的抗氧化作用[25]。综合来看,金钗石斛花具有广阔的利用前景,探讨金钗石斛花香气释放规律可为其进一步开发利用提供参考。
| [1] | 张艳磊, 何晓然, 刘园园, 等. 金钗石斛多糖对高糖诱导的大鼠肾系膜细胞氧化应激的影响[J]. 时珍国医国药, 2013, 24(1): 7–9. |
| [2] | 谢苗苗, 肖柳, 杨磊, 等. 金钗石斛多糖的分离纯化及其抗衰老活性研究[J]. 中国现代中药, 2018, 20(12): 1489–1493. |
| [3] | 胡志刚, 梁欢, 卢金清, 等. 金钗石斛茎和花中石斛碱的含量比较研究[J]. 中国药师, 2014, 17(8): 1303–1305. DOI: 10.3969/j.issn.1008-049X.2014.08.016 |
| [4] | 袁媛, 孙叶, 李风童, 等. 蕙兰不同品种花香成分分析[J]. 江苏农业科学, 2019, 47(16): 186–189. |
| [5] | ZU Y G, YU H M, LIANG L, et al. Activities of ten essential oils towards Propionibacterium acnes and PC-3, A-549 and MCF-7 cancer cells[J]. Molecules, 2010, 15(5): 3200–3210. DOI: 10.3390/molecules15053200 |
| [6] | GAUTAM N, MANTHA A K, MITTAL S. Essential oils and their constituents as anticancer agents: a mechanistic view[J]. BioMed Research International, 2014, 2014: 154106. |
| [7] | CANNAS S, USAI D, PINNA A, et al. Essential oils in ocular pathology: an experimental study[J]. Journal of Infection in Developing Countries, 2015, 9(6): 650–654. DOI: 10.3855/jidc.6842 |
| [8] | 颜沛沛, 叶炜, 江金兰. 报春石斛花香气成分及其日变化规律[J]. 亚热带植物科学, 2020, 49(3): 168–174. |
| [9] | 王元成, 曾艺芸, 李振坚, 等. 细叶石斛和翅梗石斛花朵赋香成分的GC-MS分析[J]. 林业科学研究, 2020, 33(3): 116–123. |
| [10] | 袁明焱, 王雅琴, 李一泽, 等. 基于SPME-GC-MS法分析美花石斛花的香气组成[J]. 香料香精化妆品, 2018(4): 23–25, 69. |
| [11] | 黄昕蕾, 郑宝强, 王雁. 鼓槌石斛不同花期香气成分及盛花期香气日变化规律研究[J]. 林业科学研究, 2018, 31(4): 142–149. |
| [12] | 王春玲, 李小龙, 胡增辉, 等. 山桃花香气的日变化规律[J]. 黑龙江农业科学, 2015(3): 55–60. |
| [13] | 郑家欢, 吴观健, 吴岳滨, 等. GC-MS分析金钗石斛花挥发油成分[J]. 中药材, 2016, 39(8): 1797–1799. |
| [14] | 宋小蒙, 王洪新, 马朝阳, 等. GC-MS分析金钗石斛花挥发性成分[J]. 食品与生物技术学报, 2019, 38(9): 133–138. |
| [15] | RAY H A, STUHL C J, GILLETT-KAUFMAN J L. Floral fragrance analysis of Prosthechea cochleata (Orchidaceae), an endangered native, epiphytic orchid, in Florida[J]. Plant Signaling & Behavior, 2018, 13(1): e1422461. |
| [16] | 蔡普默, 仪传冬, 季清娥, 等. 寄主水果11种挥发性成分对斑翅果蝇的引诱效果[J]. 福建农林大学学报(自然科学版), 2019, 48(3): 285–290. |
| [17] | 王培育, 郑世仲, 叶炜, 等. 文心兰挥发性成分的GC-MS分析[J]. 亚热带农业研究, 2020, 16(3): 175–179. |
| [18] | 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品添加剂使用标准: GB 2760-2014[S]. 北京: 中国标准出版社, 2014. |
| [19] | 朱福鸿. α-蒎烯抑制HepG2细胞增殖及相关机制研究[D]. 广州: 广东药学院, 2015: 67. |
| [20] | 王东风, 梁惠, 王文成. D-柠檬烯对大鼠酒精性肝损伤脂质代谢紊乱的影响[J]. 食品科学, 2015, 36(5): 163–167. |
| [21] | 邱小梅, 熊宝林, 陈石. 气相色谱内标法测定d-柠檬烯含量[J]. 云南化工, 2019, 46(2): 89–90. |
| [22] | 靖丽. 柑橘精油的代谢图谱及其主要成分d-柠檬烯对糖脂代谢紊乱的防治作用研究[D]. 重庆: 西南大学, 2014: 148. |
| [23] | 伦演鹏, 田伟金, 杨悦屏, 等. d-柠檬烯混合油剂对红火蚁的毒力及灭巢效果[J]. 广东农业科学, 2016, 43(7): 93–99. |
| [24] | 王亚男, 杨军, 朱晓换, 等. α-萜品烯和对伞花素在土荆芥诱导氧化损伤中的作用[J]. 西南农业学报, 2016, 29(6): 1302–1306. |
| [25] | 甘芝霖, 倪元颖. γ-萜品烯的体内外抗氧化性研究[J]. 食品工业科技, 2019, 40(6): 100–105, 113. |
 2021,Vol. 17
2021,Vol. 17


