文章信息
- 王培育, 郑世仲, 叶炜, 江金兰, 颜沛沛, 李永清, 林玉玲
- WANG Peiyu, ZHENG Shizhong, YE Wei, JIANG Jinlan, YAN Peipei, LI Yongqing, LIN Yuling
- 铁皮石斛与金钗石斛杂交及回交后代的SSR鉴定
- Identification of (Dendrobium catenatum×D.nobile) F1 hybrids and their backcross progenies by SSR markers
- 亚热带农业研究, 2019, 15(4): 251-256
- Subtropical Agriculture Research, 2019, 15(4): 251-256.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2019.04.007
-
文章历史
- 收稿日期: 2019-10-28
2. 福建省三明市农业科学研究院, 福建 沙县 365000;
3. 宁德师范学院生命科学学院, 福建 宁德 352100
2. Fujian Province SanmingAcademy of Agricultural Sciences, Shaxian, Fujian 365000, China;
3. College of Life Sciences, Ningde Normal University, Ningde, Fujian 352100, China
石斛属(Dendrobium)植物兼具观赏和药用价值[1],其中铁皮石斛(D.catenatum)和金钗石斛(D.nobile)是较为普遍推广的2个种。铁皮石斛是药用植物中应用最广的石斛属植物之一,具有多种生物活性物质[2-4];因其烘干呈螺旋“枫斗”状而备受推崇[5-7]。金钗石斛以茎入药,性寒、味甘,具益胃生津、滋阴清热等功效,已被列为重点保护中药材[8]。野生石斛自然繁殖率低,对生长环境要求极为严苛,长期的过度采挖使野生石斛资源逐渐枯竭[9]。目前,市场上石斛种质资源丰富且缺乏有效的鉴定技术,导致石斛品种选育严重滞后,石斛产业发展遭遇瓶颈[10]。种质资源是品种选育的基础,鉴定和分析石斛种间尤其是人工杂交后代的遗传背景成为必需步骤。DNA分子标记技术广泛应用于植物遗传关系多样性的分析,ISSR、RAPD、AFLP和SRAP等分子标记技术被广泛用于石斛分类和进化分析[11-14],但其应用受到数量和多态性影响,在可用标记的数量、基因组覆盖、多态性区分和重复性等方面受到限制。
随着新一代测序技术的发展,铁皮石斛的全基因组序列测序已完成,简单重复序列标记(simple sequence repeat, SSR)在石斛上开发和应用也逐渐增加[15-16]。SSR标记多态性高、重复性好、呈共显性遗传模式、PCR检测方便并且能够良好覆盖基因组,在种质资源鉴定、遗传多样性等研究中发挥重要作用[17-18]。SSR标记已应用于石斛属不同种间、种内亲缘关系研究以及杂种鉴定[19],但对铁皮石斛与金钗石斛杂交及回交未见报道。本研究对铁皮石斛与金钗石斛的杂交F1代植株及以铁皮石斛为母本回交后代植株进行鉴定,对于提高育种效率与丰富种质资源具有重要意义。
1 材料与方法 1.1 试验材料以铁皮石斛和金钗石斛为亲本,通过人工授粉进行杂交,建立无菌系进行单株株系分离,获得杂交后代植株。进一步以铁皮石斛为母本,选取1株杂交后代为父本,通过人工授粉进行回交,建立无菌系获得回交后代单株株系。随机抽取14株杂交F1代(编号为1~14)和18株回交1代(编号为15~32),植株的嫩叶样品保存于-20 ℃冰箱备用。试验材料均取自福建省三明市农业科学研究院。
1.2 试验方法 1.2.1 DNA的提取与检测采用改良SDS方法提取叶片DNA[20],用酶标仪检测DNA浓度,利用浓度为1.5%琼脂糖凝胶电泳检测DNA纯度,并将各样品稀释至10 ng·mL-1,保存于4 ℃冰箱待后续试验使用。
1.2.2 SSR引物获得选取24对SSR引物(表 1),其中21对引物由李永清等[21]提供,其中3对参考刘玉洋等[9]的方法合成。以上引物均由北京六合华大基因科技股份有限公司合成。
| 编号 | 引物 | 序列(5′→3′) | 目的片段/bp | |
| 1 | DR31 | F:AGAGGGAGAGTGCAAGAG | R:CGCTATTTCCATCCCTCC | 219~230 |
| 2 | OA07 | F:CCTATCCGAGGAGAACCATAA | R:AAGCTTTGAGATTCTTTTGTGACT | 160~174 |
| 3 | OA08 | F:AGGCAAAATATAACATACCTCAAT | R:AATCAAGCCATTTATCTCCTCT | 166~180 |
| 4 | OA12 | F:GCATTCTTTTGCCTAATTCAGGAA | R:TCCACCCTTTCATCCAAATACTTC | 163~287 |
| 5 | OA15 | F:ACAGCGTTAACATAAACCATAAGC | R:CTGCCCGCAGATTCAGC | 221~277 |
| 6 | OA18 | F:GGAACGGAGAAGATTAAGACAACC | R:TGCCCTCACATGCCGTATT | 179~217 |
| 7 | OA20 | F:CATATATTAGCCACTTCACTCTC | R:ATGTCCACCTCCCTAAAATAGTA | 222~266 |
| 8 | OA24 | F:GAGCAACGGGAGGGATAGAGATAT | R:ACCTCTGTCTCCCTCTTGTCCATC | 313~351 |
| 9 | OA25 | F:GGAAGGGCCTAAGTGGATG | R:GCGTACCATGCTTAACATTCA | 139~181 |
| 10 | S122 | F:GTGACTCGAGCCTTGGAATACG | R:ACGCCGGTGAAAGAAGAAGAG | 187~205 |
| 11 | S130 | F:CTCATGCATAAATTTAGGGTAGA | R:ACAACACGAACAAGTAGTCATC | 310~328 |
| 12 | DM2 | F:GAGTCGTAAGAGGCGAGTTGT | R:AATGGATGGTATCTATGTCCGTAT | 276~310 |
| 13 | DM3 | F:CTCCGGCGCTAGCTGTTGC | R:TCACTTGCGGATGGGGAGC | 178~200 |
| 14 | DM88 | F:AGCATTTTGAGATGGGATGATC | R:ATTGTCCTCGCCGATATGAGTA | 190~230 |
| 15 | DM81 | F:CTCCAATACCGATATGCTG | R:TCGGCTACAGGTAAGTGG | 100~115 |
| 16 | DM123 | F:ATAGTGGGATAAAGGCTTG | R:ATCAGTATCCACAACATTTA | 180~210 |
| 17 | DM137 | F:CTGACTGAGGTGCAGAGGTTTG | R:CCTGATGATGAGTATGAAGAGCC | 130~160 |
| 18 | DM178 | F:TCCTCCAGCTTAACACCATCA | R:CGCCACCCTACACTAAGAAAA | 290~310 |
| 19 | DM186 | F:GCCTTCTACAGCACGGGTCT | R:GGAATCTGAAACCAGGAGGC | 180~280 |
| 20 | DM198 | F:AAAAGCACTCAAAGACAAAATCAA | R:GATGAGTGAGGGATGGGTGC | 210~270 |
| 21 | DM199 | F:GTGTCTGCCCGAGTAAAAGC | R:AGCTCACGGTTACCAGGTCT | 216~235 |
| 22 | DNtSSR013 | F:GCCAAATTTCCTCCCAAAAT | R:GCAAGATGGGCTATGGTGAT | 255~275 |
| 23 | DNtSSR147 | F:ACGAAGACGGTTCACTCCAC | R:CACGAGAGACTTCCAGAGGC | 176~196 |
| 24 | DNtSSR150 | F:AATGATGGCGGTCGATACTC | R:TGCAGTGTCAAAGGTACCCA | 220~240 |
PCR反应体系:总体积10 mL,2×Taq Master Mix 5 mL,无菌水3.2 mL,SSR上下游引物各0.5 mL,cDNA 0.8 mL。PCR扩增程序如下:94 ℃预变性5 min,94 ℃变性1 min,引物退火温度下复性1 min,72 ℃延伸60 s,共40个循环后,72 ℃延伸10 min,PCR产物于4 ℃下保存。扩增产物在8%聚丙烯酰胺凝胶上恒压电泳(120 V,70 min),Ultra GelRed核酸染料染色20 min,取出凝胶拍照保存。
1.2.4 杂种SSR鉴定从候选的24对SSR引物中筛选出亲本均有明显条带的引物,用于杂交与回交后代的真假种鉴定。后代扩增图谱中具有父本特征的条带为真杂种,只有母本特征条带的为假杂种。
2 结果与分析 2.1 DNA检测石斛样品DNA的D260/D280值在1.80~1.99之间,用1%琼脂糖凝胶检测其DNA纯度(图 1)。从图 1可见,DNA完整性较好、纯度高、无拖带弥散现象,表明可以满足石斛SSR分子标记对DNA质量的要求。
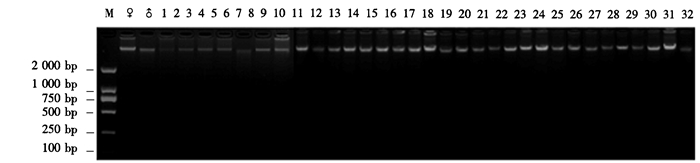
|
图 1 供试石斛总DNA检测结果 Figure 1 Test results of total Dendrobium DNA extracted from both parents, putative F1 hybrids and backcross progenies |
将24对SSR引物组合到父母本中进行扩增,筛选出13对特异性SSR引物(图 2),分别为:DNtSSR013、DNtSSR147、DNtSSR150、OA12、OA15、OA18、DM81、DM88、S122、DM123、DM178、DM186、DM199。以上引物可用于石斛杂交后代及回交后代群体真杂交种的鉴定。
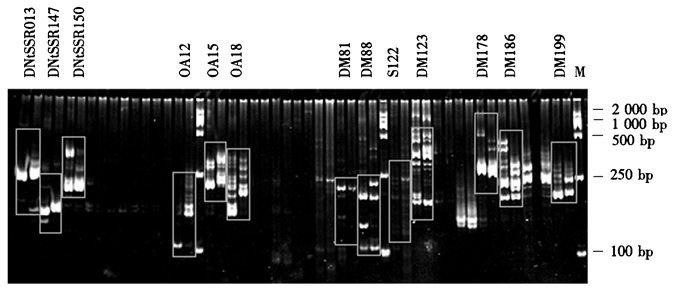
|
图 2 13对特异性SSR引物的筛选电泳 Figure 2 Electrophoregrams of amplified SSR products from 13 SSR primers screening experiments |
利用筛选的13对引物对铁皮石斛和金钗石斛两亲本、14个杂交F1代及18个回交1代进行鉴定,获得DNtSSR013、DNtSSR150、OA15和DM199共4对能够有效鉴定石斛后代群体的SSR特异性引物。通过电泳条带,可将后代群体区分为母本型、父本型、真杂交种型和缺失型。(1)引物DNtSSR013在250 bp处分别有母本和父本特征条带各1条(图 3)。在14个杂交后代中,编号1、5、7、8、11、12、14的7个单株同时具有母本和父本的特征条带,真杂交种率达到50%;编号3、4、6、9、10、13的6个单株为母本型,2号单株表现为缺失型。18个回交后代中,编号15、17、19、22、23、24、25、27、28、29、31的11个单株同时具有母本和父本的特征条带,其余7个单株均表现为父本型,真杂交种率达100%,能够扩增出母本特异条带的一共有11株,占61.1%。
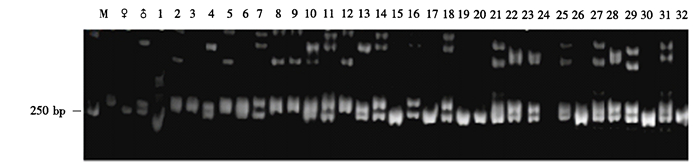
|
图 3 引物DNtSSR013对铁皮石斛×金钗石斛杂交及回交后代的扩增结果 Figure 3 PCR amplification products from (D.catenatum×D.nobile) F1 hybrids and backcross progenies by DNtSSR013 primer pair |
(2) 引物DNtSSR150在220 bp处分别有1条母本特征条带和1条父本特征条带(图 4)。14个杂交后代中,编号2、4、9、10、11、13的6个单株为真杂交种,真杂交种率达42.9%;编号5、8单株为母本型;其余6个单株为父本型。18个回交后代中,编号21、25、26、27的4个单株为真杂交种,编号15、17、20、22、23、24、28、31的8个单株为父本型,真杂交种率达66.7%,能够扩增出母本特异条带的一共有10株,占55.6%。
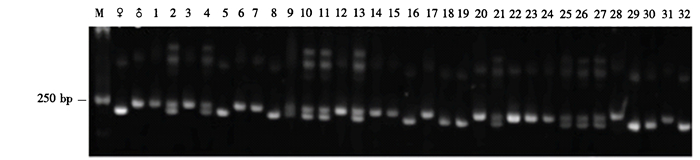
|
图 4 引物DNtSSR150对铁皮石斛×金钗石斛杂交及回交后代的扩增结果 Figure 4 PCR amplification products from (D.catenatum×D.nobile) F1 hybrids and backcross progenies by DNtSSR150 primer pair |
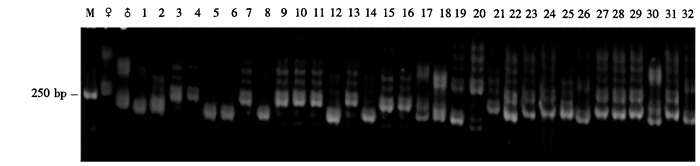
(3) 引物OA15在221~277 bp之间分别有2条母本特征条带和1条父本特征条带(图 5)。14个杂交后代中,编号3、4、7、9、10、11、13的7个单株为母本型,其余7个单株为父本型。18个回交后代中,编号17、18、22、23、24、25、27、28、29、30、31的11个单株为真杂交种;编号19、26、32的3个单株为父本型,真杂交种率达到77.8%;20号单株为缺失型,能够扩增出母本特异条带的一共有14株。
|
图 5 引物OA15对铁皮石斛×金钗石斛杂交及回交后代的扩增结果 Figure 5 PCR amplification products of (D.catenatum×D.nobile) F1 hybrids and backcross progenies by OA15 primer pair |
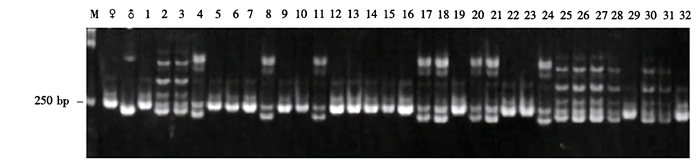
(4) 引物DM199在216~235 bp处分别有2条母本特征条带和1条父本特征条带(图 6)。14个杂交后代中,编号2、3、4、8、11的5个单株同时具有母本和父本的特征条带,真杂交种率达到35.7%,其余9个单株均为母本型。18个回交后代中,编号17、18、20、21、24、25、26、27、28、30、31的11个单株为真杂交种,真杂交种率达到61.1%,能够扩增出母本特异条带的一共有18株,占100%。
|
图 6 引物DM199对铁皮石斛×金钗石斛杂交及回交后代的扩增结果 Figure 6 PCR amplification products of (D.catenatum×D.nobile) F1 hybrids and backcross progenies by DM199 primer pair |
利用DNtSSR013、DNtSSR150、OA15和DM199这4对特异性SSR引物,均可从14个杂交群体和18个回交后代中鉴定出父本特异位点。其中,14个杂交群体中有6个单株能够同时被3对引物检测出父本特异性位点,11个单株能同时被2对引物检测出父本特异性位点,2个单株能同时被1对引物检测出父本特异位点。18个回交后代中,有7个单株能同时被4对引物检测出父本特异性位点,13个单株能同时被3对引物检测出父本特异性位点,17个单株能同时被2对引物检测出父本特异性位点,只有1个单株只能被1对引物检测出父本特异位点。综合来看,通过不同引物标记鉴定,32个后代单株群体中共有28个单株能够被检测出父本特异位点,占87.5%;回交后代中,被4对引物同时鉴定出真杂种率达到38.9%,以此认定为真性植株。
3 小结石斛种类多但遗传背景复杂,由于表观上极其相似,很难从表观上进行有效鉴别[22]。基因型丰富多样易导致石斛品种混淆直至泛滥。植物新品种的不断更替推广以及种间存在不同水平的基因流,使种质资源鉴定工作难以开展,而SSR标记技术以其自身的开发优势在植物种质鉴定方面颇见成效。SSR分子标记已经在诸多物种上进行品种选育工作的研究,如贾春兰等[23]利用设计引物开发了42对SSR引物对玉米品种真伪性、纯度进行了鉴定;Yue et al[24]从研究的42个石斛杂交品种中开发了14个SSR多态性标记,并将其用于石斛品种的鉴定。
本研究选取24对特异性SSR引物对铁皮石斛、金钗石斛2个亲本进行扩增,筛选出13对特异性SSR引物用于14个杂交F1代植株和18个回交后代植株真假杂交种的鉴定,仅有4对SSR引物能够有效对石斛后代群体进行鉴定。从32个后代单株群体中鉴定出28个真杂交种,真杂交种占后代单株群体的87.5%,并且回交后代中多数能够检测到母本的特异性条带,回交植株真杂交种率达到38.9%。以上表明,SSR分子标记能够有效对石斛后代群体进行真杂交种的鉴定,通过多引物标记的方式能够提高鉴定结果的准确性。进一步通过回交技术,能够获得回交真性植株,丰富石斛种质资源。然而,有部分后代单株表现出缺失型,推测是由于配子形成过程中发生碱基突变所引起。
| [1] | ZHENG S G, HU Y D, ZHAO R X, et al. Genome-wide researches and applications on Dendrobium[J]. Planta, 2018, 248(4): 769–784. |
| [2] | 柳俊, 邙新雨. 铁皮石斛药理作用研究综述[J]. 河南农业, 2019(3): 58–59. |
| [3] | 刘洁, 李创军, 杨敬芝, 等. 黄皮茎枝化学成分研究[J]. 中草药, 2016, 47(1): 32–37. |
| [4] | 王岩, 张海宁, 王文婧, 等. 椿皮化学成分的研究[J]. 中草药, 2012, 43(4): 649–652. |
| [5] | 沈洁琼, 徐建. 铁皮石斛、杯鞘石斛、齿瓣石斛的指纹图谱研究[J]. 浙江中医杂志, 2015, 50(7): 534–536. |
| [6] | MENG Y J, YU D L, XUE J, et al. A transcriptome-wide, organ-specific regulatory map of Dendrobium officinale, an important traditional Chinese orchid herb[J]. Scientific Reports, 2016, 6: 18864. |
| [7] | 王丛巧, 王培育, 郭艳芳, 等. 昼夜温差处理下铁皮石斛原球茎松柏苷和紫丁香苷含量的测定[J]. 热带作物学报, 2019, 40(2): 261–268. |
| [8] | 张晓敏, 孙志蓉, 陈龙, 等. 金钗石斛的化学成分和药理作用研究进展[J]. 中国现代应用药学, 2014, 31(7): 895–899. |
| [9] | 刘玉洋, 徐靖, 何金宇, 等. 铁皮石斛和金钗石斛杂交后代的分子鉴定[J]. 浙江农业科学, 2018, 59(9): 1709–1713. |
| [10] | 李霞, 何涛, 淳泽. 石斛组培苗遗传差异性ISSR检测[J]. 应用与环境生物学报, 2013, 19(2): 249–254. |
| [11] | 段媛媛, 卢超, 郭杰, 等. 铁皮石斛及霍山石斛ISSR鉴定体系的建立与优化[J]. 分子植物育种, 2019, 17(13): 4360–4366. |
| [12] | 宋爽, 周洋帆, 刘正杰, 等. 利用ISSR和AFLP标记分析石斛种质资源的遗传多样性[J]. 云南农业大学学报(自然科学), 2016, 31(4): 688–695. |
| [13] | 张杨, 陈志宽, 赖育菠, 等. 应用RAPD分子标记技术探讨3种石斛属植物的种间关系[J]. 亚热带植物科学, 2014, 43(2): 123–126. |
| [14] | 彭小凤, 何涛, 淳泽, 等. 基于叶绿体psbA-trnH和核糖体5S rRNA基因间隔区序列的石斛种间和种内鉴别[J]. 应用与环境生物学报, 2015, 21(5): 887–896. |
| [15] | Al-FAIFI S A, MIGDADI H M, AlGAMDI S S, et al. Development, characterization and use of genomic SSR markers for assessment of genetic diversity in some Saudi date palm (Phoenix dactylifera L[J]. Electronic Journal of Biotechnology, 2016, 21: 18–25. |
| [16] | 杨华, 陈琪, 韦朝领, 等. 茶树转录组中SSR位点的信息分析[J]. 安徽农业大学学报, 2011, 38(6): 882–886. |
| [17] | 杨梦婷, 黄洲, 干建平, 等. SSR分子标记的研究进展[J]. 杭州师范大学学报(自然科学版), 2019, 18(4): 429–436. |
| [18] | 张文龙, 石春杰. 美花石斛SSR-PCR体系的优化研究[J]. 种子, 2018, 37(4): 23–25. |
| [19] | 刘枫, 赵群, 戴军, 等. 霍山石斛cpDNA全序列微卫星分布及分子鉴别研究[J]. 中药材, 2016, 39(12): 2720–2724. |
| [20] | 沙丽萍. 例谈植物DNA粗提取的CTAB法、SDS法与盐析法[J]. 中学生物教学, 2018(21): 65–67. |
| [21] | 李永清, 江金兰, 叶炜, 等. SSR分子标记鉴定铁皮石斛与霍山石斛的正反交后代[J]. 福建农业学报, 2017, 32(8): 870–873. |
| [22] | 沈洁, 徐慧君, 袁英惠, 等. 铁皮石斛野生居群基于RAMP标记的遗传多样性评价[J]. 药学学报, 2011, 46(9): 1156–1160. |
| [23] | 贾春兰, 刘少坤, 柳京国, 等. SSR分子标记技术在玉米品种鉴定中的应用[J]. 农业科技通讯, 2006(4): 16–17. |
| [24] | YUE G H, LAM-CHAN L T, HONG Y, et al. Development of simple sequence repeat (SSR) markers and their use in identification of Dendrobium varieties[J]. Molecular Ecology Notes, 2006, 6(3): 832–834. |
 2019,Vol. 15
2019,Vol. 15


