文章信息
- 樊改丽
- FAN Gaili
- 棕竹炭疽病病原菌的分离鉴定
- Isolation and identification of pathogen causing anthracnose on Rhapis excelsa
- 亚热带农业研究, 2019, 15(2): 127-131
- Subtropical Agriculture Research, 2019, 15(2): 127-131.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2019.02.010
-
文章历史
- 收稿日期: 2019-03-23
炭疽菌属(Colletotrichum Corda)真菌是一类分布广泛的植物病原菌,可危害橡胶树、茶树、茉莉、辣椒、芒果等上百种植物,是多种粮食作物及经济作物的重要致病菌。胶孢炭疽菌(C.gloeosporioides)复合种分为22个种和1个亚种[1],暹罗刺盘孢菌(C.siamense)是胶孢炭疽菌复合种中的一种, 2009年由Prihastuti et al[2]从泰国健康咖啡浆果和病果上分离得到。由暹罗刺盘孢菌引起的经济作物炭疽病报道比较多,如引起的苹果[3]、草莓[4]、油茶[5]、海南台农芒果[6]、菠萝蜜[7]炭疽病等。
棕竹(Rhapis excelsa)也称观音竹、棕榈竹等,原产于我国东南和西南地区,为棕榈科棕竹属的常绿丛生灌木。现约有20种棕竹属植物,分为大叶棕竹、细叶棕竹、中叶棕竹、花叶棕竹和多裂棕竹等[8]。近年来,棕榈科植物种植越来越广泛,随之而来的棕竹病害发生也逐渐增加[9]。棕竹病害的发生不仅严重影响了棕竹的健康生长和观赏价值,同时对其他棕榈科植物造成潜在危险。而当前有关棕竹病害分离鉴定及防治的研究鲜见报道。
本文对厦门市植物园、公园及道路绿化带常见的棕竹叶斑病进行采样,采用形态学特征与分子系统发育相结合的方法进行分离鉴定,以期为棕竹炭疽病的化学防治及生物防治提供参考。
1 材料与方法 1.1 病样的采集及病原菌的分离纯化2017年7月,在厦门市植物园、公园和道路绿化带进行棕竹病害调查。采集有明显黄褐色、黑色斑点的病害叶片样品,标记后装入干净样品袋中,带回实验室进行病原菌的分离。将组织样品剪成约5 mm的组织块,放置于装有体积分数为75%酒精的烧杯中,缓慢振荡1 min,用灭菌蒸馏水冲洗3次,用无菌滤纸吸干组织表面水分,将样品放到马铃薯葡萄糖琼脂(PDA)培养基(加入0.05 g·mL-1链霉素)中,每皿放置2块。4~5 d后观察纯化平板的菌落是否为纯的单菌落。若为单菌落,则纯化完成;若不是,则继续纯化,直至每个平板上的菌落皆为单菌落。对纯化好的菌落(培养6~7 d)进行拍照后,用体积分数为25%甘油进行保菌,存于-80 ℃冰箱备用。
1.2 病原菌致病性测试取棕竹幼嫩及成熟健康的叶片,用自来水冲洗3次,用吸水纸吸干表面水分;培养皿内铺上湿润的滤纸,将叶片用接种刀轻轻刮伤表皮形成造伤叶片,将无造伤和造伤叶片放置于滤纸上;在每片叶片上接种带孢子的菌丝块(5 mm),以未接种的叶片作为对照组;盖好盖子后置于恒温光照培养箱中培养10 d,定期观察发病情况并记录结果,待发病后从病组织处再次分离病原菌。
1.3 病原菌形态学鉴定对病害叶片进行室内观察,将具有明显特征的样品(叶片正面或背面可以看见明显的小黑点等颗粒状物质)拿到体视镜(奥林巴斯SZX16)下拍照。之后进行切片和镜检,在显微镜(奥林巴斯BX-53)下观察该病原菌的形态特征,并进行拍照和测量,完成病原菌的初步鉴定。对供试菌株进行形态观察鉴定,将分离纯化的菌株进行培养、定期观察并测定生长速率;当菌丝表面出现橘黄色物质时,则该菌开始产孢,此时将菌株在体视镜下拍照;用挑针挑取产孢结构和适量孢子,在显微镜下观察菌丝形态、产孢结构、孢子形态特征,记录并进行拍照和测量。
1.4 病原菌分子生物学鉴定 1.4.1 病原菌DNA的提取及多基因PCR扩增将供试菌株在PDA培养基上培养5~7 d,收集菌丝团块,冷冻干燥后,采用DNA快速提取法提取真菌基因组DNA[10]。并对获得的DNA进行多基因PCR扩增。扩增基因包括核糖体内转录间隔区基因(ITS)、3-磷酸甘油醛脱氢酶基因(GAPDH)、肌动蛋白基因(ACT)、钙调蛋白基因(CAL)及几丁质合成酶基因(CHS-1)。扩增引物如表 1所示。扩增后5 μL PCR产物加到1%琼脂糖凝胶中进行电泳检测。当条带明亮清晰、无杂带,且条带大小与所扩基因片段大小相同时,将扩增产物回收,并送至上海铂尚生物技术有限公司进行测序。
| 基因 | 引物 | 引物序列(5′-3′) | 退火 | 片段长度/bp |
| ITS | ITS-1F | CTTGGTCATTTAGAGGAAGTAA | 56 ℃/45 s | 560 |
| ITS-4 | TCCTCCGCTTATTGATATGC | |||
| GAPDH | GDF | GCCGTCAACGACCCCTTCATTGA | 60 ℃/30 s | 240 |
| GDR | GGGTGGAGTCGTACTTGAGCATGT | |||
| CAL | CL1C | GAATTCAAGGAGGCCTTCTC | 56 ℃/60 s | 750 |
| CL2C | CTTCTGCATCATGAGCTGGAC | |||
| CHS-1 | CHS-79F | TGGGGCAAGGATGCTTGGAAGAAG | 58 ℃/30 s | 250 |
| CHS-345R | TGGAAGAACCATCTGTGAGAGTTG | |||
| ACT | ACT-521F | ATGTGCAAGGCCGGTTTCGC | 56 ℃/30 s | 250 |
| ACT-783R | TACGAGTCCTTCTGGCCCAT |
将获得的供试菌株测序序列用Bio Edit软件进行序列修正,在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中进行Blast比对,得到初步的比对结果。选用Weir et al[1]鉴定的胶孢炭疽菌复合种中的模式菌株以及从NCBI比对中选取相应种的序列作为参考序列,采用MEGA 7.0软件进行系统发育进化树的构建和注释[11]。
2 结果与分析 2.1 病原菌分离及致病性测定在厦门市植物园、公园和道路绿化带采集大叶棕竹病害样品,分离纯化出9株单菌株。9株单菌落菌株在PDA培养基上的生长速度与菌落形态特征一致,均从叶尖、叶缘及叶片中部发病,初期为褐色或黑色小斑点,随后病斑扩展形成不规则形病斑或梭形病斑,发病中期可见明显的病健交界,严重时造成叶片缺刻(图 1A)。致病性测定表明,用菌丝块接种10 d后发现造伤接种叶片有明显病斑产生(图 1B),并能从病斑处分离到与原接种菌一致的菌株,且所产生的分生孢子与原接种菌株形态、大小一致,说明供试菌株为棕竹叶斑病的病原菌;而无伤接种的叶片(CK)未表现病征(图 1C),说明供试菌株可以从伤口处侵染棕竹叶片。

|
A.自然发病;B.造伤叶片发病;C.无伤叶片(CK)。 图 1 棕竹叶片炭疽病症状 Figure 1 Leaf symptoms of R.excelsa anthracnose |
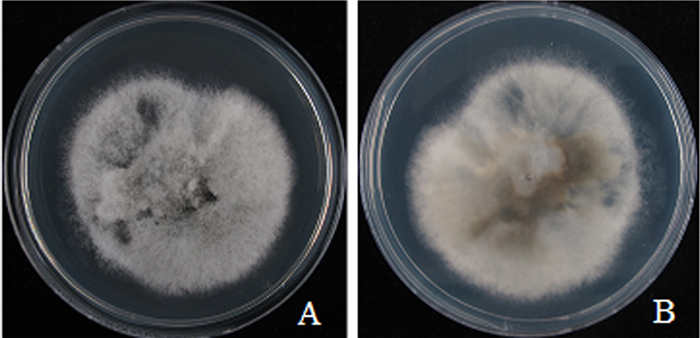
对分离菌株进行形态学特征鉴定。在PDA平板上,菌落正面菌丝为白色或灰色绒毛状,菌落中间菌丝繁茂,边缘菌丝稀疏;菌落背面白色、淡褐色、淡黄色。在光周期12 h、28 ℃条件下培养,7 d后菌落直径为4.4~5.2 cm(图 2);15 d后可在菌落表面形成肉眼可见的橘黄色分生孢子堆(图 3A)。显微镜下观察,分生孢子盘为褐色或灰褐色,分生孢子梗无色(图 3B);分生孢子为单孢、无色、长椭圆状、圆柱状、两端稍顿或一端尖顿;一些孢子内含2个油球;分生孢子大小为(12.92~15.63) μm×(4.77~5.84) μm,平均为13.93 μm×5.55 μm,长宽比为2.51(图 3C)。此鉴定结果与野外采集样品徒手切片鉴定到的菌落菌丝、分生孢子等具有相同的形态学特征。
|
A.正面;B.背面。 图 2 棕竹炭疽菌在PDA培养基上的菌落生长形态 Figure 2 Colony morphology of R.excelsa anthracnose on PDA plate |

|
A.分生孢子堆;B.分生孢子盘和分生孢子梗;C.分生孢子。 图 3 棕竹炭疽菌菌落孢子堆及孢子形态特征 Figure 3 Morphological characteristics of R.excelsa anthracnose conidiophore heaps and conidia spores |
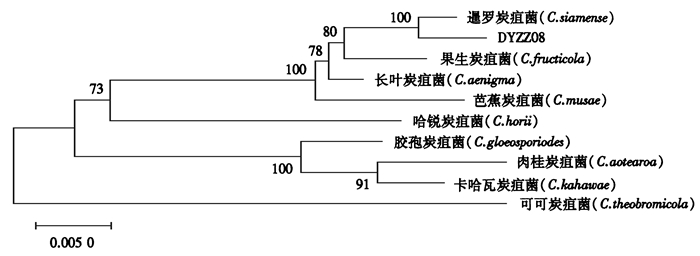
将供试菌株进行ITS基因序列扩增,并对片段测序,通过NCBI Blast同源性比对,发现病原菌株序列与胶孢炭疽菌复合种中的暹罗刺盘孢菌小种序列相似度为100%。为进一步确定鉴定结果,本研究选取真菌鉴定常用的ACT、CAL、CHS-1和GAPDH共4个单基因序列引物对病原菌进行扩增。测序结果在NCBI中进行比对表明,ACT、CAL、CHS-1和GAPDH 4个单基因序列与数据库中暹罗刺盘孢菌相似性分别为100%、99.7%、99.2%和100%。在ITS、ACT、CAL、CHS-1和GAPDH 5个基因序列的基础上,通过构建多基因系统发育树,发现病原菌菌株与暹罗刺盘孢菌株聚为一类(图 4)。结合病原菌菌落特征、显微镜下形态学特征以及分子生物学鉴定结果,本研究将棕竹炭疽病病原菌鉴定为暹罗刺盘孢菌。
|
图 4 基于ITS、ACT、CAL、CHS-1和GAPDH基因序列构建的多基因系统发育树 Figure 4 Phylogenetic tree based on the nucleotide sequences of ITS, ACT, CAL, CHS-1 and GAPDH genes |
本研究对引起厦门市植物园、公园及道路绿化带的大叶棕竹炭疽病的病原菌进行了分离与鉴定。病原菌形态学特征观察及单基因与多基因联合的系统发育分析表明,引起厦门市棕竹炭疽病的病原菌为胶孢炭疽菌复合种小种暹罗刺盘孢菌(C.siamense)。该病菌可以侵染棕榈科植物棕竹,造成棕竹炭疽病,属于国内棕榈科植物中鉴定到暹罗刺盘孢菌的首次报道。
林业和园林植物由暹罗刺盘孢菌引起的炭疽病研究相对较少。2017年李沛利等[12]鉴定了暹罗刺盘孢菌可以引起成都市园林观赏植物鹅掌柴的炭疽病;徐明珠等[13]首次分离鉴定了暹罗刺盘孢菌可引起荆州市香樟树炭疽病。吴奉奇[14]研究表明,广东省肇庆市北岭山降香黄檀、樟树、闽楠、火力楠、贝壳杉和格木炭疽病均由暹罗刺盘孢菌引起。李河等[15]研究发现,从油茶林及其附近的植被分离到的炭疽菌均可以侵染油茶,说明不同寄主植物上分离的炭疽菌均可能成为油茶炭疽病的潜在侵染源。综上表明,暹罗刺盘孢炭疽菌是一种分布广泛的真菌病害,在高温高湿的热带和亚热带地区分布更广,其寄主种类繁多,可以侵染多种植物从而引起植物炭疽病。
李沛利等[12]研究发现,暹罗刺盘孢菌侵染鹅掌柴叶片时,用砂纸擦拭鹅掌柴叶片更容易致病;刘威[16]在研究茶树炭疽病时也发现,暹罗刺盘孢菌通过伤口侵染茶树叶片。本研究致病性试验发现,在造伤接种的情况下,暹罗刺盘孢菌可以成功侵染棕竹。茶树、鹅掌柴和棕榈科植物叶片蜡质都较厚,这可能是其不容易侵染的原因。由此可见,在棕竹等园林植物栽培过程中,应尽量减少机械损伤和人为伤害,修剪枝叶的工具要经常消毒,以减少病菌侵染的几率和降低病害的流行。
致谢: 福建农林大学植物保护学院胡红莉老师对本研究病原菌测序及鉴定进行指导,谨此致谢。| [1] | WEIR B S, JOHNSTON P R, DAMM U. The Colletotrichum gloeosporioides species complex[J]. Studies in Mycology, 2012, 73: 115–180. DOI: 10.3114/sim0011 |
| [2] | PRIHASTUTI H, CAI L, CHEN H, et al. Characterization of Colletotrichum species associated with coffee berries in northern Thailand[J]. Fungal Diversity, 2009, 39: 89–109. |
| [3] | 秦瑞凤.陕西省苹果和葡萄炭疽病病原鉴定[D].杨凌: 西北农林科技大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10712-1011403184.htm |
| [4] | 韩永超, 向发云, 曾祥国, 等. 草莓根颈腐烂病的病原鉴定[J]. 中国农业科学, 2014, 47(1): 53–60. DOI: 10.3864/j.issn.0578-1752.2014.01.006 |
| [5] | 李河, 李杨, 蒋仕强, 等. 湖南省油茶炭疽病病原鉴定[J]. 林业科学, 2017, 53(8): 43–53. |
| [6] | 陈亭妤, 李聪, 周国英, 等. 海南台农芒采后果实炭疽病病原鉴定[J]. 热带作物学报, 2018, 39(7): 1396–1401. DOI: 10.3969/j.issn.1000-2561.2018.07.020 |
| [7] | 顾红杰, 郭利军, 赵亚, 等. 菠萝蜜炭疽病病原菌的形态学与多基因分子系统学鉴定[J]. 分子植物育种, 2019, 17(5): 1487–1492. |
| [8] | 赵金萍, 王炳文, 孙琪. 棕竹灰斑病病原菌生物学特性及化学防治研究[J]. 安徽农业科学, 2011, 39(26): 16013–16016. DOI: 10.3969/j.issn.0517-6611.2011.26.072 |
| [9] | 林秀香, 罗金水, 郑宴义, 等. 福建省棕榈科植物病害调查研究[J]. 中国农学通报, 2009, 25(1): 180–184. |
| [10] | 赵玲琳, 王国荣, 沈伟东, 等. 铁皮石斛炭疽病病原菌的分离鉴定及其有效杀菌剂的筛选[J]. 植物保护, 2018, 44(6): 185–190. |
| [11] | KUMAR S, STECHER G, TAMURA K. MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33(7): 1870–1874. DOI: 10.1093/molbev/msw054 |
| [12] | 李沛利, 李娟, 龚国淑, 等. 四川省鹅掌柴炭疽病病原菌的初步鉴定[J]. 植物病理学报, 2017, 47(3): 296–304. |
| [13] | 徐明珠, 罗欢, 周志雄, 等. 香樟叶斑病病原菌的分离与鉴定[J]. 中国森林病虫, 2017, 36(4): 21–25, 28. DOI: 10.3969/j.issn.1671-0886.2017.04.006 |
| [14] | 吴奉奇.几种珍贵阔叶树种炭疽病分子鉴定研究[D].广州: 华南农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10564-1016922374.htm |
| [15] | 李河, 李杨, 蒋仕强, 等. 海南省不同寄主植物炭疽病菌侵染油茶研究[J]. 植物保护, 2016, 42(4): 64–70. DOI: 10.3969/j.issn.0529-1542.2016.04.009 |
| [16] | 刘威.茶树炭疽病的病原鉴定及其遗传多样性分析[D].福州: 福建农林大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10389-1013326745.htm |
 2019,Vol. 15
2019,Vol. 15

